





《化学必修二《第三节 生活中两种常见的有机物》优秀PPT课件》是由用户上传到老师板报网,本为文库资料,大小为210.92 KB,总共有17页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 17页
- 210.92 KB
- VIP模板
- pptx
- 数字产品不支持退货
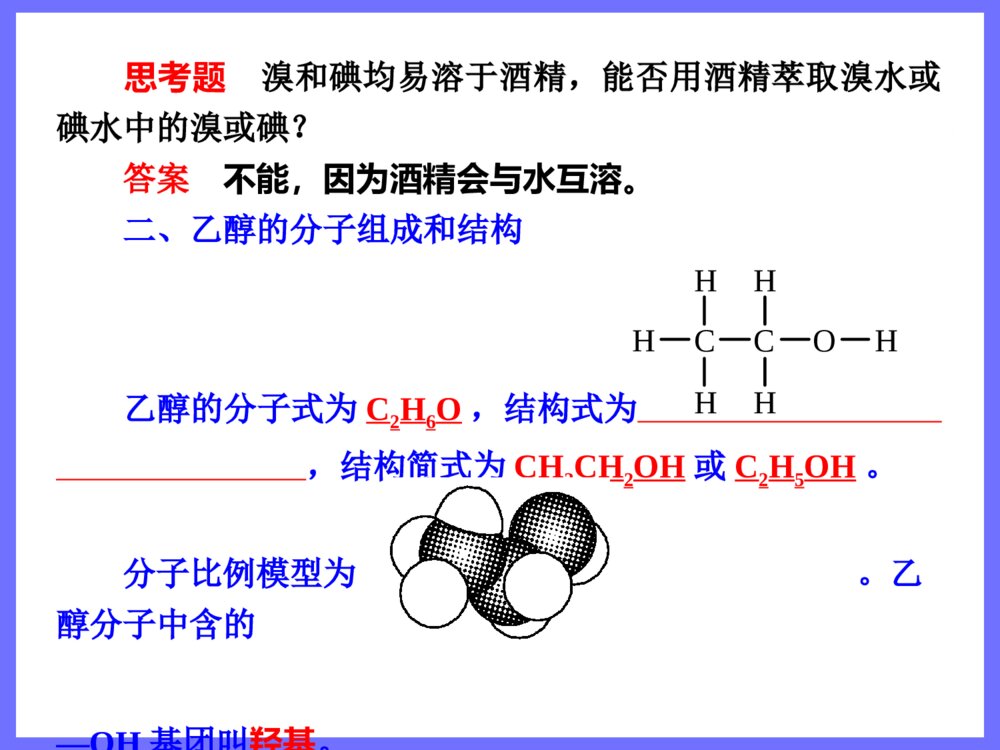
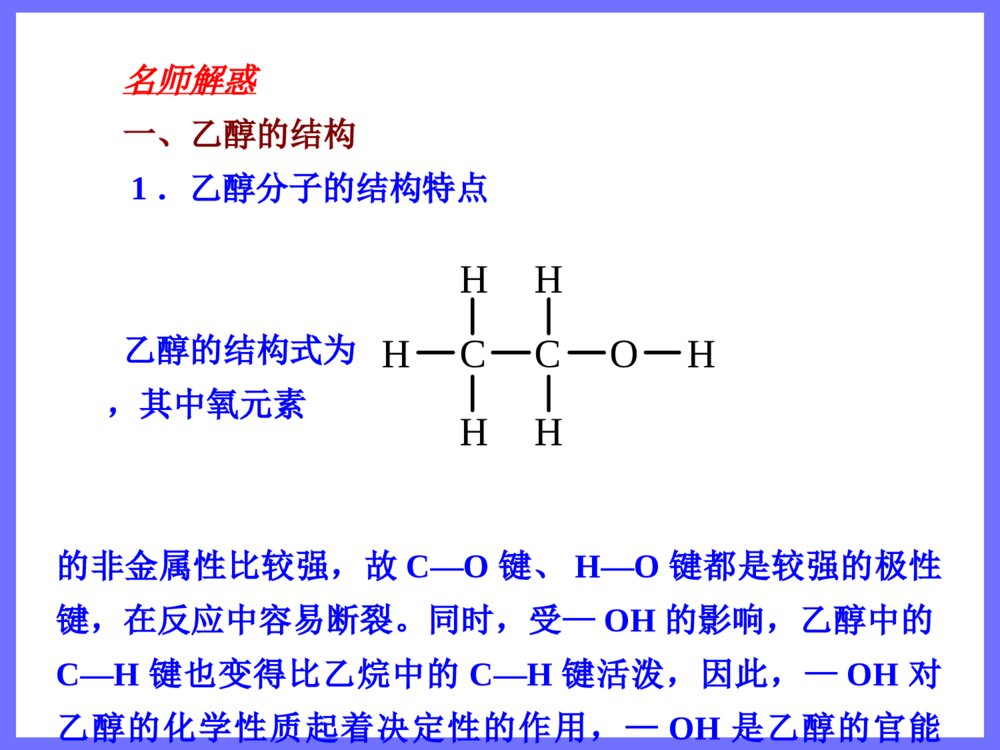
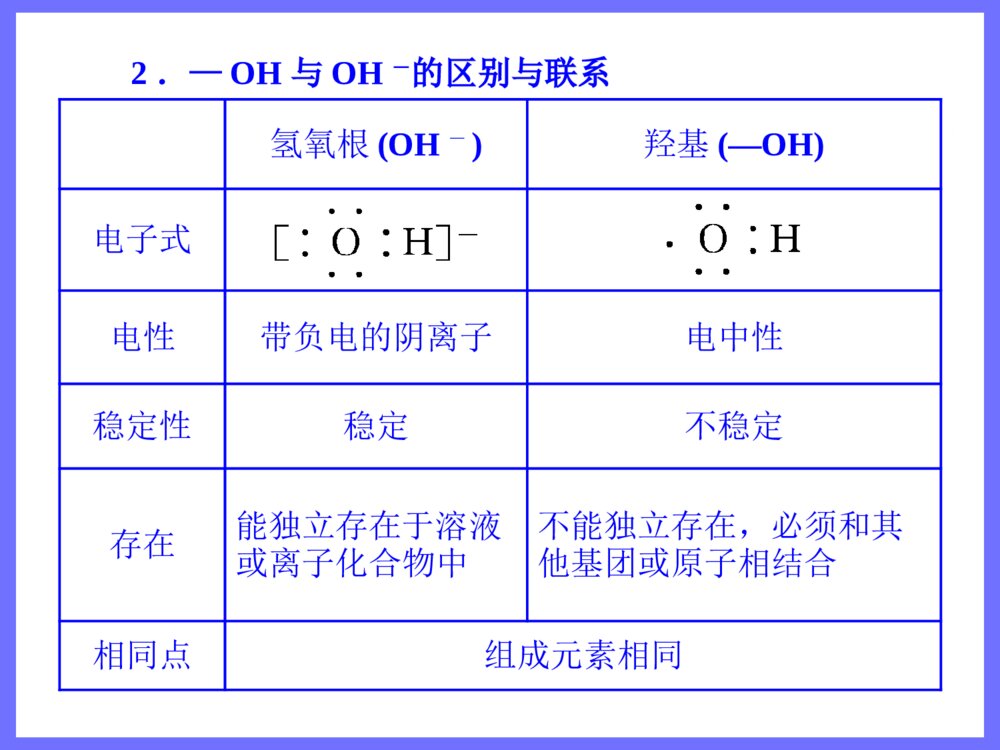
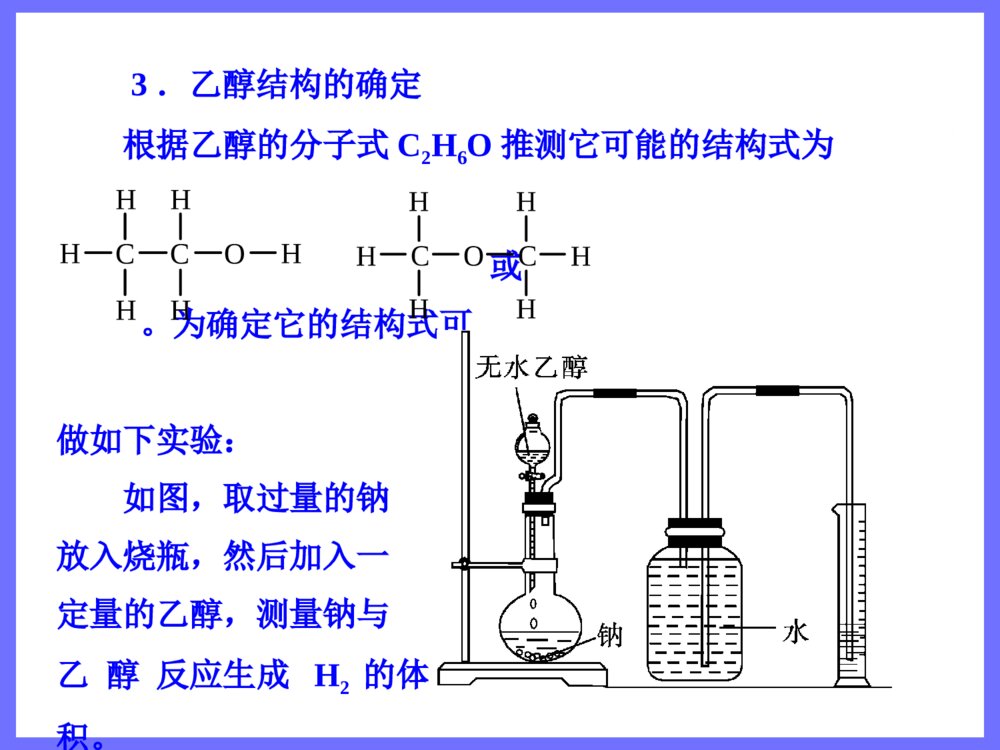
第三节 生活中两种常见的有机物第1课时 乙 醇 三维目标知识与技能1.了解乙醇分子的结构及羟基的结构特征2.了解烃的衍生物和官能团3.掌握乙醇的化学性质(重点)过程与方法通过揭示问题、讨论释疑、动手实验,学习对比、推断等多种科学探究方法情感、态度与价值观体验科学探究的艰辛与乐趣,体会化学与人类生活的密切关系,提高学习化学的积极性 思维激活 打针时,护士常常先往你的手臂上擦些酒精,这是为了消毒。酒精的学名叫“乙醇”,它具有很强的渗透能力,能够钻到细菌体内,使蛋白质凝固,这样,细菌也就一命呜呼了。然而,奇怪的是纯酒精反而不能杀菌。这是为什么呢?原来,当使用纯酒精消毒时,酒精的浓度很大,一下子就使细菌表面的蛋白质凝固了,结果形成了一层硬膜,这层硬膜对细菌有保护作用,能阻止酒精进一步渗入,所以纯酒精的杀菌能力反而不75%的酒精。你想认识乙醇吗? 自学导引 一、乙醇的物理性质 乙醇,俗称酒精,是无色、具有特殊香味的液体,密度比水小,与水以任意比例互溶,能溶解多种无机物和有机物,是良好的有机溶剂,易挥发。 思考题 溴和碘均易溶于酒精,能否用酒精萃取溴水或碘水中的溴或碘? 答案 不能,因为酒精会与水互溶。 二、乙醇的分子组成和结构 乙醇的分子式为C2H6O,结构式为,结构简式为CH3CH2OH或C2H5OH。 分子比例模型为。乙醇分子中含的—OH基团叫羟基。CHHCHHHOH 三、烃的衍生物和官能团 1.烃的衍生物 烃分子中的氢原子被其他原子或原子团取代而生成的一系列化合物称为烃的衍生物。 如乙醇可以看做乙烷分子中的氢原子被羟基取代后的产物,一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷都是甲烷的衍生物,硝基苯是苯的衍生物等。 2.官能团 决定有机化合物化学特性的原子或原子团叫做官能团。常见的官能团有—X、—OH、—COOH、—NO2、 等CC 四、乙醇的化学性质 1.跟金属钠反应 反应的化学方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑。 乙醇与金属钠的反应比水与金属钠的反应平缓得多,说明乙醇羟基中的氢原子不如水分子中的氢原子活泼。 2.氧化反应 (1)燃烧 乙醇在空气中可以燃烧,发出淡蓝色的火焰,放出大量的热,反应的化学方程式为CH3CH2OH+3O22CO2+3H2O。――→点燃 (2)催化氧化 实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热后,现象是其表面变为黑色;趁热把它插入盛有乙醇的试管中,现象为铜丝表面变为亮红色。反复多次后,试管中有刺激性气味的物质产生,该产物名称是乙醛,结构简式为CH3CHO。 反应的总化学方程式为2CH3CH2OH+O22CH3CHO+2H2O。 (3)被强氧化剂氧化 乙醇还可以与酸性高锰酸钾溶液或酸性重铬酸钾溶液反应,直接被氧化成乙酸。 CH3CH2OHCH3COOH――→Cu△――――――――→KMnO4(H+,aq)或K2Cr2O7(H+,aq) 名师解惑 一、乙醇的结构 1.乙醇分子的结构特点 乙醇的结构式为,其中氧元素的非金属性比较强,故C—O键、H—O键都是较强的极性键,在反应中容易断裂。同时,受—OH的影响,乙醇中的C—H键也变得比乙烷中的C—H键活泼,因此,—OH对乙醇的化学性质起着决定性的作用,—OH是乙醇的官能团。CHHCHHHOH 2.—OH与OH-的区别与联系氢氧根(OH-)羟基(—OH)电子式电性带负电的阴离子电中性稳定性稳定不稳定存在能独立存在于溶液或离子化合物中不能独立存在,必须和其他基团或原子相结合相同点组成元素相同 3.乙醇结构的确定 根据乙醇的分子式C2H6O推测它可能的结构式为 或。为确定它的结构式可做如下实验: 如图,取过量的钠放入烧瓶,然后加入一定量的乙醇,测量钠与乙醇反应生成H2的体积。CHHCHHHOHCHHHOCHHH 结果为4.6g乙醇可以得到标准状况下1.12LH2,这说明1mol乙醇与钠完全反应可以放出0.5molH2,乙醇分子中只有1个氢原子可以被钠取代,这1个氢原子与其余5个氢原子是不同的,由此确定乙醇的结构式为。 二、乙醇的化学性质 1.乙醇与钠的反应 乙醇与钠在常温下较缓慢地反应,生成氢气。乙醇与钠反应的化学方程式为2CH3CH2OH+2Na→2CH3CH2ONa(乙醇钠)+H2↑,反应时乙醇分子中H—O键断裂,乙醇与钠的反应类似于水与钠的反应,羟基上的氢能被钠置换,而其他氢原子不能被钠置换。乙醇分子可以看做水分子里的一个氢原子被乙基(—CH2CH3)取代后的产物。由于乙基对羟基的影CHHCHHHOH响,使羟基上的氢原子活泼性减弱,不如水分子中的氢原子活泼,所以乙醇与钠的反应比水与钠的反应平缓得多。钠与水、乙醇的反应比较如下表:钠与水的反应实验钠与乙醇的反应实验钠的现象钠粒熔为闪亮的小球快速浮游于水面,并快速消失钠粒未熔化,沉于乙醇液体底部,并慢慢消失声的现象有“咝咝”的声音无任何声音气的现象观察不到气泡有气泡生成实验结论钠的密度小于水的密度,熔点低。钠与水剧烈反应,单位时间内放出的热量大,反应生成氢气。2Na+2H2O=2NaOH+H2↑,水分子中的氢原子相对较活泼钠的密度大于乙醇的密度。钠与乙醇缓慢反应生成氢气。2Na+2CH3CH2OH―→H2↑+2CH3CH2ONa,乙醇分子里羟基中的氢原子相对不活泼反应实质水分子中的氢原子被置换的置换反应乙醇分子中羟基上的氢原子被置换的置换反应 [特别提醒] 乙醇能和活泼金属钾、钙、镁等发生类似的反应,如镁和乙醇反应的化学方程式为Mg+2CH3CH2OH→(CH3CH2O)2Mg+H2↑。 2.乙醇的氧化反应 (1)乙醇在空气中燃烧,发出淡蓝色的火焰,放出大量的热,完全燃烧后生成CO2和H2O,CH3CH2OH+3O22CO2+3H2O。乙醇是一种很好的液体燃料,被称为“绿色能源”。 (2)乙醇在有催化剂(如Cu和Ag)存在并加热的条件下,被氧气氧化生成乙醛。 2CH3CH2OH+O22CH3CHO+2H2O 乙醇催化氧化的反应原理如下:――→点燃――――→Cu(或Ag)△ 首先,铜被氧化为CuO:2Cu+O22CuO,然后,CuO与CH3CH2OH反应生成乙醛、铜和H2O: 总反应为2CH3CH2OH+O22CH3COH+2H2O。 [特别提醒] 乙醇发生催化氧化反应时,分子中H—O键和连有羟基的碳上的C—H键同时断裂。分子中连有—OH的碳原子上没有氢原子的醇,不能发生催化氧化反应。 (3)乙醇还可以被重铬酸钾(K2Cr2O7)、高锰酸钾等强氧化剂氧化。如乙醇能使酸性KMnO4溶液褪色:5CH3CH2OH+4KMnO4+6H2SO4→2K2SO4+4MnSO4+5CH3COOH+11H2O。=====△――→Cu△ 典例导析 知识点1:乙醇的物理性质 例1 若以w1和w2分别表示物质的量浓度为amol·L-1和bmol·L-1的乙醇溶液中乙醇的质量分数,且知2w1=w2,则下列推断中正确的是(乙醇的密度比纯水小)( ) A.a2aD.2a=b 解析 由于乙醇的密度比水小,所以乙醇的水溶液浓度越大,密度越小。由w2=2w1可知,b>a,且设ρ1、ρ2分别为amol·L-1和bmol·L-1的乙醇溶液的密度,则有ρ1>ρ2。根据c=可知:a=,b=。由于w2=2w1,ρ1>ρ2,所以b<2a。选A。 答案 A1000Mw11100046w22100046w1000Mw11100046w22100046w 跟踪练习1 已知质量分数为0.95的乙醇溶液的物质的量浓度为16.52mol·L-1,则质量分数为0.475的乙醇溶液的物质的量浓度( ) A.等于8.26mol·L-1 B.小于8.26mol·L-1 C.大于8.26mol·L-1 D.无法判断 答案 C 知识点2:乙醇的燃烧 例2 在常压和100℃条件下,把乙醇汽化为蒸气,然后和乙烯以任意比例混合,体积为VL,将其完全燃烧,需消耗相同条件下氧气的体积是( ) A.2VLB.2.5VL C.3VLD.无法计算 解析 等体积的乙烯和乙醇蒸气消耗氧气的体积相等,根据CH2CH2+3O22CO2+2H2O或CH3CH2OH+3O22CO2+3H2O可确定消耗氧气的体积是3VL。 答案 C――→点燃――→点燃 跟踪练习2 一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和H2O的总质量为27.6g的混合气体,将混合气体通过无水CaCl2后,固体增重10.8g,则CO的质量是( ) A.1.4gB.2.2g C.4.4gD.在2.2g与4.4g之间 答案 A 知识点3:乙醇的结构和性质的关系 例3 乙醇在一定条件下发生化学反应时化学键的断裂如下图所示,则乙醇与氧化铜反应时,化学键断裂的位置是( ) A.②③B.②④C.①③D.③④ 解析 乙醇与氧化铜加热时反应生成乙醛、铜和水,其化学方程式为CH3CH2OH+CuOCH3CHO+H2O+Cu,其实质是乙醇结构式中的②、④处化学键断裂生成乙醛。 答案 B 跟踪练习3 能证明乙醇分子中含有一个羟基的事实是( ) A.乙醇完全燃烧生成水 B.0.1mol乙醇与足量金属钠反应生成0.05molH2 C.乙醇能与水以任意比例互溶 D.乙醇容易挥发 答案 B――→△



















