







《人教版化学必修1《4.2.2元素周期表和元素周期律的应用》PPT课件》是由用户上传到老师板报网,本为文库资料,大小为1.53 MB,总共有75页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 75页
- 1.53 MB
- VIP模板
- pptx
- 数字产品不支持退货
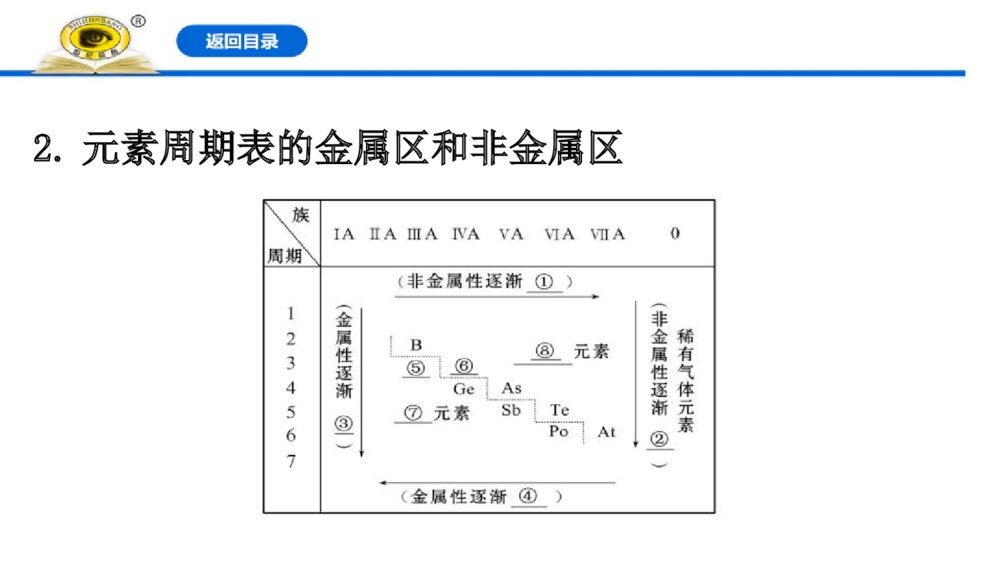
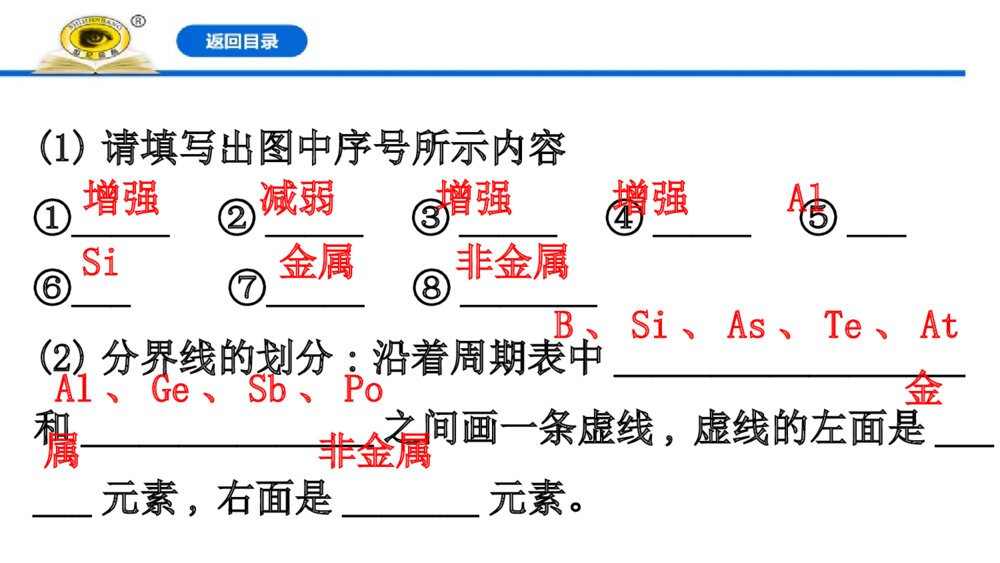
第2课时 元素周期表和元素周期律的应用一、元素周期表的分区及化合价规律1.元素周期表与元素周期律的关系元素周期律的发现,对化学的发展有很大影响。____________是___________的表现形式,反映了元素之间的_________,是学习、研究、应用化学的一种重要工具。元素周期表元素周期律内在联系2.元素周期表的金属区和非金属区(1)请填写出图中序号所示内容①_____ ②_____ ③_____ ④_____ ⑤___ ⑥___⑦_____ ⑧_______(2)分界线的划分:沿着周期表中__________________和_______________之间画一条虚线,虚线的左面是______元素,右面是_______元素。增强减弱增强增强AlSi金属非金属B、Si、As、Te、AtAl、Ge、Sb、Po金属非金属(3)分界线附近的元素,既能表现出一定的_______,又能表现出一定的_________,故元素的_______和__________之间没有严格的界线。(4)周期表的左下方是金属性最强的元素,是___元素(放射性元素除外);右上方是非金属性最强的元素,是___元素;最后一个纵行是0族元素。金属性非金属性金属性非金属性铯氟【巧判断】(1)金属元素不可能具有非金属性,非金属元素不可能具有金属性。( )提示:×。分界线附近的元素,既能表现出一定的金属性,又能表现出一定的非金属性。(2)同周期从左向右非金属性逐渐增强,同主族从下到上非金属性逐渐增强,故周期表中氦元素非金属性最强。( )提示:×。氦元素是稀有气体元素,氟元素非金属性最强。【情境·思考】元素周期表在预测新元素、发现新物质方面起着巨大的作用。随着社会的发展,对新型农药的需求量越来越大。若要寻找新型农药,可在周期表的哪个位置进行探索?提示:可在氟、氯、硫、磷、砷等元素在周期表中的位置附近寻找。3.元素化合价与元素在周期表中位置的关系(1)价电子元素的化合价与原子的___________有密切关系,所以,元素原子的___________也叫价电子。主族元素的价电子是___________,过渡元素的价电子包括最外层电子及次外层或倒数第三层的部分电子。最外层电子最外层电子最外层电子(2)主族元素最高正化合价=_________=_____________(价电子数)。(3)非金属元素的化合价①最高正化合价等于原子所能失去或偏移的______________。主族序数最外层电子数最外层电子数②最低负化合价等于使它达到______稳定结构所需要得到的电子数。③最高正价与最低负价绝对值之和等于__。8电子8【微思考】为什么氧元素无+6价,氟元素无正价?提示:O、F原子半径小,原子核对外层电子的吸引能力强。二、元素周期表和元素周期律的应用1.元素的位置、结构、性质之间的关系元素在周期表中的位置,反映了元素的原子结构和性质。可根据元素在周期表中的位置推测元素的结构和性质,也可以根据元素的原子结构推测其在周期表中的位置和性质。其关系可表示为2.寻找新元素3.发现物质的新用途知识点 元素的位置、原子结构、性质之间的关系【重点释疑】1.位-构-性关系图示2.(1)元素的原子结构与元素在周期表中位置的关系。(2)熟记周期表中的一些规律。①各周期元素种类数(分别为2、8、8、18、18、32、32)。②稀有气体元素原子序数(分别为2、10、18、36、54、86、118)和所在周期(分别在一到七周期)。③同族上下相邻元素原子序数的关系(相差2、8、18、32等各种情况)。④同周期ⅡA族与ⅢA族元素原子序数差值(有1、11、25三种情况)。3.原子结构与元素性质的关系4.元素性质与元素在周期表中位置的关系【方法规律】元素推断的思路分析【思考·讨论】如果已知X、Y为周期表中相邻的两元素,且它们的最高价氧化物对应水化物的酸性强弱为X>Y,能否确定它们的相对位置?提示:可根据元素非金属性的变化规律确定它们的相对位置。由已知条件可确定非金属性为X>Y,所以,如果它们同周期,则X在Y的右面;如果它们同主族,则X在Y的上面。【案例示范】【典例】(2019·全国卷Ⅱ)今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )A.原子半径:W丙C.氢氧化物碱性:丙>丁>戊D.最外层电子数:甲>乙【解析】选C。同周期元素原子半径从左至右是依次减小的,故A项错误;同主族元素金属性自上而下是增强的,故B项错误;同周期元素的金属性从左至右越来越弱,故对应氢氧化物的碱性是逐渐减弱的,故C项正确;同周期元素的原子最外层电子数从左到右越来越多,故D项错误。【补偿训练】1.运用元素周期律分析下面的推断,其中不正确的是( )A.钾与水反应,比钠与水反应更剧烈B.AgAt既难溶于水又不溶于稀硝酸C.在空气中加热,铷(Rb)的氧化产物比钠的氧化产物更复杂D.HClO的酸性比H2CO3的酸性强【解析】选D。A项,金属性:K>Na,元素的金属性越强,对应的单质与水反应越剧烈,则钾与水反应,比钠与水反应更剧烈,不符合题意;B项,卤族元素形成的卤化银都既不溶于水又不溶于稀硝酸,因此AgAt既难溶于水也不溶于稀硝酸,不符合题意;C项,碱金属元素从上到下元素的金属性逐渐增强,对应的单质与氧气反应的产物有氧化物、过氧化物、超氧化物等,越来越复杂,不符合题意;D项,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,而HClO不是最高价氧化物的水化物,符合题意。2.(2019·淮北高一检测)X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )A.原子半径:W>Z>Y>XB.最高价氧化物对应水化物的酸性W比Z弱C.Y的气态氢化物的稳定性较Z的弱D.四种元素的单质中,Z的熔、沸点最高【解析】选D。Y原子的最外层电子数是内层电子数的3倍,则Y为O,故X为N,Z为S,W为Cl,A项错误;HClO4的酸性比H2SO4的酸性强,B项错误;H2O比H2S稳定,C项错误;S为固体,其他为气体,D项正确。3.(2019·泰安高一检测)短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法错误的是( )A.Y原子的电子总数是其K层电子数的4倍B.原子半径大小顺序为r(X)>r(Y)>r(Z)>r(W)>r(Q)C.Q的单质能与W的氢化物发生置换反应D.元素Q的最高价氧化物对应水化物的酸性是短周期中最强的【解析】选B。由5种元素在周期表中的位置可以推知:Z为Al,X为N,Y为O,W为S,Q为Cl。Y原子的电子总数是8,其K层有2个电子,电子总数是K层电子数的4倍,A项正确;原子半径大小顺序为r(Z)>r(W)>r(Q)>r(X)>r(Y),B项错误;氯气能与硫化氢发生置换反应生成氯化氢和硫单质,C项正确;根据同周期元素性质递变规律可知非金属性:短周期中氟元素非金属性最强,但是F无正价,没有最高价含氧酸,故短周期中氯元素的最高价氧化物对应水化物的酸性最强,D项正确。4.短周期元素X、Y、Z、M、N在元素周期表中的相对位置如图所示,X、Y、Z原子最外层电子数之和等于M、N原子最外层电子数之和。则下列说法不正确的是( )XYZMNA.原子半径大小:Z>X>YB.最高价氧化物的水化物的酸性M大于X的C.X和氢元素所形成的化合物的沸点可能比Y的氢化物的沸点高D.MY2可以使紫色石蕊试液先变红后褪色【解析】选D。由短周期元素X、Y、Z、M、N在元素周期表中的相对位置,可知X、Y处于第二周期,Z、M、N处于第三周期,而X、Y、Z原子最外层电子数之和等于M、N原子最外层电子数之和,设Z原子最外层电子数为a,则X、Y、M、N的最外层电子数依次为a+1、a+3、a+3、a+4,则:a+1+a+3+a=a+3+a+4,解得a=3,故Z为Al、X为C、Y为O、M为S、N为Cl。同主族自上而下原子半径增大,同周期自左而右原子半径减小,故原子半径:Z>X>Y,故A正确;M、X的最高价氧化物的水化物分别为硫酸、碳酸,硫酸的酸性比碳酸的强,故B正确;Y的氢化物为水,常温下为液态,而X和氢元素所形成的化合物为烃类物质,可能为气态、液态、固态,若为固态,其沸点高于Y的氢化物,故C正确;MY2为SO2,不能漂白酸碱指示剂,使紫色石蕊试液变红,故D错误。【素养提升】古诗云:“唯有儿时不可忘,持艾簪蒲额头王。”意思是说端午节这天,孩子们拿了艾叶,戴上菖蒲,额头上用雄黄酒写了“王”字,以辟邪防疫。把雄黄酒洒在墙角、床底等处,可以驱虫,清洁环境。雄黄是一种矿物质,俗称“鸡冠石”,其主要成分是硫化砷,As位于元素周期表第ⅤA族,另外第ⅥA族元素Se在生活中有广泛应用。砷元素的最高价态是几价?试比较As、Se的氢化物哪个热稳定性强。提示:+5价;H2Se。【课堂回眸】【核心整合】1.元素周期律及其应用2.实例分析元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分:(1)根据元素周期律,请你预测H3AsO4、H3PO4的酸性强弱:P、As位置关系(_______)→P、As原子结构特点(______________相等、P原子序数比As___)→性质递变规律(同主族随原子序数的增大元素非金属性_________)→预测结果:H3AsO4__H3PO4(填“>”“<”或“=”)。同主族最外层电子数小逐渐减弱<(2)根据NaH的存在,有人提议可把氢元素放在第ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的第____族。ⅣA(3)人体所需的微量元素中有一种被誉为“生命元素”的主族元素R,对延长人类寿命起着重要作用。已知R元素的原子有4个电子层,其最高价氧化物的分子式为RO3,请推断R元素的名称,并预测其氢化物的稳定性强弱(与水相比)。流程:【素养迁移】1.1871年门捷列夫根据新排出的周期表预言了锗的存在,把它命名为“类硅”。1886年,德国矿业学院分析化学教授ClemensA.Winkler在研究一种新矿石辉银锗矿(4Ag2S·GeS2)的时候,发现有一未知的新元素并通过实验验证了自己的推断,它就是元素锗。锗继镓和钪后被发现,巩固了化学元素周期表。(1)在该事例中,体现了元素周期表的什么用途。提示:预测、寻找新元素的用途。(2)门捷列夫把“锗”命名为“类硅”,硅是一种良好的半导体,请解释锗也可以作为半导体材料的原因。提示:锗与硅同主族,且处于元素周期表中金属与非金属的分界线附近,金属元素锗具有一定的非金属性,故可作半导体材料。2.铊位于第六周期第ⅢA族,铊元素在研究光导纤维、催化剂和超导材料等方面具有重要作用。在第二次世界大战期间,氯化铊的混合晶体就曾被用来传送紫外线,深夜进行侦察敌情或自我内部联络;铊还是一种有剧毒性的物质,铊对人体的毒性超过了铅和汞,近似于砷,近年来铊中毒事件屡有发生。元素铊的相关信息如图所示。根据卡片信息回答下列问题:请预测:(1)铊单质的颜色可能是:________。 (2)铊单质的熔点比Al________。 (3)铊的最高价氧化物对应水化物的碱性比氢氧化铝强还是弱?请说明理由。【解析】(1)铝单质是银白色的,故铊的颜色可能是银白色。(2)同主族金属单质的熔点逐渐降低,故铊单质的熔点比Al低。(3)铊的最高价氧化物对应水化物的碱性比氢氧化铝强,因为铊的金属性比铝强。答案:(1)银白色 (2)低 (3)铊的最高价氧化物对应水化物的碱性比氢氧化铝强,因为铊的金属性比铝强。3.制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷的目的。人们曾采用乙醚、NH3、CH3Cl等作制冷剂,但它们不是有毒就是易燃,于是科学家根据元素性质的递变规律开发出了新的制冷剂。根据已有知识,某些元素化合物的易燃性、毒性变化趋势如下:(1)氢化物的易燃性探究:若易燃性:SiH4>PH3>H2S>HCl,请分析CH4、NH3、H2O、HF的易燃性。提示:CH4>NH3>H2O>HF。Si、P、S、Cl位于同周期,氢化物易燃性从左到右逐渐减弱,故C、N、O、F的氢化物易燃性逐渐减弱。(2)化合物的毒性探究:若毒性:PH3>NH3,CCl4>CF4,请预测H2S与H2O、CS2与CO2的毒性强弱。提示:H2S>H2O、CS2>CO2。N与P、F与Cl同主族,结合毒性:PH3>NH3,CCl4>CF4,可知同主族元素形成的结构相似的化合物毒性从上到下增强,故毒性:H2S>H2O、CS2>CO2。(3)科学家发现结构类似的物质的沸点与相对分子质量的大小有关。已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新的制冷剂的沸点范围应介于二者之间,经过较长时间的反复实验,发现了制冷剂CF2Cl2(氟利昂),然而这种制冷剂造成了当今的环境问题。这个环境问题是什么?提示:大气臭氧层出现空洞。(4)在制冷剂的发现中虽然造成了环境问题,但求助于周期表中元素及其化合物的性质变化趋势开发制冷剂的科学思维方法是值得借鉴的。在上述探究中主要分析了物质的哪些性质变化规律?提示:易燃性、毒性、沸点。



















