








《分析化学误差和分析数据的处理PPT课件》是由用户上传到老师板报网,本为文库资料,大小为1.23 MB,总共有56页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 56页
- 1.23 MB
- VIP模板
- ppt
- 数字产品不支持退货
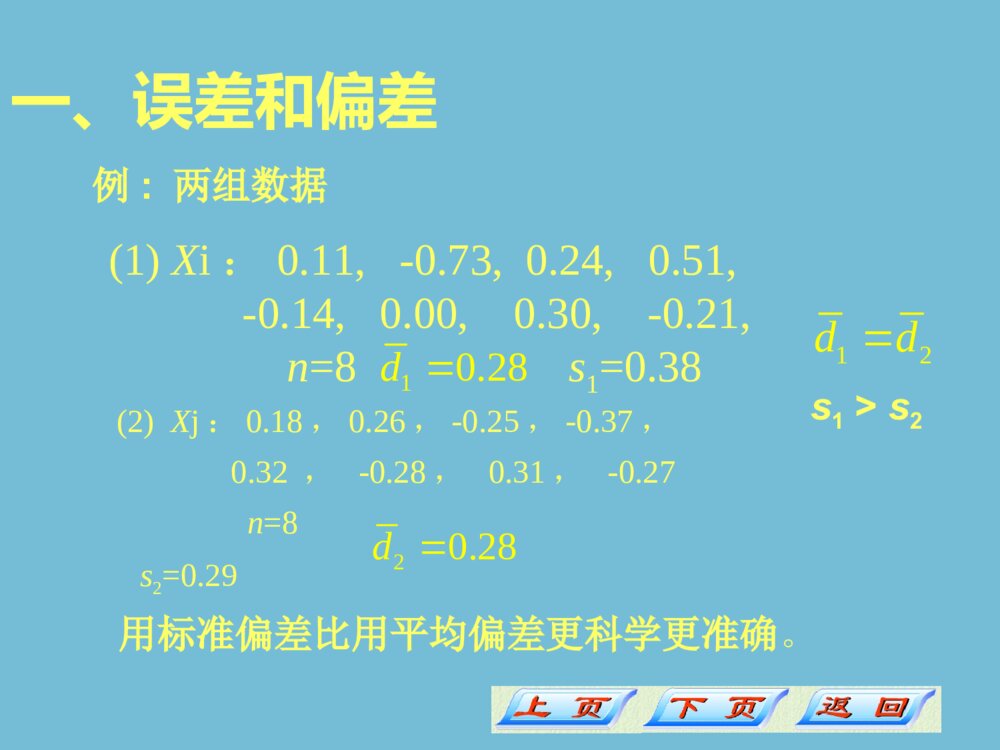
23/10/81第二章分析化学中的误差及数据处理•一、误差和偏差•二、准确度和精密度•三、系统误差和偶然误差第1节分析化学中的误差1.误差:分析结果与真实值之间的差值误差可用绝对误差(Ea)和相对误差(Er)表示相对误差Er=(Ea/XT)×100%表示误差在真实值中所占的比例绝对误差Ea=E表示测定值与真实值之差一、误差和偏差误差:正、负E=X-XT例:已知两个试样的质量分别为mT1=1.6246g、mT2=0.1625g测定值m1=1.6245g、m2=0.1624g则Ea1=-0.0001g、Ea2=-0.0001g(相等)Er1=-0.006%、Er2=-0.06%(不等)可见,用相对误差来比较各种情况下测定结果的准确度,更为确切些。一、误差和偏差例.称量:基准物:硼砂Na2B4O7·10H2OM=381碳酸钠Na2CO3M=106欲配制相同物质的量浓度、相同体积的标准溶液时,选那一个更能使测定结果准确度高?(只考虑称量误差)滴定:如何确定滴定体积消耗?(一般要求相对误差为0.1%)0.00~10.00mL;20.00~25.00mL;40.00~50.00mL1111nniiiidXXdnn相对平均偏差:iidXX100%rddX平均偏差:偏差:正、负一、误差和偏差2.偏差:分析结果与平均值之间的差值无正、负使用相对平均偏差表示分析结果的好坏比较简单,但这个方法有不足之处,因为在一系列的测定中,小偏差的测定总是占多数,而大偏差的测定总是占少数,按总的测定次数求相对平均偏差所得的值偏小,大偏差得不到充分的反映。所以相对平均偏差在数理统计上一般不采用。近年来,在分析化学的教学中,越来越广泛地采用数理统计方法来处理各种测定数据。一、误差和偏差3.标准偏差当测量次数较多时,用标准偏差S和相对标准偏差(又称变异系数)来衡量分析结果的好坏:21SXXn100%rSSX可以更好地说明数据的分散程度标准偏差S相对标准偏差sr(又称变异系数)一、误差和偏差(2)Xj:0.18,0.26,-0.25,-0.37,0.32,-0.28,0.31,-0.27n=8s2=0.29 20.28d用标准偏差比用平均偏差更科学更准确。s1>s2例:两组数据(1)Xi:0.11,-0.73,0.24,0.51,-0.14,0.00,0.30,-0.21,n=8s1=0.3810.28d12dd一、误差和偏差二、准确度和精密度准确度表示分析结果与真实值之间的接近程度1.准确度可见,误差的大小是衡量准确度高低的尺度。E越小,表示测定结果与真实值越接近,准确度越高;反之,E越大,准确度越低。XXT,误差为正值,表示测定结果偏高;误差:E=X-XT2.精密度在实际工作中,真实值通常是不知道的,因此无法求出分析结果的准确度,所以不得不用另一种方式来判断分析结果的好坏。这种方法是:在相同的条件下重复测定多次,然后计算n次测定结果的符合程度,即所谓的精密度,它反映测定结果的再现性。二、准确度和精密度精密度表示几次测定结果的接近程度,通常以偏差来表示。偏差越小,说明分析结果的精密度越高。3.准确度和精密度的关系分析结果与真实值的接近程度准确度的高低用误差的大小来衡量;几次平行测定结果相互接近程度精密度的高低用偏差来衡量。精密度是保证准确度的先决条件;精密度高不一定准确度高;分析结果的衡量指标。(1)准确度(2)精密度(3)两者的关系两者的差别主要是由于系统误差的存在。二、准确度和精密度 根据误差的性质与产生的原因,可将误差分为系统误差、偶然误差两类。分析结果与真实值之间的差值称为误差误差的来源: 测量对象的代表性,测量工具的误差,测量方法的误差,测量环境引发的误差,人为的误差,计算的误差,统计误差等等。误差的客观性:误差是客观的,是不以人的意志而改变的。三、系统误差和随机误差1.系统误差系统误差的性质是:也叫可测误差,它是由于分析过程中某些经常发生的、比较固定的原因所造成的。a.对分析结果的影响比较恒定(单向性);b.在同一条件下,重复出现(重复性);c.可以消除(可校正性)。系统误差是不允许存在的。它影响结果的准确度,不影响精密度。三、系统误差和随机误差系统误差产生的主要原因:(1)方法误差选择的方法不够完善例:重量分析中沉淀的溶解损失;滴定分析中指示剂选择不当。(2)仪器误差仪器本身的缺陷例:电光天平两臂不等,砝码未校正;滴定管、容量瓶未校正。三、系统误差和随机误差系统误差产生的主要原因:(3)试剂误差所用试剂有杂质例去离子水不合格试剂纯度不够(含待测组份或干扰离子)(4)操作误差操作人员主观因素造成例:对指示剂颜色辨别偏深或偏浅;滴定管读数不准。三、系统误差和随机误差2.偶然误差也叫不可测误差或随机误差,它是由一些随机的偶然的因素造成的偶然误差的特点:a.不恒定b.难以校正c.服从正态分布(统计规律)客观存在的,不可避免的,只能减小,不能消除。三、系统误差和随机误差它既影响结果的准确度,又影响精密度。偶然误差产生的原因:(1)偶然因素所引起的例如:测定时环境的温度、湿度和气压的微小波动(2)仪器性能的微小变化(3)分析人员对各分试样处理时的微小区别三、系统误差和随机误差 这类误差在工作上应该属于责任事故,是不允许存在的。重做!3、过失 是指分析人员工作中的差错,主要是由分析人员的粗心或疏忽而造成的,没有一的规律可循。例如:记录错了、计算错了等等三、系统误差和随机误差小结1.下列概念的含义:误差(系统误差随机误差)、偏差、准确度、精密度。2.误差、平均值、偏差、平均偏差、相对平均偏差、标准偏差、相对标准偏差的计算。掌握:理解:1.系统误差和随机误差的性质和特点。2.准确度与误差、精密度与偏差的关系。预习1、有效数字及其运算规则2、分析化学中的数据处理4、提高分析结果准确度的方法3、回归分析法23/10/821第二章分析化学中的误差及数据处理•第2节•有效数字及其运算规则一、有效数字二、有效数字的修约规则三、有效数字的运算规则一、有效数字在定量分析中,分析结果所表达的不仅仅是试样中待测组分的含量,还反映了测量的准确程度。所以,记录实验数据和计算结果应保留几位有效数字是一件很重要的事,不能随便增加和减少位数。一、有效数字记录数据和计算结果须根据测定方法和使用仪器的准确度来决定保留几位数字,所保留的有效数字中,只有最后一位是可疑的(注:P50)。有效数字:是指在分析工作中实际上能测量到的数字。包括全部可靠数字和一位不确定数字。一、有效数字2.实验过程中常遇到的两类数字(1)数目:如测定次数;倍数;系数;分数(不记位数)。1.改变单位,不改变有效数字的位数如:24.01mL24.0110-3L一、有效数字(2)测量值或计算值。数据不仅表示数量的大小且其位数与测定准确度有关。 2.实验过程中常遇到的两类数字结果绝对偏差相对偏差有效数字位数0.51800±0.00001±0.002%50.5180±0.0001±0.02%40.518±0.001±0.2%33.数据中零的作用数字零在数据中具有双重作用:(1)作普通数字用,如0.51804位有效数字5.18010-1(2)作定位用:如0.05183位有效数字5.1810-20定位作用有效数字零一、有效数字一、有效数字一、有效数字一、有效数字(1)容量器皿:滴定管(量至0.01mL):如24.32mL,2.45mL移液管和吸量管(量至0.01mL):如1.23mL,10.00mL,20.00mL容量瓶:50.00mL,100.0mL,250.0mL量筒(量至1mL或0.1mL):如25mL,4.0mL4.与实验有关的注意点一、一、有效数字有效数字(2)称量仪器分析天平即万分之一天平(称至0.1mg):12.8212g,0.2338g,1.4562g,0.0561g千分之一天平(称至0.001g):0.234g,1.356g,10.324g百分之一天平(称至0.01g):1.26g,0.23g,14.26g台秤(称至0.1g):4.0g,0.5g,16.8g4.与实验有关的注意点一、有效数字一、有效数字(3)标准溶液的浓度,一般用4位有效数字表示:如0.1000mol/L,0.01235mol/L(4)pH=4.34,小数点后的数字位数为有效数字位数,如:对数值,lgX=2.38;X=2.41024.与实验有关的注意点(5)对于可疑数字,除非特别说明,通常可理解为有+1或-1个单位的误差。(6)在计算未知试样的含量时,分析结果用几位有效数字表示,要示具体情况而定。多数为4位。例:ω(Fe)=0.5643或ω(Fe)/10-2=56.43又如ω(Fe)=0.0564或ω(Fe)/10-2=5.644.与实验有关的注意点一、有效数字一、有效数字(7)统计结果的误差时,一般保留1~2位有效数字,最多2位。在同一个实验中,误差保留有效数字位数应相同。二、有数字的修约规则二、有数字的修约规则四舍六入,五成双;五后有非零数字就进位。例:3.1487.39760.73675.57.43.1760.74修约数字时要一步到位,不能分次修约例如将13.4565修约为两位有效数字一次完成修约13.456513分次完成修约13.456513.45613.4613.51475.5075.5176.5176.5076767776三、有效数字的运算规则三、有效数字的运算规则1.加减运算+26.7126.7091结果的位数取决于绝对误差最大的(即小数点后位数少的)数据的位数例:0.0121绝对误差:0.000125.640.011.0570.0012.2.乘除运算乘除运算有效数字的位数取决于相对误差最大的(即有效数字位数最少的)数据的位数。例:(0.03255.10360.0)/139.8=0.0711791840.0325±0.0001/0.0325100%=±0.3%5.103±0.001/5.103100%=±0.02%60.06±0.01/60.06100%=±0.02%139.8±0.1/139.8100%=±0.07%0.071223/10/834第二章分析化学中的误差及数据处理•1.Q检验法•2.格鲁布斯(Grubbs)检验法第3节可疑数据的取舍第三节可疑数据的取舍过失误差的判断解决的问题:确定某个数据是否可用。方法:a、Q检验法b、格鲁布斯(Grubbs)检验法可疑数据的取舍过失误差的判断 步骤:1.Q检验法(3)求可疑数据与相邻数据之差Xn-Xn-1或X2-X1(2)求极差Xn-X1(1)数据排列(由小到大)X1X2…Xn可疑数据的取舍过失误差的判断12111nnnnXXXXQQXXXX或(4)计算Q值:(5)根据测定次数和要求的置信度(如90%)查表: 表1--2不同置信度下,舍弃可疑数据的Q值表测定次数Q90Q95Q9930.940.980.9940.760.850.93 80.470.540.63若Q>QX舍弃该数据。(过失误差造成)(6)将Q与QX(如Q90)相比,(偶然误差所致)若QG表,弃去可疑值,反之保留例:有数据1.011.021.041.05求在置信度为95%时,有无可疑数据。解:=1.03S=0.018G=(1.05-1.03)/S=1.11查表G表=1.46G



















