






《人教版必修1:3.2.2《物质的量在化学方程式计算中的应用》PPT课件》是由用户上传到老师板报网,本为文库资料,大小为512.51 KB,总共有55页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 55页
- 512.51 KB
- VIP模板
- pptx
- 数字产品不支持退货
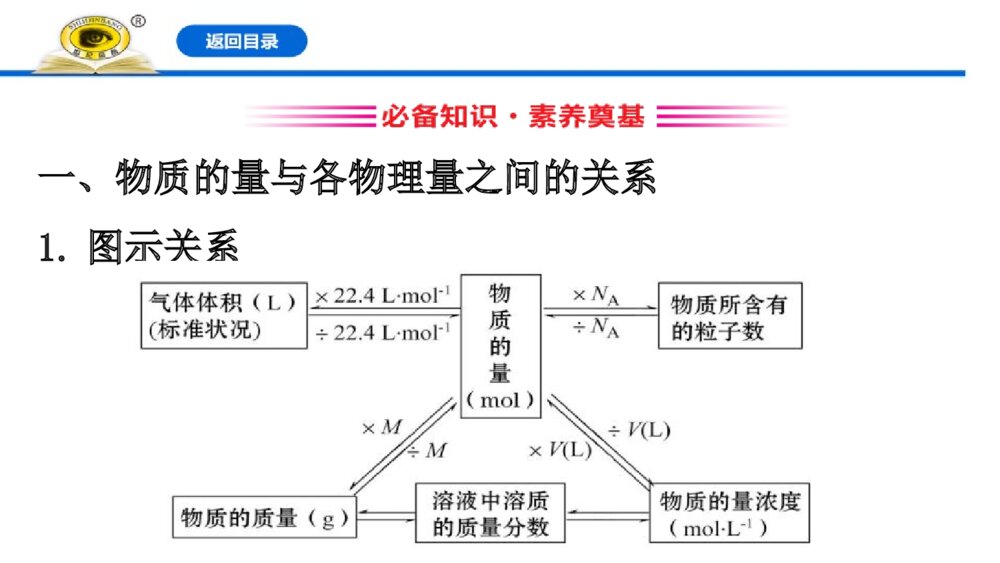
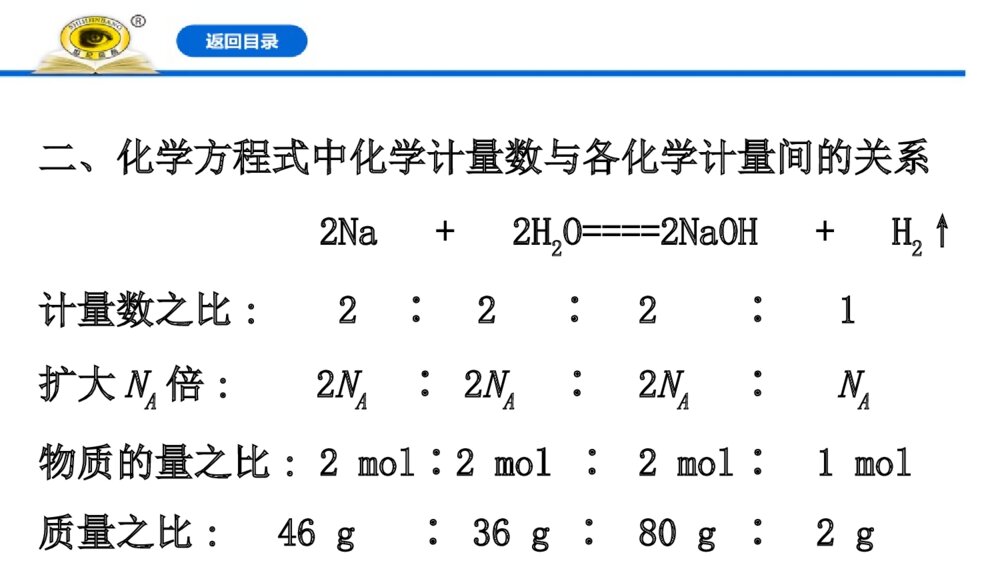
第2课时 物质的量在化学方程式计算中的应用 一、物质的量与各物理量之间的关系1.图示关系2.计算公式(1)已知物质的质量:n(B)=_______;(2)已知标准状况时的气体体积:n(B)=_________;(3)已知物质的粒子数:n(B)=_______;(4)已知溶液中的物质的量浓度:n(B)=_______________。mBMBmVBgV[]ANBNc(B)·V[B(aq)]mBMBmVBgV[]ANBN【做一做】22gCO2的物质的量是________mol,在标准状况下的体积是_________L。 0.511.2二、化学方程式中化学计量数与各化学计量间的关系 2Na + 2H2O====2NaOH + H2↑计量数之比:2∶2∶2∶1扩大NA倍:2NA∶2NA∶2NA∶NA物质的量之比:2mol∶2mol∶2mol∶1mol质量之比:46g∶36g∶80g∶2g结论:化学方程式中化学计量数之比等于_________之比,也等于_________之比,对于有气体参与的反应还等于_____之比。粒子个数物质的量体积【情境·思考】甲、乙两位同学就物质的量应用于化学方程式的计算,进行了以下讨论:你同意哪位同学的说法?提示:甲。若题目所给物质的物理量单位不一致,换算成同一个单位,有时显得很烦琐,这时只要做到各个量的单位“上下一致,左右相当”即可。知识点 物质的量应用于化学方程式计算的基本步骤【重点释疑】1.计算步骤2.计算过程中的注意事项(1)书写格式规范化:在根据化学方程式计算的过程中,各物理量、物质名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。(2)单位运用对应化:根据化学方程式计算时,如果题目所给的两个量单位不一致,要注意两个量的单位要“上下一致,左右相当”。(3)如果两种反应物的量都是已知的,求解某种产物的量时,必须先判断哪种物质过量,然后根据不足量的物质进行计算。【思考·讨论】观察下面的化学方程式,及各物质对应的物理量,思考并回答相关问题。2Na + 2H2O====2NaOH + H2↑2×23g2mol 2mol 22.4Lm(Na)n(H2O)n(NaOH)V(H2)则有22223g2mol2mol22.4LmNanHOnNaOHVH=22223g2mol2mol22.4LmNanHOnNaOHVH=(1)为什么利用化学方程式进行计算时,同一种物质的单位必须统一,而不同的物质则不必统一?提示:同一种物质用不同的物理量表示时,比例是相同的。例如1mol钠和23g钠完全相同。(2)上述反应是在常温常压下发生的吗?说明你的判断理由。提示:不是。因为在计算中1mol氢气的体积是22.4L,说明一定不是在常温常压下进行的。【案例示范】【典例】镁铝合金具有很好的强度、刚性和尺寸稳定性,常用来制作又轻又薄的笔记本电脑、手机等的外壳。把10.2g镁铝合金的粉末放入过量的烧碱溶液中,在标准状况下生成6.72L氢气。试计算:(1)该合金中铝的质量分数是________。 (2)该合金中镁与铝的物质的量之比是________。 (3)该合金溶于足量的盐酸中,标准状况下产生氢气的体积是________。 【解题指南】解答本题应注意以下两点:(1)掌握铝与氢氧化钠溶液的反应,同时明确镁与氢氧化钠溶液不反应。(2)注意应用化学方程式计算时的规范问题。【解析】(1)把镁铝合金的粉末放入过量的烧碱溶液中,镁不反应,只有铝能与氢氧化钠溶液反应。设铝的物质的量为n(Al),则:2Al+2NaOH+2H2O====2NaAlO2+3H2↑2mol 3×22.4Ln(Al) 6.72L解得:n(Al)=0.2mol,m(Al)=0.2mol×27g·mol-1=5.4g,铝的质量分数为×100%≈52.9%。5.4g10.2g5.4g10.2g(2)m(Mg)=10.2g-5.4g=4.8g,n(Mg)==0.2mol,则n(Al)∶n(Mg)=1∶1。14.8g24gmol-14.8g24gmol-(3)设由铝生成的氢气为V1(H2),由镁生成的氢气为V2(H2),由铝和镁与盐酸的反应可知:2Al+6HCl====2AlCl3+3H2↑2mol 3×22.4L0.2mol V1(H2)解得:V1(H2)=6.72L,Mg+2HCl====MgCl2+H2↑1mol 22.4L0.2mol V2(H2)解得:V2(H2)=4.48L,V总(H2)=V1(H2)+V2(H2)=6.72L+4.48L=11.2L。答案:(1)52.9% (2)1∶1 (3)11.2L【迁移·应用】1.0.56g氧化钙恰好与20mL盐酸反应,则此盐酸的物质的量浓度是( )A.0.10mol·L-1B.0.20mol·L-1C.0.50mol·L-1D.1.00mol·L-1【解析】选D。CaO+2HCl====CaCl2+H2O 56g2mol 0.56g c(HCl)×20×10-3L则:解得c(HCl)=1.00mol·L-1。356g2mol0.56gcHCl2010L-=356g2mol0.56gcHCl2010L-=2.将1molNa和1molAl的混合物投入足量水中,产生的气体在标准状况下的体积为( )A.11.2LB.22.4LC.33.6LD.44.8L【解析】选D。根据化学方程式进行计算:2Na+2H2O====2NaOH+H2↑2 2 11mol 1mol0.5mol2Al+2NaOH+2H2O====2NaAlO2+3H2↑2 2 31mol 1mol 1.5mol故Na、Al完全反应生成2molH2,在标准状况下的体积为44.8L。【备选要点】一、化学计算的常用方法【重点释疑】方法一:关系式法当已知量和未知量之间是靠多个反应来联系时,只需直接确定已知量和未知量之间的比例关系,即“关系式”。(1)根据化学方程式确定关系式写出发生反应的化学方程式,根据量的关系写出关系式。(2)根据原子守恒确定关系式【思考·讨论】用1molCO还原足量的Fe2O3,充分反应后将生成的CO2通入澄清的石灰水中,求生成CaCO3沉淀的质量。(1)怎样利用化学方程式建立CO和CaCO3间的关系?提示:上述过程中发生反应的化学方程式有:3CO+Fe2O32Fe+3CO2,CO2+Ca(OH)2====CaCO3↓+H2O,则关系式为3CO~3CO2~3CaCO3,即CO~CaCO3。(2)怎样利用原子守恒建立CO和CaCO3间的关系?提示:根据碳原子守恒CO→CO2→CaCO3,即CO中的碳原子全部转化为CaCO3,得出CO~CaCO3。【案例示范】【典例】硫黄制硫酸时发生的反应有S+O2SO22SO2+O22SO3SO3+H2O====H2SO4由硫黄制取硫酸的关系式是________。假设64g硫黄完全反应,可制取硫酸的质量是________。 【解题指南】利用关系式法解题的关键是利用化学方程式确定已知量和待求量之间的关系式。【解析】据题中化学方程式(或根据硫原子守恒)可得关系式S~H2SO4。制取硫酸的质量为×98g·mol-1=196g。答案:S~H2SO4 196g164g32gmol-164g32gmol-【迁移·应用】(2019·孝感高一检测)已知Fe+S====FeS,FeS+2HCl====FeCl2+H2S↑,2H2S+3O22SO2+2H2O,一定量的铁粉和9g硫粉混合加热,待其反应后再加入过量盐酸,将生成的气体完全燃烧,共收集得9g水,则加入的铁粉质量为( )A.14gB.42gC.56gD.28g====点燃【解析】选D。根据各步反应的定量关系,可列出关系式:Fe→FeS(铁守恒)→H2S(硫守恒)→H2O(氢守恒)Fe→H2(化学方程式)→H2O(氢守恒)推出:Fe~H2O 56 18 xg 9g56∶xg=18∶9g,x=28即加入的铁粉质量为28g。方法二:差量法根据化学反应前后物质的有关物理量发生的变化,找出“理论差量”,如反应前后的质量差、物质的量差、气体体积差等。该差量的大小与反应物的有关量成正比。差量法就是借助这种比例关系,解决一定量变计算题的方法。【思考·讨论】把一铁棒插入CuSO4溶液后,过一段时间取出,铁棒质量增加了4g。(1)怎样确定铁与CuSO4溶液反应的理论差量?提示:根据化学方程式可知56g铁反应后生成64g铜,生成的铜附着在铁表面,铁棒增重8g。(2)怎样利用理论差量和实际差量列式求算参加反应的Fe的质量?提示:Fe+CuSO4====FeSO4+Cu Δm(增加)56 64 8m(Fe)4g列等式 得出:m(Fe)=28g568mFe4g=,568mFe4g=,【案例示范】【典例】已知:①碳酸钠高温下不分解;②碳酸氢钠受热发生分解反应:2NaHCO3Na2CO3+H2O+CO2↑。充分加热碳酸钠和碳酸氢钠的混合物19g,完全反应后固体质量减轻了3.1g,求:(1)原混合物中碳酸钠的质量是________g。 (2)在剩余固体中,加入过量盐酸,反应后放出二氧化碳的体积(标准状况)是________L。 【解析】(1)设混合物中碳酸氢钠的质量为m,则:2NaHCO3Na2CO3+H2O+CO2↑ Δm168g 106g 62gm 3.1g故m=×168g=8.4g,则碳酸钠的质量为19g-8.4g=10.6g。3.1g62g3.1g62g(2)剩余固体为碳酸钠,质量为19g-3.1g=15.9g,物质的量为=0.15mol,根据碳原子守恒可知,生成二氧化碳的物质的量为0.15mol,标准状况下的体积为0.15mol×22.4L·mol-1=3.36L。答案:(1)10.6 (2)3.36115.9g106gmol-115.9g106gmol-【迁移·应用】将8g铁片放入100mL硫酸铜溶液中,溶液中的铜离子全部被还原时,固体质量变为8.2g,则原硫酸铜溶液的物质的量浓度为( )A.0.5mol·L-1B.0.25mol·L-1C.0.025mol·L-1D.0.125mol·L-1【解析】选B。Fe +CuSO4====FeSO4+Cu Δm56g1mol64g8gn(CuSO4)(8.2-8)gn(CuSO4)==0.025mol,c(CuSO4)==0.25mol·L-1。1mol0.2g8g0.025mol0.1L1mol0.2g8g0.025mol0.1L二、守恒法1.质量守恒:反应前后元素质量、原子个数不变。2.得失电子守恒:还原剂失电子总数=氧化剂得电子总数。3.电荷守恒:阳离子所带正电荷总数=阴离子所带负电荷总数。【针对训练】1.在体积为VL的密闭容器中通入amol一氧化碳和bmol氧气,点燃充分反应后容器内碳原子与氧原子数之比为( )A.a∶bB.a∶2bC.a∶(a+2b)D.a∶[2(a+b)]【解析】选C。根据反应前后原子守恒可知,n(C)∶n(O)=a∶(a+2b)。2.0.3mol氯气和足量的金属M反应,生成0.2molMCln,则n等于( )A.1B.2C.3D.4【解析】选C。根据氯原子守恒,可知0.3molCl2和0.2molMCln均含0.6molCl。【课堂回眸】



















