








《初三化学 第三章 物质构成的奥秘课件PPT下载》是由用户上传到老师板报网,本为文库资料,大小为386.6 KB,总共有21页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 21页
- 386.6 KB
- VIP模板
- pptx
- 数字产品不支持退货
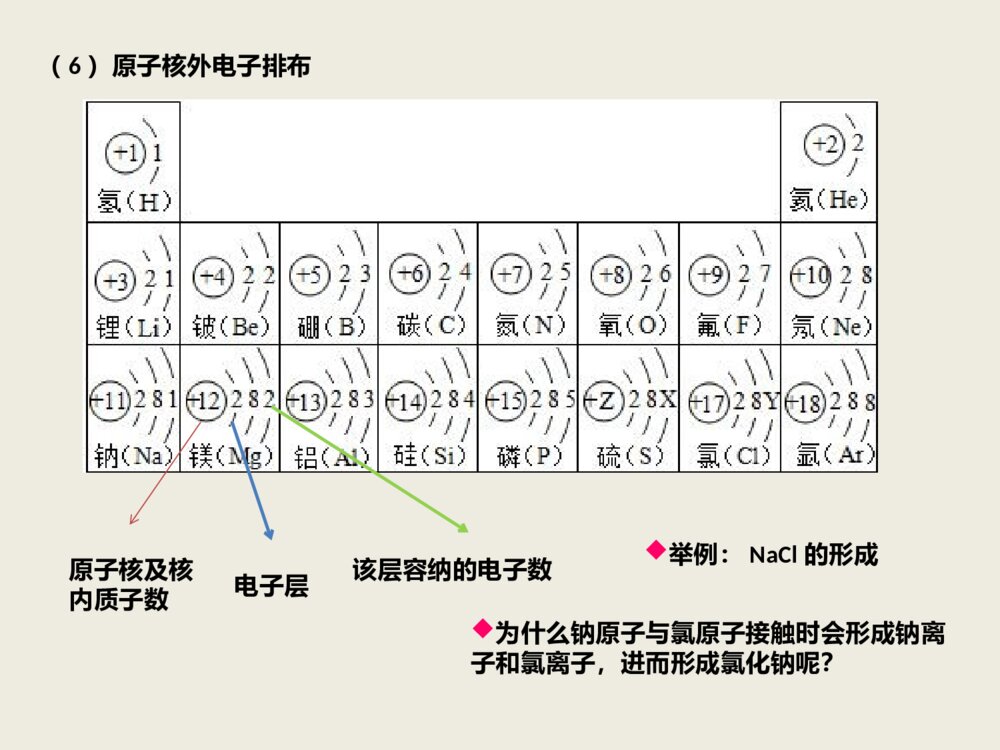
第三章物质构成的奥秘第1节构成物质的基本微粒一、微粒的性质(1)微粒是在不停地运动的微粒运动的速率与温度有关。温度越高,微粒运动的速率越快。举例(2)微粒之间有间隙在固体、液体中,微粒之间的空隙比较小,在气体物质中,微粒之间的空隙比较大,所以气体往往容易被压缩。一般物质有热胀冷缩的现象,这是构成物质的微粒之间的空隙在受热时增大,遇冷时减小的缘故。例1下列事实,不适合用“微粒之间有间隙”的性质来解释的是()A一定体积的气体加压后体积变小B一定量的水结冰后体积变大C室外的电线在冬天变短,夏天变长D1L大豆与1L黄沙混合总体积小于2L二、分子(1)由分子构成的物质,分子是保持其化学性质的最小颗粒。如水是由水分子构成,氧气由氧分子构成、二氧化碳由二氧化碳分子构成,因为构成它们的微粒不同,所以它们具有不同的化学性质。(2)分子的性质①质量和体积都很小②分子是在不停运动着的,温度越高,运动速率越快,空隙越大;压强越大,空隙越小。例2下列操作或现象与分子特性对应关系不正确的是()选项操作或现象分子特性A气体可压缩储存于钢瓶中分子间有空隙B物体的热胀冷缩分子的大小是可以变化的C湿衣服晾干分子是运动的D1滴水中大约有1.67*1021个水分子分子很小例3明确宏观现象的微观本质是学习化学的重要思想方法。下列说法正确的是()A水与冰共存物是纯净物,是因为它们由同种分子构成B水结成冰,是因为温度降低,分子停止运动C水通电分解生成氢气和氧气,是因为水中含有氢分子和氧分子D水与酒精混合液的体积小于混合前二者的体积之和,是因为混合后分子体积变小三、原子(1)原子的概念:原子是化学变化中的最小微粒。化学反应的实质就是反应物分子破裂,所含各原子重新组合成新的分子。水的电解实验证明了,在化学变化中分子是可分的,而原子是不可分的。(2)原子的基本性质具有与分子相似的基本性质微粒分子原子不同点①分子是保持物质化学性质的最小微粒②在化学反应中,分子可以分为原子,原子重新组合成新的分子①原子是化学变化中的最小微粒②在化学反应中,原子不可再分,不能变成其他微粒联系原子分子(3)原子的构成原子核(带正电)核外电子(每个电子带一个单位负电荷)质子(每个质子带一个单位正电荷)中子(不带电)例4原子和分子的根本区别是()A大小不同B能否直接构成物质C能否保持物质的物理性质D在化学反应中能否再分稀有气体、铜、铁、金刚石、硅等是由原子构成的物质。(4)构成原子的粒子间的关系在原子中,核电荷数(原子核所带的正电荷数)=质子数=核外电子数因此原子不显电性原子的质子数(或核电荷数)决定原子的种类,因此不同种类的原子,核内质子数不同。原子一般(不是所有)由核内质子、中子和核外电子这三种粒子构成的。例5紫薯中含有被誉为“抗癌大王”的硒元素,已知硒原子的核电荷数为34,中子数为44,则硒原子的核外电子数为()A、10B、34C、44D、78普通氢原子中只有一个质子和一个核外电子。(5)相对原子质量与相对分子质量相对原子质量(Ar)=某原子的实际质量(Kg)/[标准碳原子的质量(Kg)X1/12]相对分子质量相对分子质量等于构成分子的各原子的相对原子质量的总和。明确组成物质的分子的化学符号例6已知一个二氧化硫(SO2)分子的质量为nKg,一个三氧化硫(SO3)分子的质量为mKg(设两分子中的硫原子和氧原子分别相同),若以一个氧原子质量的1/16作为相对原子质量的标准,则SO2的相对分子质量为()A、16m/(m-n)B、16n/(m-n)C、16n/(n-m)D、32n/(m-n)(6)原子核外电子排布原子核及核内质子数电子层该层容纳的电子数举例:NaCl的形成为什么钠原子与氯原子接触时会形成钠离子和氯离子,进而形成氯化钠呢?四、离子(带电荷的原子或原子团)①原子团失去电子而带正电荷,形成阳离子。②原子团得到电子而带负电荷,形成阴离子。2Mg2+表示每个镁离子带2个单位的正电荷表示2个镁离子例7下列关于原子与离子之间的区别,叙述正确的是()A、原子可以直接构成物质,离子不可以直接构成物质B、原子和离子中质子数都与核外电子数相等C、原子可以通过得失电子转化成离子,离子不可以转化成原子D、原子不带电,离子带电第2节组成物质的化学元素一、元素(1)定义元素是具有相同核电荷数(及质子数)的同一类原子的总称。一般可分为金属元素和非金属元素。(2)元素与原子的区别联系项目元素原子区别①宏观概念,只讲种类,不讲个数;②用于表示物质的宏观组成,如水是由氢元素和氧元素组成的。①微观概念,既讲种类,又讲个数;②用于表示物质的微观结构,如一个水分子是由2个氢原子和1个氧原子构成的。联系原子是元素的个体,元素是同一类原子的总称。例1元素观是化学的重要观念之一。下列有关元素的说法错误的是()A、物质都是由元素组成的B、同种元素的原子核内中子数相同C、在化学变化中元素的种类不发生改变D、决定元素种类的是质子数二、单质、化合物、氧化物以及物质的简单分类混合物(多种物质)纯净物(一种物质)单质(同种元素)化合物(多种元素)稀有气体金属非金属氧化物其他三、自然界中元素的存在地壳:氧、硅、铝、铁、钙,氧元素几乎占地壳中各元素总含量的一半海洋:氧、氢、氯、钠、镁,其中氧元素和氢元素约占总量的96.5%人体:水占体重的70%左右,氧、碳、氢、氮、钙、磷等太阳:最丰富的元素是氢,其次是氦,还含有碳、氮、氧和多种金属元素。四、元素与人体健康缺钙:骨质疏松、畸形、易患佝偻病;钙吸过量:白内障、动脉硬化缺锌:儿童发育停滞、智力低下,侏儒症缺钴、铁:贫血缺碘(碘过量):甲状腺疾病微量硒可以防癌;过量硒则是致癌的因素之一。第3节物质的组成一、化学式(用元素符号和数字的组合表示物质组成的式子)项目化学式的含义以“H2O”为例宏观表示一种物质表示水这种物质表示该物质的元素组成表示水是由氢元素和氧元素组成的微观表示该物质的一个分子表示一个水分子表示该物质的分子构成表示一个水分子是由两个氢原子和一个氧原子构成的例1水是生命的源泉。下面对水的化学式H2O的意义的理解,错误的是()A、水是一种氧化物B、水是由氢、氧两种元素组成的C、水分子中含有氢、氧两种原子D、水分子中含有两个氢原子、一个氧原子二、化合价(化合价是元素的性质)(1)常见元素及原子团的化合价①常见元素的化合价一价氢氯钾钠银,二价氧钙钡镁锌三铝四硅五价磷二三铁,二四碳,二四六硫都齐全铜汞二价最常见氢一氧二为标准单质零价永不变②常见原子团的化合价氢氧根、硝酸根、硫酸根、碳酸根、铵根三、化学式的书写1、单质化学式(1)直接用元素符号表示单质:(适用于原子直接构成物质)金属单质稀有气体单质部分非金属固态单质如:钠(Na)银(Ag)汞(Hg)等如:氦气(He)氖气(Ne)等如:金刚石(C)等(2)用元素符号和数字表示单质:(体现分子实际形态)非金属单质:如氢气(H2)、氧气(O2)、氮气(N2)、氯气(Cl2)、臭氧(O3)等。2、化合物的化学式:弄清物质的组成元素或原子团确定元素原子或原子团的个数关系确定元素原子或原子团的前后关系例:写出氧化铝、氢氧化镁的化学式四、化合价的书写方法+1+2常见正价元素:H2OCaCO3-1-2常见负价元素:HClMgO-1–1+1–2–2原子团:OHNO3NH4SO4CO300单质化合价:H2Cu元素的化合价通常标在元素符号或原子团的正上方,一般把“+,-”号写在前面(均不能省略),价数写在后面(1不能省略)。1、写出组成元素或原子团的符号一般:正价在左(前);负价在右(后);一般:金属在左(前);非金属在右(后);一般:非金属氧化物中非金属元素在左(前);氧元素在右(后);2、化合物中各元素的化合价代数和等于零。3、将原子(或原子团)个数标在元素右下角(个数1省略不写),原子团≧2时要用括号括起来。化合物的化学式书写要领化合价的应用:(化合物中各元素的化合价代数和等于零)标出下列物质中加横线元素化合价:KMnO4CaCO3H2O2H2SO4KClO3K2Cr2O7五、有关化学式计算的方法技巧1、比例守恒法:根据化学式表示的化合物中任两种元素间的质量比为一定值,抓住不同物质化学式间的关系,可巧算混合物中某元素的质量分数。例:由FeSO4和Fe2(SO4)3组成的混合物中S的质量分数为a%,求Fe的质量分数?解答时抓住两种物质都由Fe和SO4组成,无论其怎样混合,其中S、O原子个数比总是1:4,即质量比总为32:16*4=1:2。a%~2a%~1-3a%2、转换法:将目标元素的原子个数转换为“1”,然后计算目标元素以外的原子的质量,最后比较即可。例:在FeO、Fe2O3、Fe3O4、FeS中铁元素的质量分数由大到小的排列顺序是?FeO、Fe2O3、Fe3O4、FeS可以转化为FeO、FeO3/2、FeO4/3、FeO2(1个S原子的质量=2个O原子)。把Fe原子以外的其他原子的质量计算出来,其他原子的质量越大,Fe原子的质量分数越小,则铁元素的质量分数由大到小的顺序为FeO、Fe3O4、Fe2O3、FeS。3、平均值法:巧解混合物问题的一种常见的方法。其数学依据是两个数M1、M2的算式平均值M一定介于两者之间。求得平均值后,就可判断出各成分的数值范围:要么都等于中间值,要么必有一种大于平均值,一种小于平均值。4、关系式法:关系式法是根据化学式所包含的各种比例关系,找出已知量与未知量之间的比例关系,直接列比例式进行计算的方法。例:多少克硫酸铵[(NH4)2SO4]与42.4g尿酸[CO(NH2)2]所含的氮元素的质量相等?例:乙烯(C2H4)是石油炼制的重要产物之一。常温常压时,乙烯是一种气体,它与另一种气体组成的混合物中碳元素的质量分数为87%,则另一种气体可能是()。A.H2B.CH4C.C2H2D.CO



















