


《《有机化学炔烃二烯烃》化学课件PPT下载》是由用户上传到老师板报网,本为文库资料,大小为3.69 MB,总共有67页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 67页
- 3.69 MB
- VIP模板
- ppt
- 数字产品不支持退货
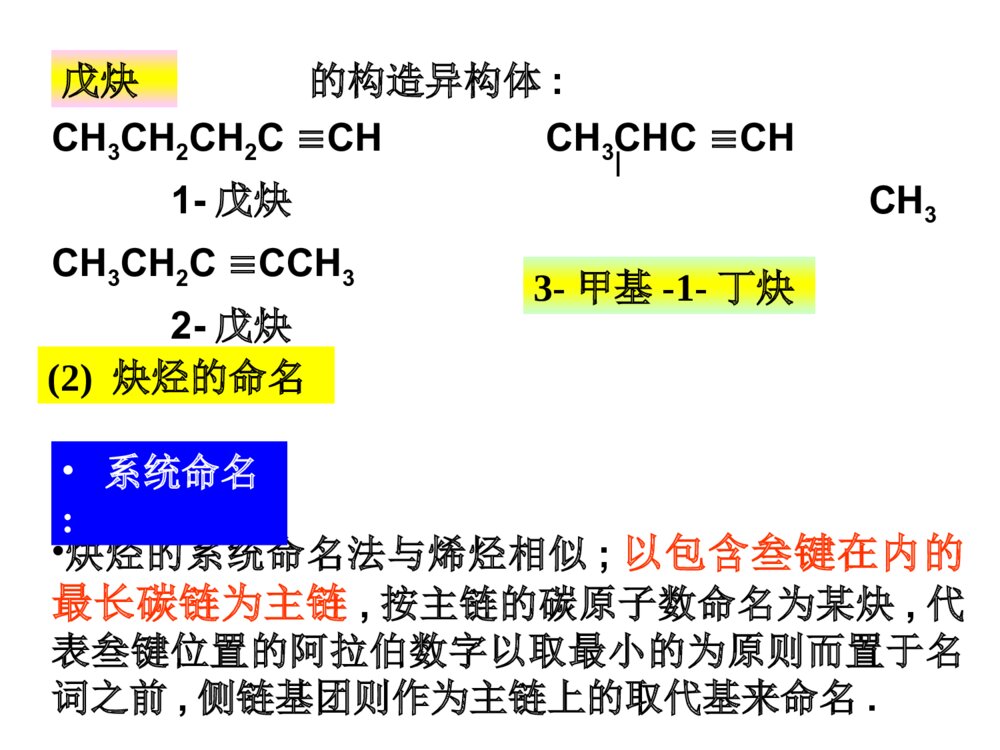
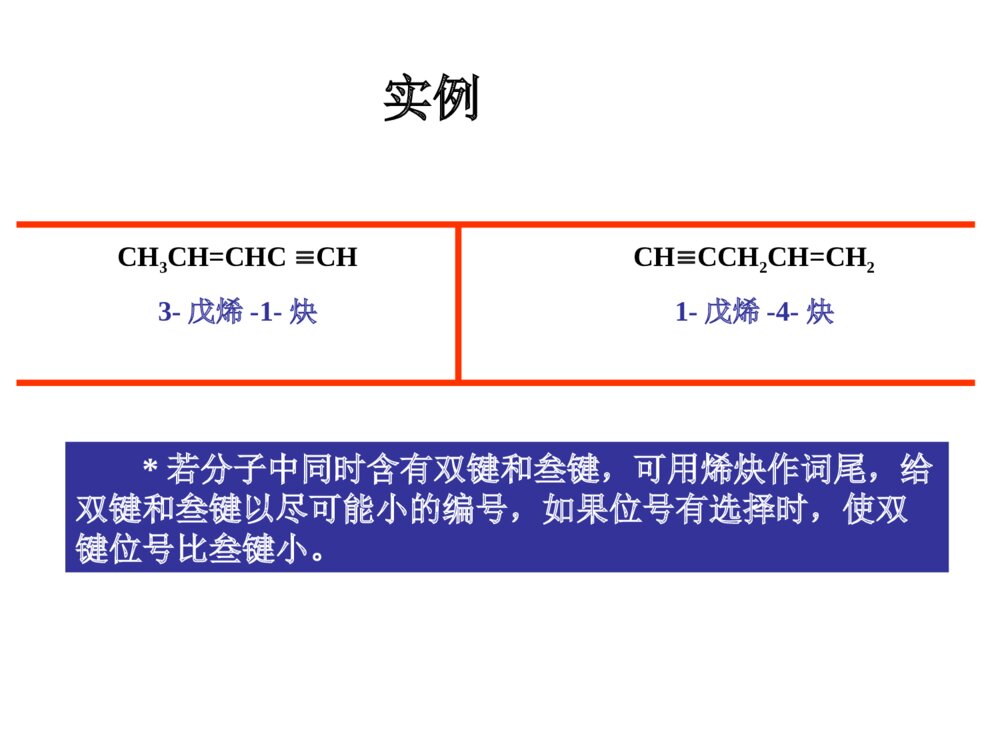
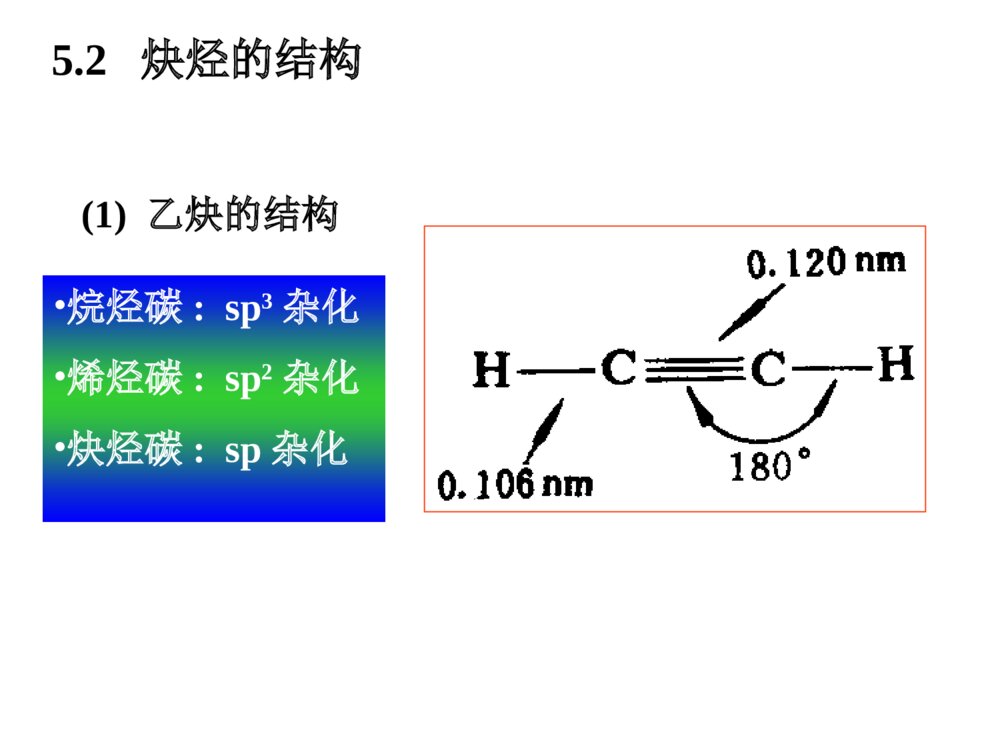
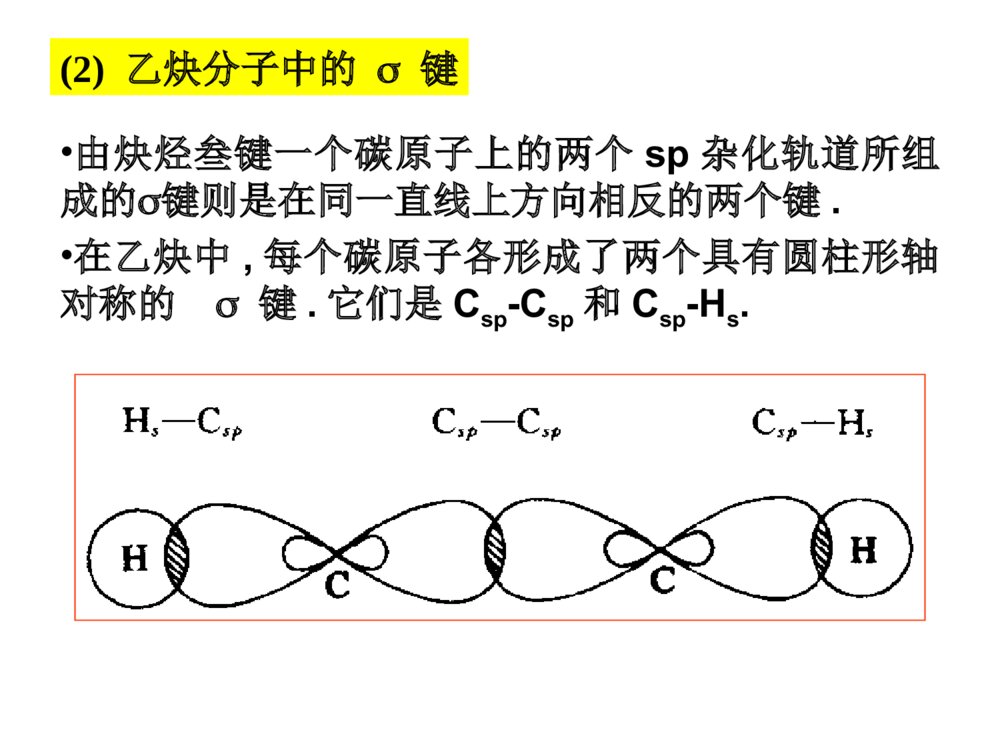
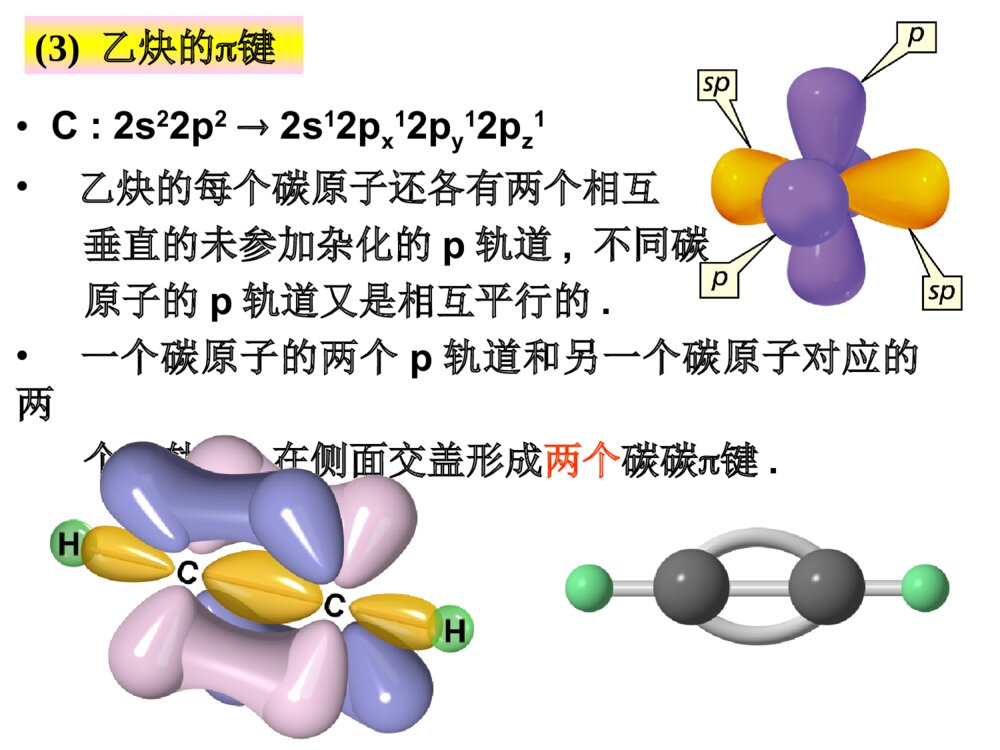
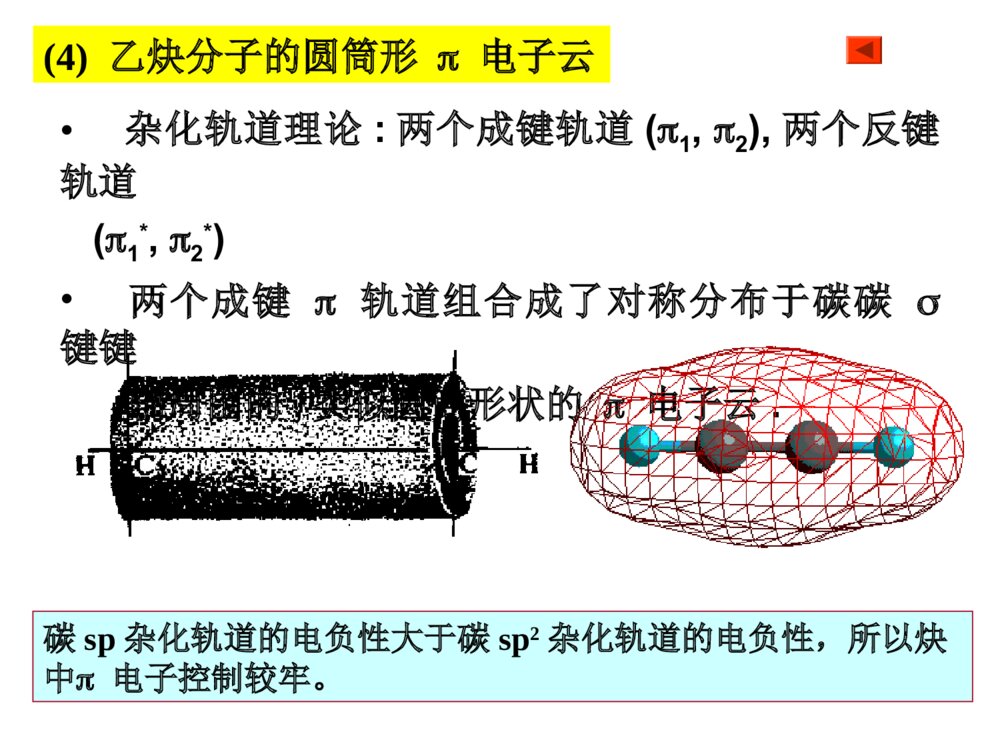
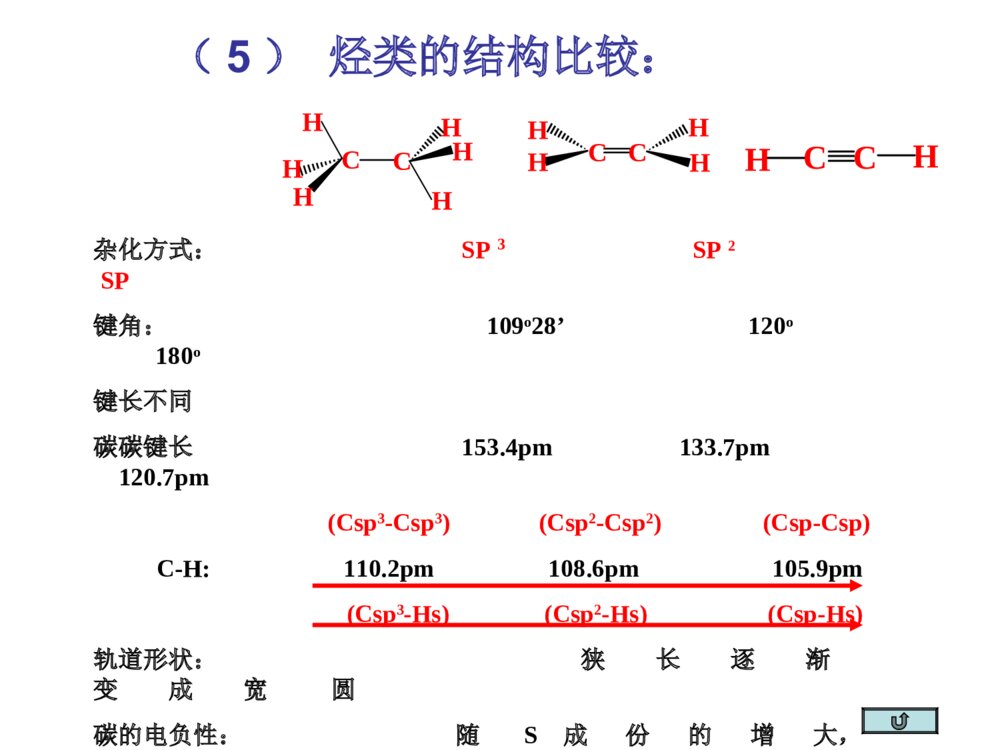
第一部分炔烃第二部分二烯烃本章提纲5.1炔烃的异构和命名定义:分子中含有碳碳叁键的烃叫做炔烃,它的通式:CnH2n-2.官能团为:-CC-(1)异构体——从丁炔开始有异构体.•同烯烃一样,由于碳链不同和叁键位置不同所引起的.由于在碳链分支的地方不可能有叁键的存在,所以炔烃的异构体比同碳原子数的烯烃要少.由于叁键碳上只可能连有一个取代基,因此炔烃不存在顺反异构现象.几个重要的炔基:HCC-CH3CC-HCCCH2-乙炔基1-丙炔基2-丙炔基ethynyl1-propynyl2-propynyl•的构造异构体:CH3CH2CH2CCHCH3CHCCH1-戊炔CH3CH3CH2CCCH32-戊炔•炔烃的系统命名法与烯烃相似;以包含叁键在内的最长碳链为主链,按主链的碳原子数命名为某炔,代表叁键位置的阿拉伯数字以取最小的为原则而置于名词之前,侧链基团则作为主链上的取代基来命名.3-甲基-1-丁炔戊炔(2)炔烃的命名•系统命名:实例CH3CH=CHCCH3-戊烯-1-炔CHCCH2CH=CH21-戊烯-4-炔*若分子中同时含有双键和叁键,可用烯炔作词尾,给双键和叁键以尽可能小的编号,如果位号有选择时,使双键位号比叁键小。5.2炔烃的结构•烷烃碳:sp3杂化•烯烃碳:sp2杂化•炔烃碳:sp杂化(1)乙炔的结构•由炔烃叁键一个碳原子上的两个sp杂化轨道所组成的键则是在同一直线上方向相反的两个键.•在乙炔中,每个碳原子各形成了两个具有圆柱形轴对称的键.它们是Csp-Csp和Csp-Hs.(2)乙炔分子中的键•C:2s22p22s12px12py12pz1•乙炔的每个碳原子还各有两个相互垂直的未参加杂化的p轨道,不同碳原子的p轨道又是相互平行的.•一个碳原子的两个p轨道和另一个碳原子对应的两个p轨道,在侧面交盖形成两个碳碳键.(3)乙炔的键•杂化轨道理论:两个成键轨道(1,2),两个反键轨道(1*,2*)•两个成键轨道组合成了对称分布于碳碳键键轴周围的,类似圆筒形状的电子云.(4)乙炔分子的圆筒形电子云碳sp杂化轨道的电负性大于碳sp2杂化轨道的电负性,所以炔中电子控制较牢。杂化方式:SP3SP2SP键角:109o28’120o180o键长不同碳碳键长153.4pm133.7pm120.7pm(Csp3-Csp3)(Csp2-Csp2)(Csp-Csp)C-H:110.2pm108.6pm105.9pm(Csp3-Hs)(Csp2-Hs)(Csp-Hs)轨道形状:狭长逐渐变成宽圆碳的电负性:随S成份的增大,逐渐增大。pka:~50~40~25(5)烃类的结构比较:CCHHHHHHHHHHCCHHCC5.3炔烃的物理性质自学!!5.4.1三键碳上氢原子的弱酸性R-CCHR-CC-+H+碳氢键的断裂也可以看作是一种酸性电离,所以将烃称为含碳酸含碳酸的酸性强弱可用pka判别,pka越小,酸性越强。烷烃(乙烷)〈烯烃(乙烯)氨〈末端炔烃(乙炔)〈乙醇〈水〈HFpka~50~4434251615.73.2酸性逐渐增强其共轭碱的碱性逐渐减弱5.4炔烃的化学性质CHCNa+C2H5BrCHC-C2H5•与金属钠作用CHCHCHCNaNaCCNa•与氨基钠作用RCCH+NaNH2RCCNa+NH3•烷基化反应NaNa液氨液氨—得到碳链增长的炔烃炔化物的生成RCCHRCC-Li++n﹣C4H9n-C4H9Li,THF,RCCHRCCMgBr+C2H6C2H5MgBrR-CCHR-CCCuR-CCNaR-CCAgR-CCCuR-CCH+Ag(CN)-2+HO-R-CCAgR-CCH+AgNO3R-CCH+Cu2(NO3)2NaNH2Ag(NH3)+2NO3Cu(NH3)+2ClHNO3HNO3-CN+H2O纯化炔烃的方法鉴别方法红色白色1加HX*1与不对称炔烃加成时,符合马氏规则。*2与HCl加成,常用汞盐和铜盐做催化剂。*3由于卤素的吸电子作用,反应能控制在一元阶段。*4反式加成。CH3CH2CCCH2CH3+HCl催化剂97%HCH3CH2CCClCH2CH35.4.2加成反应加HBr时:RCCH+HBrRCBr=CH2RCCH+HBrRCH2CHBr2过氧化物或光照无过氧化物既能发生亲电加成,又能发生自由基加成。烯、炔烃与HBr都有过氧化物效应!CHCHH2O,HgSO4-H2SO4[CH2=CH-OH]互变异构CH3CH=ORCCHH2O,HgSO4-H2SO4[CH2=CR-OH]互变异构CH3C=ORRCCR’H2O,HgSO4-H2SO4[CHR’=CR-OH]+[CHR=CR’-OH]互变异构R’CH2CR+RCH2CR’==OO*1Hg2+催化,酸性。*2符合马氏规则。*3乙炔乙醛,末端炔烃甲基酮,非末端炔烃两种酮的混合物。2加水记住反应条件!官能团异构体:分子式相同、分子中官能团不同而产生的异构体。互变异构体:分子中因某一原子的位置转移而产生的官能团异构体。C2H6O:CH3CH2OH,CH3OCH3HCH3CCHCH3OHCH3CCHCH3O互变异构烯醇式酮式*1CH2=CH-CH2-CCH+Br2(1mol)CH2BrCHBr-CH2-CCH*2HCCHCl2Cl2FeCl3FeCl3CHCl2-CHCl2HHCCClCl反应能控制在这一步。*3加氯必须用催化剂,加溴不用。3加卤素Br2?RCCHR2BH,0oCH2O2,HO-RCH2CHOBR2HCCRH\'ROHHHCC4硼氢化反应5加氢和还原R-CC-R’H2/Ni,orPd,orPtRCH2CH2R’H2/Pd-CaCO3orPd-BaSO4orNiBR\'HRHCCR\'HRHCC硼氢化RCOOH~0oCR\'HRHCCNa,NH3R\'HRHCCLiAlH4(THF)(>90%)(90%)(82%)反式顺式反式顺式例:催化加氢选择性*1CH2=CH-CH2CH2-CCH+H2(1mol)CH3CH2CH2CH2-CCH烯烃比炔烃易氢化*2CH2=CH-CCH+H2(1mol)CH2=CH-CH=CH2共轭双键较稳定NiNi例:将(Z)-2-戊烯转变为(E)-2-戊烯定义:亲核试剂进攻炔烃的不饱和键而引起的加成反应称为炔烃的亲核加成。常用的亲核试剂有:ROH(RO-)、HCN(-CN)、RCOOH(RCOO-)1.CHCH+HOC2H5CH2=CHOC2H5碱,150-180oC聚合,催化剂[CH2-CH]nOC2H5粘合剂炔烃亲核加成的区域选择性:优先生成稳定的碳负离子。6炔烃的亲核加成2.CHCH+CH3COOH3.CHCH+HCNCH2=CH-CNZn(OAc)2150-180oCCH2=CH-OOCCH3聚合,催化剂[CH2-CH]n[CH2-CH]nOOCCH3H2O[CH2-CH]nOH乳胶粘合剂现代胶水CuCl2H2O,70oC聚合,催化剂[CH2-CH]nCN人造羊毛RCCR’KMnO4(冷,稀,H2O,PH7.5)KMnO4(H2O,100oC)KMnO4(HO-,25oC)RCOOH+R’COOH(1)O3(2)H2O,ZnBH3H2O2,HO-RCH2CR’=O5.4.3氧化反应RCCROOHCCRR\'3BOHHCCRR\'RCOOH+R’COOHRCOOH+R’COOH•只生成几个分子的聚合物CHCH+CHCHCH2=CH-CCH乙烯基乙炔CH2=CH-CCHCH2=CH-CC-CH=CH2二乙烯基乙炔3CHCH4CHCHCu2Cl3+NH4ClH2OCHCH催化剂Ni(CN)2,(C6H6)3P醚苯Ni(CN)2醚环辛四烯5.4.4聚合反应•焦炭和石灰在高温电炉中反应3C+CaOCaC2+COCaC2+H2OCHCH+Ca(OH)2•甲烷的部分氧化法2CH4CHCH+3H24CH4+O2CHCH+2CO+7H22000℃1500℃0.01~0.1s5.5.1乙炔的生产(1)碳化钙法生产乙炔(2)由天然气或石油生产乙炔5.5炔烃的制备(A)乙炔不稳定,易分解:CHCH2C+H2=-227kJ/mol(B)乙炔的爆炸极限:3%~80%.为避免爆炸,一般用浸有丙酮的多孔物质(如石棉,活性炭)吸收乙炔后储存钢瓶中,以便于运输和使用.(C)乙炔燃烧:2CHCH+5O24CO2+2H2O=-270kJ/mol--乙炔在氧中燃烧所形成的氧炔焰最高可达3000,℃因此广泛用来熔接或切割金属.H2C=CH-Cl氯乙烯[H2C=CH-OH]CH3CHO乙醛CHCHH2C=CH-OCH3甲基乙烯基醚H2C=CH-CN丙烯腈H2C=CH-OCOCH3乙酸乙烯酯•—这些反应的结果可看成是这些试剂的氢原子被乙烯基(H2C=CH-)取代,因此这些反应又叫做乙烯基化反应.•它们的聚合物大多数是合成树脂,塑料,合成纤维及合成橡胶原料.HClHOHCH3OHHCNCH3COOH乙烯基化反应(D)乙炔作为原料5.5.2由二元卤代烷制备炔烃用邻二卤代烷和偕二卤代烷制备CH3CHBr-CHBrCH3KOH-C2H5OHorNaNH2的矿物油<100oCCH3CH2-CBr2CH3CH3CH=CCH3BrKOH-C2H5OH,>150oCNaNH2的矿物油,150-160oCCH3CCCH3NaNH2KOH-C2H5OHCH3CH2CCH叁键移位5.5.3由金属炔化物制备炔烃CH3CH2CCH空气,CuCl,NH3,CH3OHCH3CH2CC-CCCH2CH3二聚RMgXNaNH2RLiCH3CH2CCMgXR’XCH3CH2CCNaC2H5CCR’R’XR’XCH3CH2CCLi*叁键无法移位时,产物是唯一的。从指定原料合成CHCHNaNH2CHCNaCH3CH2CH2ClCHCCH2CH2CH3NaNH2CCCH2CH2CH3NaCH3(CH2)6CH2ClCH3(CH2)7CCCH2CH2CH3H2/LindlarPdCCH3C(H2C)6H2CCH2CH2CH3HH炔烃的反应RCCR1NaNH2RCCNa+-n-C4H9LiRCCLiC2H5MgBrRCCMgBrM(NH3)2NO3,M=Ag(I),Cu(I)RCCMHXRCCXHXRCCH2R1XXROOR/HBr也存在反马氏加成R1=HR1=HR1=HH2ORCCH2R1OHgSO4X2HR1RCCXXR1X2RX2CCX2R1LindlarPdH2RCCHR1HBH3/H2O2RH2CCR1OO3RCOOH+R1COOHR1=H5.6二烯烃的分类和命名含有两个双键的碳氢化合物称为双烯烃或二烯烃。CnH2n-2CH2=C=CH2CH2=CHCH2CH2CH=CH2CH2=CH-CH=CH2丙二烯1,5-己二烯1,3-丁二烯(累积二烯烃)(孤立二烯烃)(共轭二烯烃)分子中单双键交替出现的体系称为共轭体系,含共轭体系的多烯烃称为共轭烯烃。双烯体的异构现象:S-(Z)-1,3-丁二烯S-(E)-1,3-丁二烯HCH2CH2CCHHHCH2CH2CC无法改变的S-顺构象无法改变的S-反构象二环[4.4.0]-1,9-癸二烯•最简单的共轭二烯烃--1,3-丁二烯结构:5.7共轭二烯烃的结构及特性1,3-丁二烯结构S-反式和S-顺式—共轭分子体系中键的离域而导致分子更稳定的能量.离域能越大,表示该共轭体系越稳定.共轭体系—单双键交替的共轭体系叫,共轭体系.共轭效应—这个体系所表现的共轭效应叫做,共轭效应.1,3-戊二烯的离域能(共轭能)离域能1,3-丁二烯中碳原子是sp2杂化,而乙烷中碳原子是sp3杂化,S成分增加,轨道尺寸缩小,键长缩短。1,3-丁二烯中P轨道在C2与C3之间也发生重叠,π电子离域,分子内能降低,氢化热数据减小,键长缩短。CH2=CHCH2ClCH2=CHCH2++Cl-p,-共轭效应—由键的p轨道和碳正离子中sp2碳原子的空p轨道相互平行且交盖而成的离域效应,叫p,共轭效应.缺电子体系等电子体系多电子体系P-共轭CH2=CHCH2+CH2=CHCH2CH2=CHCH2ˉ·+CH2=CH-CH2烯丙型正离子苄基正离子烯丙基氯和苄基氯分子中的氯原子非常活泼,很容易发生取代反应和消除反应,一般比叔卤烷中卤原子活性要大。卤烃反应活性次序:烯丙基卤、苄卤>叔卤烷>仲卤烷>伯卤烷>乙烯型卤、苯基型卤烯丙型和苄基型卤代烃(1)亲核取代反应(与OHˉ、ORˉ、CNˉ、NH3容易)CH2=CH-CH2-ClCuCN,硝基苯CH2=CH-CH2-CN(2)消除反应(3)与金属镁反应————CH2-Cl+MgCH2-MgClCHCH2CH2CH3Br∣CH=CH2CH2CH3KOH,C2H5OH纯醚烯丙型卤代烃的反应(4)与二烷基铜锂反应烯丙基氯与HX加成时,由于双键受卤原子的诱导作用,负性基团主要加在1位上(反马式加成):CH2=CH-CH2Cl+HXCH2-CH2-CH2ClX-(5)加成反应——CH2Cl+CH3(CH2)3CuLi(CH2)4CH3纯醚乙烯式卤代烃(1)乙烯型和苯基型卤原子的活泼性氯乙烯和氯苯很相似,由于p-共轭的结果,电子云分布趋向平均化,因此C-Cl键的偶极矩将减小,键长缩短。意味着C-Cl之间结合得更加紧密,致使氯原子的活泼性降低,不易发生一般的取代反应,使C=C之间的键长拉长。(1)双键碳上有取代基的烯烃和共轭二烯烃的氢化热较未取代的烯烃要小些.说明:有取代基的烯烃和共轭二烯烃更稳定.(2)产生原因:双键的电子云和相邻的碳氢键电子云相互交盖而引起的离域效应.HCH2=CH-C-HH超共轭效应表示:超共轭作用(﹣共轭)例1:例2:CH3CH2+在乙基碳正离子中,有三个sp2杂化轨道,还有一个空p轨道.碳氢键和空p轨道有一定程度的交盖,使电子离域并扩展到空p轨道上.使正电荷有所分散,增加碳正离子的稳定性.和碳正离子相连的碳氢键越多,也就是能起超共轭效应的碳氢键越多,越有利于碳正离子上正电荷的分散,就可使碳正离子的能量更低,更趋于稳定.正碳离子稳定顺序:3°>2°>1°则不同结构烯烃的稳定性次序如下:CH2=CH2<RCH=CHR<R2C=CHR<R2C=CR2例1:CH2=CH-CH=CH2+Br2CH2-CH-CH=CH2+CH2-CH=CH-CH2BrBrBrBr1,2-加成产物1,4加成产物例2:CH2=CH-CH=CH2+HBrCH2-CH-CH=CH2+CH2-CH=CH-CH2HBrHBr1,2-加成产物1,4加成产物5.8.11,2-加成和1,4-加成加卤素和卤化氢5.8共轭二烯烃的性质•共轭二烯烃的亲电加成产物1,2-加成和1,4-加成产物之比与结构,试剂和反应条件有关.例如:1,3-丁二烯与HBr加成产物(1)0℃下反应:1,2-加成产物占71%,1,4-加成产物占29%(2)在40℃下反应:1,2-加成产物占15%,1,4-加成产物占85%热力学控制?动力学控制?产物稳定性?反应活化能大小?•低温下1,2加成为主是由于反应需要的活化能较低.•高温下1,4加成为主是由于1,4加成产物更稳定.1,4-加成1,2-加成丁二烯与HBr亲电加成的反应机理共轭双烯与含有烯键或炔键的化合物相互作用,生成六元环状化合物的反应称为狄尔斯--阿尔德反应。+双烯体亲双烯体环状过渡态产物对双烯体的要求:(1)双烯体的两个双键必须取S-顺式构象。(2)双烯体1,4位取代基位阻较大时,不能发生该反应。二反应机理及例子狄尔斯-阿尔德(Diels-Alder)反应5.8.2双烯合成与电环化反应OOO+OOOHH双烯体亲双烯体三D--A反应的特点:1反应具有很强的区域选择性+OCH3CHOOCH3OCH3CHOCHO+CH3CHO+CH3CH3CHOCHO+70%100%0%30%当双烯体和亲双烯体上均有取代基时,可产生两种不同的产物,实验证明:邻或对位的产物占优势。2反应是立体专一的顺式加成反应COOHHHHOOC+COOHHHCOOHHCOOHCOOHH+COOHHCOOHH+COOHCOOHHH参与反应的亲双烯体顺反关系不变3D-A反应是一个可逆反应,提高温度利于逆向分解反应。四D-A反应的应用:1合成环状化合物+CHO=HCHOKMnO4HOOCCOOHCOOHCHO***H2利用可逆性提纯双烯化合物,鉴别双烯化合物。3利用逆反应制备不易保存的双烯体。+200oC,20MPa200oC镍铬丝写出下列反应的产物(1)+EtO2CCCCO2Et(2)+CH2=C(CO2CH3)2(3)CH3+CH2=CHCO2CH3(4)+HCCCO2CH3CO2EtCO2EtCO2CH3CO2CH3HCO2CH3H3CO2CH+CO2CH3小结:共轭体系发生共轭加成的实例CH2=CH-CH=CH2CH2=CH-CHCH2CH2=CH-CH=CH2nCH2=CH-CH=CH2CH2=CH-CH=CH2CH2Br-CHBr-CH=CH2CH3-CHCl-CH=CH2CH2Br-CH=CH-CH2BrBr2,冰醋酸1,2-加成1,4-加成CH3-CH=CH-CH2ClHCl1,2-加成1,4-加成聚合[CH2-CH=CH-CH2]n电环合,hCH2=CH-CH=CH2+双烯加成5.8.3二烯烃的聚合——合成橡胶1处理:橡胶植物-----胶乳-----经醋酸处理后凝固-----经压制成生橡胶(线状结构,加热变软,溶剂溶涨)-------经加硫处理成天然橡胶(网状结构,性能良好)-------成型加工成橡胶制品。2结构:顺-1,4-聚异戊二烯3发展史天然橡胶和合成橡胶合成橡胶通用合成橡胶:顺丁橡胶、乙丙橡胶、异戊橡胶、丁苯橡胶特种合成橡胶:用于特殊用途。甲基橡胶(第一次世界大战,德),丁钠橡胶(1910-1932俄),氯丁橡胶(1925-1937美),丁苯橡胶(1933-1937德),丁腈橡胶(1925-1937德)硫桥•丁二烯是制备丁钠,顺丁和丁苯橡胶的重要原料•主要由石油裂解而得的C4馏分(丁烯,丁烷等)进一步脱氢而得:1-3丁二烯丁腈橡胶-—丁二烯+丙烯腈聚合nCH2=CH-CH=CH2-(-CH2-CH-CH-CH2-)-n例2:--CH2-CH=CH-CH2--CH2-CH=CH-CH2----CH2-CH-CH2-CH--CHCHnCH2=CH-CH=CH2CH2CH2--CH2-CH--CH2-CH=CH-CH2--CHCH2Na60℃‖‖‖1,4加成1,2加成1,2和1,4加成丁钠橡胶例:共轭二烯烃与其他双键化合物共聚:•丁苯橡胶—丁二烯+苯乙烯聚合•丁基橡胶—异戊二烯+异丁烯聚合5.9周环反应大纲对工科学生不要求此节!作业:P1195-1:(1),(2),(5)5-3,5-5,5-6



















