





《鲁科版化学20版必修二1.1.2《原子结构与元素性质原子结构元素周期律》PPT课件》是由用户上传到老师板报网,本为文库资料,大小为935.86 KB,总共有128页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 128页
- 935.86 KB
- VIP模板
- pptx
- 数字产品不支持退货
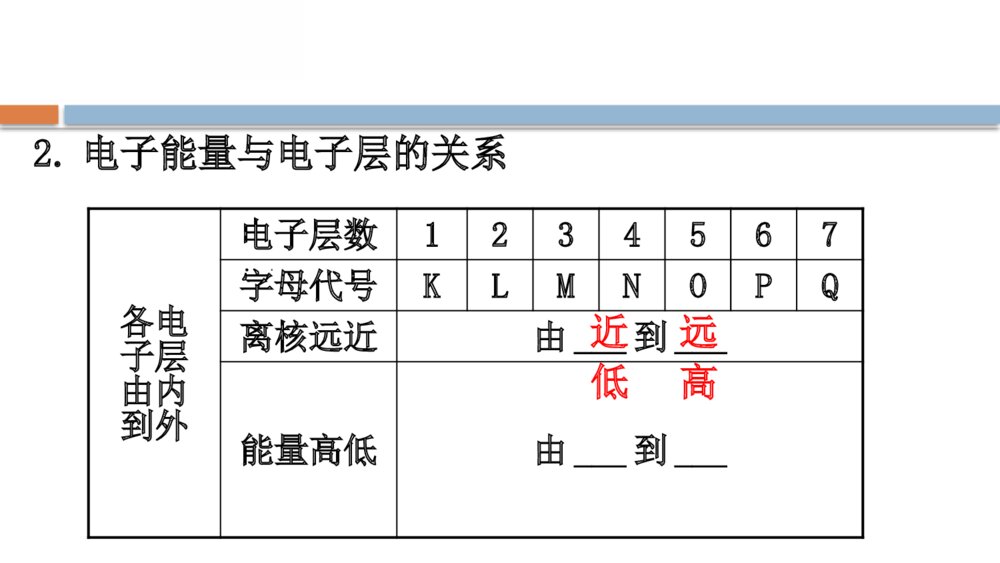
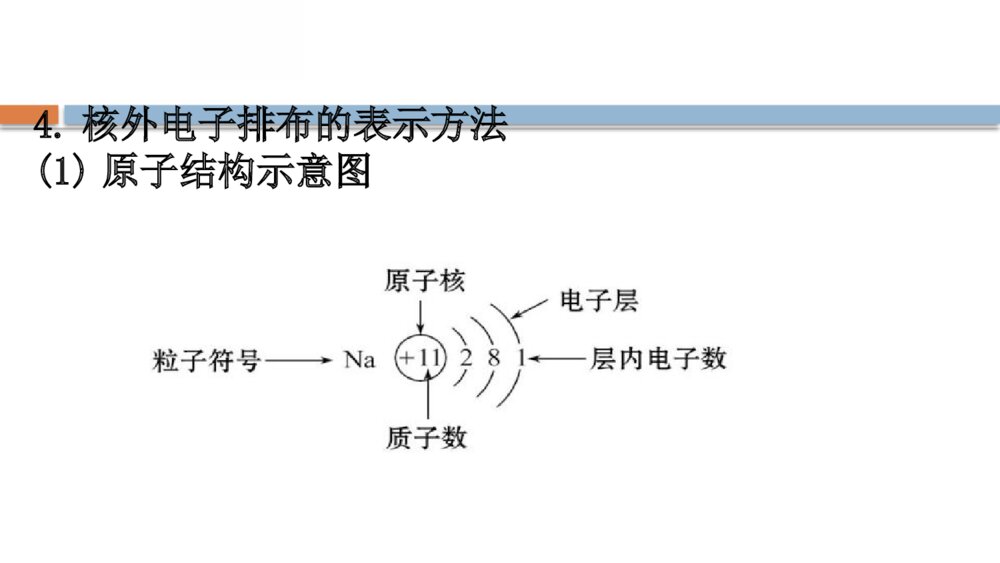
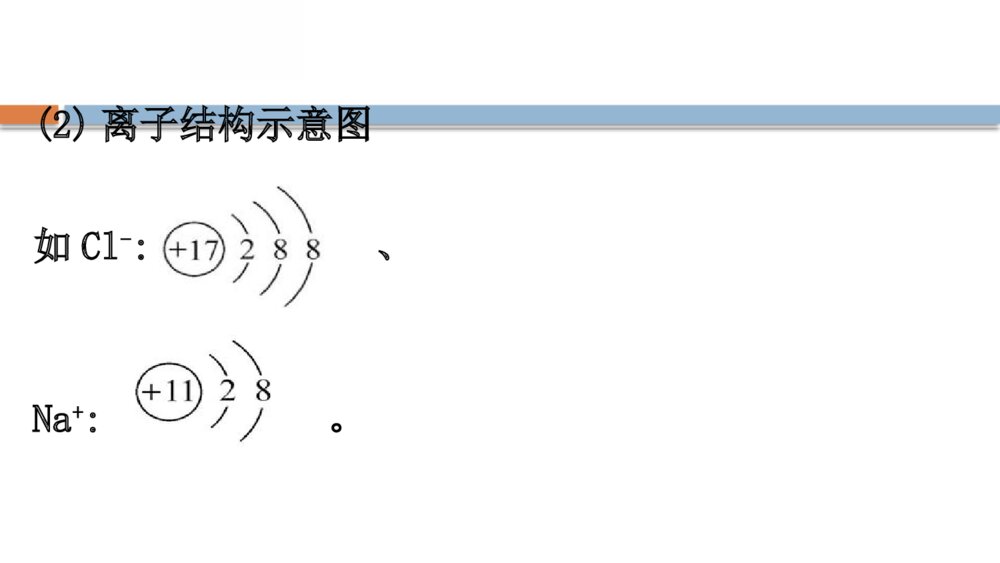
第1章 原子结构 元素周期律 第1节 原子结构与元素性质第2课时核外电子排布原子结构与元素原子得失电子能力 一、核外电子排布1.原子核外电子排布的特征2.电子能量与电子层的关系各电子层由内到外电子层数1234567字母代号KLMNOPQ离核远近由___到___能量高低由___到___近远低高3.原子核外电子排布的一般规律【巧判断】(1)距核越近的电子能量越高。( )提示:×。核外电子排布的原则是距核由近及远,能量由低到高依次排列,所以距核越近的电子能量越低。(2)每层电子容纳的电子数必须是2n2个。( )提示:×。每层电子容纳的电子数最多是2n2个,可以少于这个数。(3)钾元素是19号元素,钾原子最外层电子数是9个。( )提示:×。最外层电子数不能超过8个,所以钾原子的最外层是1个电子。【情境·思考】洋葱是我们非常熟悉的一种蔬菜,洋葱切开后,我们会看到里面一层一层的呈现,电子层模型类似于切开的洋葱。请思考:(1)原子核周围是否真实存在这样的壳层?提示:电子层不是真实存在的,是科学家为了表达形象,根据电子经常出现的区域而设想的结构模型。(2)电子在原子核外是否沿固定轨迹做高速旋转?提示:电子在某一区域内做无规则运动。4.核外电子排布的表示方法(1)原子结构示意图(2)离子结构示意图如Cl-:、Na+:。【情境·思考】KCl在医学上有很重要的用途,主要用于治疗各种原因引起的低钾血症,预防低钾血症,以及治疗洋地黄中毒引起频发性、多源性早搏或快速心律失常等。【情境·思考】(1)画出Cl、K、Cl-、K+的结构示意图。(2)从结构示意图上可以得出Cl-和K+的结构示意图有什么异同点?提示:(1)(2)相同点是核外电子排布方式完全相同,不同点是核电荷数不同。5.元素性质与原子最外层电子数之间的关系(1)元素的性质与原子最外层电子排布的关系元素种类金属元素非金属元素稀有气体元素最外层电子数一般小于__一般大于或等于____(He为__)4482元素种类金属元素非金属元素稀有气体元素原子得失电子的能力一般易___电子一般易___电子既不易___电子,也不易___电子单质具有的性质具有______性具有_____性一般不与其他物质反应失得得失还原氧化(2)元素的化合价与原子最外层电子数的关系金属元素非金属元素稀有气体元素只显正价且一般等于最外层电子数,如、一般既有正价又有负价,最高正价=最外层电子数,最低负价=最外层电子数-8,如原子结构为稳定结构,常见化合价为零2Mg1Na71ClCl、2Mg1Na71ClCl、【巧判断】(1)稀有气体元素原子最外层都排有8个电子。( )提示:×。稀有气体He最外层有2个电子。(2)最外层电子数为4时,既不容易得电子也不容易失电子,化学性质较稳定。( )提示:√。最外层电子数为4时,形成稳定结构得失电子的概率是相等的,所以化学性质比较稳定。二、原子结构与元素原子得失电子能力1.实验探究元素NaMgK实验过程用_____切下一小块金属钠,用_____吸干表面的煤油,放入盛有水并滴加几滴酚酞的烧杯中取一小段镁条,用_____除去表面的氧化膜,放入盛有等量水并滴有酚酞的另一只烧杯中用小刀切下一小块与钠块__________的金属钾,用_____吸干表面的煤油,放入盛有等量水并滴加几滴酚酞的烧杯中小刀滤纸砂纸大小相同滤纸元素NaMgK实验现象钠___在水面上,熔成一个闪亮的小球,小球向四周移动,发出“嘶嘶”的响声,酚酞_____镁片没有变化,加热时,镁片上有气泡冒出,酚酞溶液_____钾与水立即剧烈反应,放出的热使钾立即燃烧起来,酚酞溶液_____变红变红变红浮元素NaMgK反应方程式___________________________________________________________________结论与水反应的剧烈程度:__>___>___2Na+2H2O====2NaOH+H2↑Mg+2H2OMg(OH)2+H2↑2K+2H2O====2KOH+H2↑KNaMg2.判断依据3.原因解释(1)在电子层数相同时,核电荷数越大,最外层电子离核越近,原子越难_______而越易_______;(2)最外层电子数相同,电子层数越多,最外层电子离核越远,原子越易_______而越难_______。失电子得电子失电子得电子【情境·思考】镁和铝在金属活动性顺序表中均排在氢之前,但是二者分别与盐酸反应的速率、现象不一样,①中反应剧烈,②中反应不剧烈。(1)根据图示以及镁、铝的电子层结构分析,哪个图表示的是镁与盐酸的反应?(2)试利用原子结构的观点解释反应剧烈的一方剧烈的原因是什么?提示:(1)图①。镁反应更加剧烈。(2)因镁和铝电子层数相同,铝的核电荷数更大,最外层电子离核更近,原子越难失电子,所以金属性较弱,与酸反应的剧烈程度越不剧烈。知识点一 核外电子排布的规律与核外电子排布的表示方法【重点释疑】1.核外电子排布规律解读核外电子排布规律是相互联系的,不能孤立地应用其中的一项。(1)“一低”电子首先排布在能量最低的电子层里。排满能量低的电子层,再排能量高的电子层。(2)“两不超”各电子层电子不超过2n2个;最外层电子不超过8个(第一层为最外层时不超过2个)。(3)“一稳定”2.核外电子排布的表示方法(1)原子结构示意图:为了形象表示原子核外电子分层排布的情况而采用的直观图示。如氯原子结构示意图为(2)离子结构示意图:离子结构示意图就是指原子得失电子以后的结构示意图。阳离子结构示意图与其原子结构示意图相比,少了一个电子层,核电荷数不变;阴离子结构示意图与其原子结构示意图相比,核电荷数、电子层数相同,但最外层电子数增加为8。如 【易错提醒】核外电子排布规律的正确认识(1)核外电子的排布规律是相互联系的,不能孤立地理解和应用其中的一项,必须同时满足各项要求。如当M层不是最外层时,最多可以排18个电子,而当它是最外层时,最多可以排8个电子。(2)电子不一定排满M层才排N层,如K和Ca的核外电子排布情况分别为、。【拓展提升】短周期元素原子结构的特殊性(1)最外层电子数为1的原子有H、Li、Na;最外层电子数为2的原子有He、Be、Mg。(2)最外层电子数与次外层电子数相等的原子有Be、Ar;最外层电子数是次外层电子数2倍、3倍、4倍的原子分别是C、O、Ne。(3)次外层电子数是最外层电子数2倍的原子有Li、Si。(4)内层电子总数是最外层电子数2倍的原子有Li、P。(5)电子层数与最外层电子数相等的原子有H、Be、Al;电子层数是最外层电子数2倍的原子是Li。(6)最外层电子数是电子层数2倍的原子有He、C、S;最外层电子数是电子层数3倍的原子是O。 【思考·讨论】 (1)M层上最多可容纳18个电子,为什么钾原子的核外电子排布不是,而是呢?提示:若钾原子的M层排布9个电子,此时M层就成为最外层,这与电子排布规律中的“最外层上排布的电子不能超过8个”相矛盾,不符合电子排布的规律,即M层不是最外层时最多可排18个电子,而它作为最外层时最多只能排8个电子。(2)1~20号元素形成稳定结构后最外层一定是8个电子的稳定结构吗?举例说明。提示:不一定。如Li+和H+等在形成离子变成稳定结构之后均不是8电子稳定结构。【案例示范】【典例】今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍。A和B分别是( )A.硅原子和钠原子B.硼原子和氢原子C.氯原子和碳原子D.碳原子和铝原子【思维建模】解答核外电子推断题的思路如下:【解析】选D。设x、y分别为A原子L层、M层的电子数,依题意可知:KLMA原子2xyB原子22xy+3B原子的M层至少有3个电子,因而其L层的电子数必然是8,求得x=4;对A原子来说,L层有4个电子时只能是最外层,即y=0,y+3=3,因此,A、B两原子分别为碳原子和铝原子。 【母题追问】(1)A元素的原子最外层电子数是次外层电子数的2倍,则该元素的原子核内质子数是多少?(证据推理与模型认知)提示:K层为次外层时,A元素的原子最外层电子数为2×2=4<8;L层为次外层时,A元素的原子最外层电子数为8×2=16>8,不可能,故A元素的原子核外电子数为2+4=6,即质子数为6。(2)当第n电子层作为原子的最外层时,其最多容纳的电子数与(n-1)层相同;当第n电子层作为原子的次外层时,其最多容纳的电子数比(n-1)层最多容纳的电子数多10个。则n层是K层~N层中的哪一层?(证据推理与模型认知)提示:根据核外电子排布规律可知,当n为最外层时,最多可容纳8个电子,则第(n-1)层最多也可容纳8个电子,故(n-1)层为次外层时,n层应为M层;当n层为次外层时,其最多可容纳的电子数比(n-1)层多10个,则证明n层最多可容纳18个电子,也应为M层。 【迁移·应用】1.下列关于原子核外电子排布规律的说法错误的是( )A.K层是能量最低的电子层B.原子失电子时先失去能量低的电子C.核外电子总是优先排布在能量较低的电子层上D.N层为次外层时,最多可容纳的电子数为18【解析】选B。距原子核由近到远,电子的能量由低到高,即离原子核近的电子能量低,离原子核远的电子能量高,则K层是能量最低的电子层,A正确;原子最先失去最外层电子,最外层电子的能量最高,所以原子失电子时先失去能量高的电子,B错误;核外电子总是优先排布在能量较低的电子层上,C正确;电子层的次外层最多容纳18个电子,所以N层为次外层时,最多可容纳的电子数为18,D正确。2.(2019·邯郸高一检测)核电荷数为16的元素和核电荷数为4的元素的原子相比较,前者下列数据是后者4倍的是( )①电子数②最外层电子数③电子层数④次外层电子数A.①④B.①③④C.①②④D.①②③④【解析】选A。核电荷数为16的元素和核电荷数为4的元素的原子的电子数分别是16和4,最外层电子数分别是6和2,电子层数分别是3和2,次外层电子数分别为8和2,A项正确。知识点二 原子结构与元素性质的关系【重点释疑】1.原子结构与元素性质、元素化合价的关系原子类别与元素性质的关系与元素化合价的关系稀有气体最外层电子数为8(He为2),结构稳定,性质不活泼原子结构为稳定结构,常见化合价为零金属元素原子最外层电子数一般小于4,较易失去电子易失去最外层电子,达到稳定结构,其最高正价为+m(m为最外层电子数)原子类别与元素性质的关系与元素化合价的关系非金属元素原子最外层电子数一般大于或等于4,较易获得电子,形成8电子稳定结构得到一定数目的电子,达到稳定结构,其最低负价为m-8(H为m-2)2.元素原子失电子能力的判断依据可以根据元素单质与水或酸反应放出氢气的剧烈程度来判断元素失电子能力的强弱,一般与水或酸反应越剧烈,失电子能力越强。 【易错提醒】关于原子结构与元素性质的主要易错点(1)最外层电子数小于4的不一定为金属元素,如H、He等;最外层电子数大于4的不一定为非金属元素,如Po等。(2)氟没有正价;氧没有最高正价,只有在OF2中表现正价。(3)活泼金属易形成阳离子,活泼非金属易形成阴离子,但是碳难以形成C4-、C4+;硅难以形成Si4+和Si4-;硼难以形成B3+;氢元素可以形成H+和H-。(4)金属元素只有正化合价不能说明金属元素不能形成阴离子,如[Al(OH)4]-等,但在这些离子中,金属元素仍为正价。 【思考·讨论】 (1)尝试画出钙原子的结构示意图,分析为什么钙在化学反应中表现还原性?提示:钙原子的结构示意图为,其最外层有2个电子,容易失去电子形成Ca2+,表现出还原性。(2)尝试画出氧原子的结构示意图,分析氧元素的常见化合价。提示:氧原子的结构示意图为,氧容易获得2个电子形成O2-,因此氧元素的常见化合价为-2价。【案例示范】【典例】(2019·天水高一检测)已知X、Y是原子核电荷数不大于18的元素。X原子的最外层电子数为a,次外层电子数为a+2;Y原子的最外层电子数为b-5,次外层为b。判断X、Y两元素形成的化合物的组成是( ) A.XY2B.Y4XC.Y2X3D.XY5【思维建模】解答本题的思路为【解析】选C。由于X原子的次外层电子数为a+2,故不可能为K层,由于其核电荷数不大于18,故其次外层应为L层,所以a+2=8,a=6。由于Y原子的最外层电子数为b-5>0,即b>5,其次外层电子数为b>5,故其次外层只能为L层,即b=8。所以X和Y的核外电子排布分别为,即X和Y分别为S和Al,化合价分别为-2价和+3价,因此易形成化合物Al2S3。【母题追问】(1)判断X元素的最高正价和最低负价。提示:+6价、—2价。由于X元素为硫元素,最外层有6个电子,因此其最高正价为+6价,最低负价为6-8=-2。(2)若将题干中的“a+2”改为“a-2”,其他条件不变,写出X、Y两元素形成的化合物的化学式。提示:Al4C3。由于最外层电子数不大于8,X原子的次外层电子数为a-2,故次外层只可能为K层,故a-2=2,a=4。所以X为碳元素。 【迁移·应用】1.(2019·苏州高一检测)核电荷数为1~20的元素中,下列叙述正确的是( )A.原子最外层只有1个或2个电子的元素一定是金属元素B.核外电子排布完全相同的两种微粒化学性质一定相同C.原子核外各层电子数相等的元素不一定是金属元素D.核电荷数为17的元素容易获得1个电子【解析】选D。在核电荷数为1~18的元素中,最外层只有1个电子的元素有H、Li、Na、K,其中H为非金属元素,最外层只有2个电子的元素有He、Be、Mg、Ca,其中He为稀有气体元素,A项错误;核外电子排布完全相同的微粒S2-和K+化学性质不相同,S2-具有还原性,K+不具有还原性,B项错误;原子核外各层电子数相等的只有Be,它是金属元素,C项错误;核电荷数为17的元素的原子结构示意图为,其最外层有7个电子,很容易获得1个电子而成为8个电子的稳定结构,D项正确。2.(2019·三明高一检测)X、Y、Z为短周期元素,这些元素原子的最外层电子数分别为1、4、6,则由这三种元素组成的化合物的化学式可能是( )A.XYZB.X3YZC.XYZ2D.X2YZ3【解析】选D。元素组成的化合物分子中正负化合价的代数和为0。X最外层电子数为1,则其在化合物中的化合价为+1价;Y最外层电子数为4,则其在化合物中的化合价为+4价或-4价;Z元素原子的最外层电子数为6,则其在化合物中的化合价为-2价;所以根据化合物中的正负化合价的代数和为0的原则可知这三种元素组成的化学式可能是X2YZ3,如H2CO3、Na2SiO3等。【补偿训练】1.下列元素的最高正价为+5价的是( ) A.NaB.AlC.PD.Cl【解析】选C。P原子结构示意图为,根据元素最高化合价=元素原子的最外层电子数可知,选C。2.(2019·聊城高一检测)在地壳中含量位于第二位的非金属元素的最高化合价是( )A.+3B.+4C.+5D.+6【解析】选B。地壳中含量位于第二位的非金属元素为Si,其原子结构示意图为,据最高化合价=最外层电子数可知为+4价。【素养提升】稀有气体越来越广泛地应用在工业、医学、尖端科学技术以及日常生活里。如稀有气体通电时会发光,五光十色的各种霓虹灯就是灯管里充入了不同含量的氖、氩、氦等稀有气体的结果。请从原子结构与元素性质角度解释,为什么人们过去将稀有气体称为惰性气体?(宏观辨识与微观探析)提示:元素的原子最外层达8个电子(1个电子层时为2个电子)时,结构稳定,不易得到电子或失去电子。稀有气体元素原子的最外层电子数为8(He为2),已达稳定结构,不容易得、失电子,所以不易发生化学反应,被人们称为惰性气体。知识点三 常见的电子数相同的微粒【重点释疑】1.10电子微粒2.18电子微粒3.记忆其他等电子微粒(1)“14电子”微粒:Si、N2、CO、。(2)“16电子”微粒:S、O2。22C22C【方法规律】推断“10电子”微粒和“18电子”微粒的方法(1)首先确定10电子和18电子的中性原子Ne和Ar,然后找出比它们少或多电子的原子转化成阴、阳离子或氢化物分子。(2)将微粒加、减H+后,核外电子总数不变,由氢化物分子可推出相应的阴离子或阳离子,如NH3和、,H2O和H3O+、OH-,H2S和HS-等。4NH2NH4NH2NH(3)根据CH4、NH3、H2O、HF分子内有10个电子,减去一个H后剩余的原子或原子团“CH3”“NH2”“OH”“F”有9个电子,这四种原子或原子团两两结合得到的分子均为18电子微粒,如自身两两结合得到的分子有CH3CH3(乙烷)、N2H4(肼)、H2O2、F2;不同原子或原子团之间两两结合可得到的分子有CH3OH、CH3NH2(甲胺)等。 【思考·讨论】(1)某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数(如图所示),该微粒若是中性微粒,这种微粒是什么?提示:单核中性微粒为原子,原子的核电荷数=核外电子数,此微粒为核电荷数为18的氩原子。(2)若上述微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒是什么?提示:具有还原性,能被溴水氧化的18e-微粒是S2-。【案例示范】【典例】(2019·惠州高一检测)已知A、B、C、D是中学化学中常见的四种不同微粒。它们之间存在如图中转化关系:(1)如果A、B、C、D均是10电子的微粒,请写出:A的化学式________;D的化学式________。 (2)如果A和C是18电子的微粒,B和D是10电子的微粒,请写出A与B在溶液中反应的离子方程式________。 【解题指南】解答本题注意以下两点:(1)正确理解“微粒”的含义,包括原子、分子、离子等;(2)能够熟练地掌握10电子和18电子微粒。【解析】(1)10电子微粒A、B反应得到两种10电子微粒,应是铵根离子与氢氧根离子反应得到氨气与水,或是HF与OH-反应得到F-与H2O。而B能与氢离子反应生成D,可推知A为或HF,B为OH-,C为NH3或F-,D为H2O。4NH4NH(2)如果A、C均是18电子的微粒,B、D是10电子的微粒,结合转化关系,可推断:A为H2S,B为OH-,C为HS-或S2-,D为H2O;或A为HS-,B为OH-,C为S2-,D为H2O,A与B在溶液中反应的离子方程式:H2S+OH-====HS-+H2O或H2S+2OH-====S2-+2H2O或HS-+OH-====S2-+H2O。答案:(1)或HF H2O(2)H2S+OH-====HS-+H2O或H2S+2OH-====S2-+2H2O或HS-+OH-====S2-+H2O4NH4NH 【迁移·应用】1.(2019·大庆高一检测)下列微粒电子数相同的一组是( ) A.Na+和K+B.CH4和C.和Cl-D.O2-和4NH2NH168O4NH2NH168O【解析】选B。各微粒电子数分别为A中Na+:10,K+:18;B中CH4:10,:10;C中:10,Cl-:18;D中O2-:10,:8。4NH2NH168O4NH2NH168O2.(2019·南宁高一检测)与OH-具有相同质子数和电子数的粒子是( )A.H2OB.F-C.Na+D.NH3【解析】选B。OH-是10电子微粒,其核内有9个质子,所以答案选B。【素养提升】1.水是生命之源,人的体重约50%~70%是水分。组成人体的细胞需要用水来维持,水是构成一切生物体的基本成分。不论是动物还是植物,均以水维持最基本的生命活动。人可数天无食,不可一天无水,所以,水也是人类最必需的营养素之一。已知,水的分子式为H2O,其质子数和电子数均为10个,请书写一个与其电子数相等的微粒生成水的离子方程式。提示:可以是H3O++OH-====2H2O等。2.氨气是一种重要的化工原料,在工业上主要用于制造氨水、氮肥(尿素、碳铵等)、复合肥料、硝酸、铵盐、纯碱等,广泛应用于化工、轻工、化肥、制药、合成纤维等领域。此外,液氨常用作制冷剂,氨还可以作为生物燃料来提供能源,请写出用两种10电子微粒制备氨气的离子方程式。提示:+OH-====NH3↑+H2O。4NH4NH【课堂回眸】 【核心整合】1.体系建构2.知识梳理(1)微粒间的关系质量数(A)=质子数(Z)+中子数(N)(2)元素、核素、同位素三者之间的关系(3)核外电子排布规律①电子总是尽先排布在能量最低的电子层里。②每个电子层最多只能排布2n2个电子。③最外层电子数不超过8个电子(K层为最外层时,电子数不超过2个)。(4)原子结构与元素性质的关系①稀有气体最外层电子达到稳定结构,其化学性质稳定;常见化合价为0价②金属元素原子最外层电子数一般小于4,易失去而形成阳离子,常见化合价为正价。③非金属元素原子最外层电子数一般大于或等于4,易获得电子而形成阴离子,常见化合价为负价。 【素养迁移】1.与铂同族的贵金属钯(Pd)有多种核素。下列关于的说法正确的是( )A.中子数相同,化学性质不同B.质子数相同,互为同位素C.核外电子数不同,是同一种元素D.质量数不同,性质完全相同1031044646PdPd、1031044646PdPd、【解析】选B。质子数相同,核外电子数相同,中子数不同,属于同种元素,互为同位素,化学性质几乎完全相同,物理性质有所不同。1031044646PdPd和1031044646PdPd和2.是重要的核工业原料,在自然界的丰度很低的浓缩一直为国际社会所关注。下列有关的说法中正确的是( )23592U23592U23592U23592U23592U23592UA原子核中含有92个中子B原子核外有143个电子C与互为同位素D与互为同素异形体23592U23592U23592U23592U23892U23892U23592U23592U23592U23592U23892U23892U【解析】选C。含中子数=235-92=143,核外电子数=质子数=92,与互为同位素而不是互为同素异形体。23592U23892U23592U23892U3.YBa2Cu8Ox(Y为钇)是磁悬浮列车中的重要超导材料,关于的说法不正确的是( )8939Y8939YA.元素钇的原子序数为39B.质子数与中子数之差为50C.原子的核外电子数是39D.和是两种不同的核素9039Y8939Y9039Y8939Y【解析】选B。由知,的质子数为39,中子数为89-39=50,由原子序数=质子数=核外电子数,知A项、C项正确;质子数与中子数之差应为11,B项错误。8939Y8939Y8939Y8939Y4.据有关报道称,福岛第一核电站放置在海边的反应堆储水罐的水位从2016年11月左右便开始下降,共计泄漏了约300吨放射性污水,其中可能含有碘的同位素。已知碘原子的结构示意图如下13153I13153I下列有关说法不正确的是( )A.中的中子数为131B.碘元素是一种非金属元素C.原子结构示意图中c=18D.碘元素可以形成KIO4的化合物13153I13153I【解析】选A。中的中子数=质量数-质子数=131-53=78,故A项错误;根据核外电子排布规律可以得出a、b、c、d分别为2、8、18、7,故C项正确,由于最外层电子数为7>4,并根据元素的名称可以判断碘元素为非金属元素,故B项正确;由于碘的最外层电子数为7,因此其最高正化合价为+7价,可以形成KIO4的化合物,故D项正确。13153I13153I5.2019年6月17日,发改委新闻发言人孟玮在新闻发布会上表示,为推动我国稀土产业的高质量发展,国家发改委正抓紧研究出台有关政策措施。我国是全球稀土第一储量大国,也是第一生产大国,加强稀土资源的开发利用,限制稀有金属对外出口,对于我国战略安全具有重要意义。稀土元素钕的一种核素是制造导弹的合金材料的重要元素。14060Nd14060Nd二者是什么关系?原子的中子数与质子数之差为多少?(3)14g钕含有的电子数是6mol,这句话对吗?为什么?14014260601NdNd和140602Nd14014260601NdNd和140602Nd提示:二者质子数相同,中子数不同,互为同位素;(2)原子的中子数与质子数之差=140-60-60=20;14014260601NdNd和14014260601NdNd和(3)元素的相对原子质量等于该元素的各种同位素原子的相对原子质量与其丰度的乘积之和,因此14g钕对应的钕原子的物质的量并非0.1mol,含有的电子也不是6mol。



















