








《《化学中常用的物理量》物质的量在化学反应中的应用PPT课件》是由用户上传到老师板报网,本为文库资料,大小为906.43 KB,总共有38页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 38页
- 906.43 KB
- VIP模板
- pptx
- 数字产品不支持退货
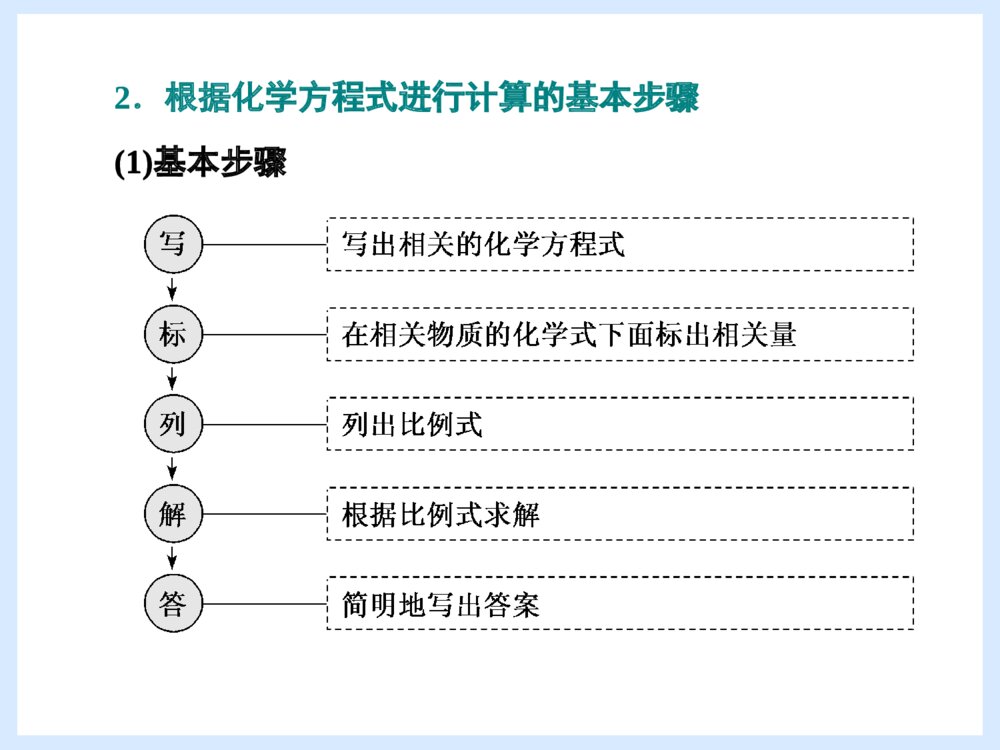
第3节 化学中常用的物理量——物质的量第三课时物质的量在化学反应中的应用[新课程标准是什么]1.掌握物质的量应用于化学方程式的计算方法。2.了解物质的量及其相关物理量的应用,体会定量研究对化学科学的重要作用。[新课程标准是什么]1.掌握物质的量应用于化学方程式的计算方法。2.了解物质的量及其相关物理量的应用,体会定量研究对化学科学的重要作用。新知探究(一) 物质的量在化学方程中的应用[学考层级][自学新教材]阅读教材,回答下列问题:1.化学方程式提供的信息硫在氧气中燃烧的化学方程式为S+O2=====点燃SO2。这个式子不仅表明了反应物是________,生成物是________,反应条件是________,还表示了参与反应的各物质之间的质量关系,即在点燃条件下,每________份质量的S与________份质量的O2恰好反应生成________份质量的SO2。提示:S和O2SO2点燃323264[自学新教材]阅读教材,回答下列问题:1.化学方程式提供的信息硫在氧气中燃烧的化学方程式为S+O2=====点燃SO2。这个式子不仅表明了反应物是________,生成物是________,反应条件是________,还表示了参与反应的各物质之间的质量关系,即在点燃条件下,每________份质量的S与________份质量的O2恰好反应生成________份质量的SO2。提示:S和O2SO2点燃3232642.化学方程式中化学计量数的含义化学方程式:H2+Cl2=====点燃2HCl。分子数之比为____________________________。化学计量数之比为________________________。扩大NA倍之比为________________________。物质的量之比为__________________________。结论:化学方程式中反应物或生成物化学式前的计量数之比就是它们的________之比。提示:1∶1∶21∶1∶21∶1∶21∶1∶2物质的量2.化学方程式中化学计量数的含义化学方程式:H2+Cl2=====点燃2HCl。分子数之比为____________________________。化学计量数之比为________________________。扩大NA倍之比为________________________。物质的量之比为__________________________。结论:化学方程式中反应物或生成物化学式前的计量数之比就是它们的________之比。提示:1∶1∶21∶1∶21∶1∶21∶1∶2物质的量3.实验室用Zn和稀H2SO4反应制H2,若用32.5gZn与足量的稀H2SO4反应,试求:(1)生成标准状况下的H2的体积。(2)反应消耗的H2SO4的物质的量。提示:方法一:32.5gZn的物质的量为32.5g65g·mol-1=0.5mol。Zn与稀H2SO4反应的化学方程式:Zn+H2SO4===ZnSO4+H2↑1mol1mol1mol0.5moln(H2SO4)n(H2)(1)1mol0.5mol=1molnH2,n(H2)=0.5mol,V(H2)=0.5mol×22.4L·mol-1=11.2L。3.实验室用Zn和稀H2SO4反应制H2,若用32.5gZn与足量的稀H2SO4反应,试求:(1)生成标准状况下的H2的体积。(2)反应消耗的H2SO4的物质的量。提示:方法一:32.5gZn的物质的量为32.5g65g·mol-1=0.5mol。Zn与稀H2SO4反应的化学方程式:Zn+H2SO4===ZnSO4+H2↑1mol1mol1mol0.5moln(H2SO4)n(H2)(1)1mol0.5mol=1molnH2,n(H2)=0.5mol,V(H2)=0.5mol×22.4L·mol-1=11.2L。(2)1mol0.5mol=1molnH2SO4,n(H2SO4)=0.5mol。方法二:Zn与稀H2SO4反应的化学方程式:Zn+H2SO4===ZnSO4+H2↑65g1mol22.4L32.5gn(H2SO4)V(H2)(1)65g32.5g=22.4LVH2,V(H2)=11.2L。(2)65g32.5g=1molnH2SO4,n(H2SO4)=0.5mol。(2)1mol0.5mol=1molnH2SO4,n(H2SO4)=0.5mol。方法二:Zn与稀H2SO4反应的化学方程式:Zn+H2SO4===ZnSO4+H2↑65g1mol22.4L32.5gn(H2SO4)V(H2)(1)65g32.5g=22.4LVH2,V(H2)=11.2L。(2)65g32.5g=1molnH2SO4,n(H2SO4)=0.5mol。[落实新知能]1.化学方程式中化学计量数的含义化学方程式中反应物或生成物化学式前的计量数之比就是它们的物质的量之比,也等于参加反应的气体物质的体积(相同状况)之比。[落实新知能]1.化学方程式中化学计量数的含义化学方程式中反应物或生成物化学式前的计量数之比就是它们的物质的量之比,也等于参加反应的气体物质的体积(相同状况)之比。2.根据化学方程式进行计算的基本步骤(1)基本步骤2.根据化学方程式进行计算的基本步骤(1)基本步骤(2)注意事项①各种符号的书写要规范,大写字母与小写字母的意义各不相同。例如,“M”表示摩尔质量,而“m”表示质量,“N”表示微粒数,而“n”表示物质的量。②设未知数直接用各物理量的符号表示,且要注明物质(或微粒)的符号。例如,设参加反应的NaOH的物质的量为n(NaOH)。③各物理量及单位、物质的名称、公式等尽量用符号表示。例如,已知NaOH溶液的体积和物质的量浓度,求NaOH溶液的质量,就写成:m(NaOH)=c(NaOH)×V[NaOH(aq)]×M(NaOH)。④根据化学方程式进行计算时,如果遇到已知物理量与未知物理量不一致时,可以直接列式计算。只要满足“上下一致,左右相当”即可进行求算。(2)注意事项①各种符号的书写要规范,大写字母与小写字母的意义各不相同。例如,“M”表示摩尔质量,而“m”表示质量,“N”表示微粒数,而“n”表示物质的量。②设未知数直接用各物理量的符号表示,且要注明物质(或微粒)的符号。例如,设参加反应的NaOH的物质的量为n(NaOH)。③各物理量及单位、物质的名称、公式等尽量用符号表示。例如,已知NaOH溶液的体积和物质的量浓度,求NaOH溶液的质量,就写成:m(NaOH)=c(NaOH)×V[NaOH(aq)]×M(NaOH)。④根据化学方程式进行计算时,如果遇到已知物理量与未知物理量不一致时,可以直接列式计算。只要满足“上下一致,左右相当”即可进行求算。[演练新学考]1.物质在发生化学反应时()A.它们的质量一定相等B.它们的物质的量一定相等C.它们的质量之比等于化学方程式中化学计量数之比D.它们的物质的量之比等于化学方程式中化学计量数之比解析:物质在发生化学反应时是按照一定比例进行的,这个比值可以是质量比,也可以是微粒个数比,也可以是物质的量之比,也可以是气体的体积比,而化学方程式中的化学计量数可以表示微粒个数之间的关系,也可以表示物质的量之间的关系,但不表示质量之间的关系。答案:D[演练新学考]1.物质在发生化学反应时()A.它们的质量一定相等B.它们的物质的量一定相等C.它们的质量之比等于化学方程式中化学计量数之比D.它们的物质的量之比等于化学方程式中化学计量数之比解析:物质在发生化学反应时是按照一定比例进行的,这个比值可以是质量比,也可以是微粒个数比,也可以是物质的量之比,也可以是气体的体积比,而化学方程式中的化学计量数可以表示微粒个数之间的关系,也可以表示物质的量之间的关系,但不表示质量之间的关系。答案:D2.把一小块钠放入足量水中,会发生如下反应:2Na+2H2O===2NaOH+H2↑。有关该反应的下列说法正确的是()A.反应中Na与NaOH的质量相等B.反应中H2O和H2的质量相等C.反应中H2O和H2的质量比为2∶1D.反应中Na与NaOH的物质的量之比为1∶1解析:该反应中,Na与NaOH的物质的量之比为1∶1,质量之比为23∶40,所以A项错误、D项正确;H2O与H2的物质的量之比为2∶1,质量之比为18∶1,所以B、C项均错误。答案:D2.把一小块钠放入足量水中,会发生如下反应:2Na+2H2O===2NaOH+H2↑。有关该反应的下列说法正确的是()A.反应中Na与NaOH的质量相等B.反应中H2O和H2的质量相等C.反应中H2O和H2的质量比为2∶1D.反应中Na与NaOH的物质的量之比为1∶1解析:该反应中,Na与NaOH的物质的量之比为1∶1,质量之比为23∶40,所以A项错误、D项正确;H2O与H2的物质的量之比为2∶1,质量之比为18∶1,所以B、C项均错误。答案:D3.在标准状况下,11.2LCH4在足量O2中燃烧,反应后生成的气态物质的体积为()A.11.2LB.5.6LC.22.4LD.16.8L解析:标准状况下,11.2LCH4的物质的量是0.5mol,由化学方程式:CH4+2O2===CO2+2H2O可知,生成的气态物质为CO2,且其物质的量为0.5mol,所以体积为11.2L。答案:A3.在标准状况下,11.2LCH4在足量O2中燃烧,反应后生成的气态物质的体积为()A.11.2LB.5.6LC.22.4LD.16.8L解析:标准状况下,11.2LCH4的物质的量是0.5mol,由化学方程式:CH4+2O2===CO2+2H2O可知,生成的气态物质为CO2,且其物质的量为0.5mol,所以体积为11.2L。答案:A4.CaCO3的摩尔质量为100g·mol-1。将5.0gCaCO3固体完全溶于稀盐酸后,再用蒸馏水稀释成100mL溶液。该溶液中Ca2+的物质的量浓度为()A.5.0mol·L-1B.0.10mol·L-1C.1.0mol·L-1D.0.50mol·L-1解析:n(CaCO3)=5.0g100g·mol-1=0.05mol,碳酸钙和稀盐酸反应的化学方程式为CaCO3+2HCl===CaCl2+H2O+CO2↑,根据钙原子守恒得n(Ca2+)=n(CaCO3)=0.05mol,则c(Ca2+)=0.05mol0.1L=0.5mol·L-1。答案:D4.CaCO3的摩尔质量为100g·mol-1。将5.0gCaCO3固体完全溶于稀盐酸后,再用蒸馏水稀释成100mL溶液。该溶液中Ca2+的物质的量浓度为()A.5.0mol·L-1B.0.10mol·L-1C.1.0mol·L-1D.0.50mol·L-1解析:n(CaCO3)=5.0g100g·mol-1=0.05mol,碳酸钙和稀盐酸反应的化学方程式为CaCO3+2HCl===CaCl2+H2O+CO2↑,根据钙原子守恒得n(Ca2+)=n(CaCO3)=0.05mol,则c(Ca2+)=0.05mol0.1L=0.5mol·L-1。答案:D5.化学实验中残余的氯气可以用氢氧化钠溶液吸收,以防污染空气。若有3.20g氢氧化钠发生了化学反应,试求:(1)生成NaCl的质量为________。(2)生成NaClO的物质的量为________。(3)被吸收的氯气在标准状况下的体积为________。(4)生成水的物质的量为________。解析:方法一:Cl2+2NaOH===NaCl+NaClO+H2O71g80g58.5g74.5g18gm(Cl2)3.20gm(NaCl)m(NaClO)m(H2O)5.化学实验中残余的氯气可以用氢氧化钠溶液吸收,以防污染空气。若有3.20g氢氧化钠发生了化学反应,试求:(1)生成NaCl的质量为________。(2)生成NaClO的物质的量为________。(3)被吸收的氯气在标准状况下的体积为________。(4)生成水的物质的量为________。解析:方法一:Cl2+2NaOH===NaCl+NaClO+H2O71g80g58.5g74.5g18gm(Cl2)3.20gm(NaCl)m(NaClO)m(H2O)(1)80g3.20g=58.5gmNaCl,解得m(NaCl)=2.34g。(2)80g3.20g=74.5gmNaClO,解得m(NaClO)=2.98g,n(NaClO)=mNaClOMNaClO=2.98g74.5g·mol-1=0.040mol。(3)80g3.20g=71gmCl2,解得m(Cl2)=2.84g,n(Cl2)=mCl2MCl2=2.84g71g·mol-1=0.040mol,标准状况下,V(Cl2)=n(Cl2)×22.4L·mol-1=0.896L。(4)80g3.20g=18gmH2O,解得m(H2O)=0.72g,n(H2O)=mH2OMH2O=0.72g18g·mol-1=0.040mol。(1)80g3.20g=58.5gmNaCl,解得m(NaCl)=2.34g。(2)80g3.20g=74.5gmNaClO,解得m(NaClO)=2.98g,n(NaClO)=mNaClOMNaClO=2.98g74.5g·mol-1=0.040mol。(3)80g3.20g=71gmCl2,解得m(Cl2)=2.84g,n(Cl2)=mCl2MCl2=2.84g71g·mol-1=0.040mol,标准状况下,V(Cl2)=n(Cl2)×22.4L·mol-1=0.896L。(4)80g3.20g=18gmH2O,解得m(H2O)=0.72g,n(H2O)=mH2OMH2O=0.72g18g·mol-1=0.040mol。方法二:3.2gNaOH的物质的量为n(NaOH)=mNaOHMNaOH=3.2g40g·mol-1=0.080mol。Cl2+2NaOH===NaCl+NaClO+H2O1mol2mol1mol1mol1moln(Cl2)0.080moln(NaCl)n(NaClO)n(H2O)(1)2mol0.080mol=1molnNaCl,解得n(NaCl)=0.040mol,m(NaCl)=n(NaCl)×M(NaCl)=0.040mol×58.5g·mol-1=2.34g。方法二:3.2gNaOH的物质的量为n(NaOH)=mNaOHMNaOH=3.2g40g·mol-1=0.080mol。Cl2+2NaOH===NaCl+NaClO+H2O1mol2mol1mol1mol1moln(Cl2)0.080moln(NaCl)n(NaClO)n(H2O)(1)2mol0.080mol=1molnNaCl,解得n(NaCl)=0.040mol,m(NaCl)=n(NaCl)×M(NaCl)=0.040mol×58.5g·mol-1=2.34g。(2)2mol0.080mol=1molnNaClO,解得n(NaClO)=0.040mol。(3)1molnCl2=2mol0.080mol,解得n(Cl2)=0.040mol,在标准状况下V(Cl2)=n(Cl2)×22.4L·mol-1=0.040mol×22.4L·mol-1=0.896L。(4)2mol0.080mol=1molnH2O,解得n(H2O)=0.040mol。答案:(1)2.34g(2)0.040mol(3)0.896L(4)0.040mol(2)2mol0.080mol=1molnNaClO,解得n(NaClO)=0.040mol。(3)1molnCl2=2mol0.080mol,解得n(Cl2)=0.040mol,在标准状况下V(Cl2)=n(Cl2)×22.4L·mol-1=0.040mol×22.4L·mol-1=0.896L。(4)2mol0.080mol=1molnH2O,解得n(H2O)=0.040mol。答案:(1)2.34g(2)0.040mol(3)0.896L(4)0.040mol6.已知10g铁铜混合物与100mL一定浓度的盐酸恰好完全反应,得到标准状况下2.24L的H2。请计算:(1)反应生成H2的物质的量为________mol。(2)该盐酸的物质的量浓度为________。(3)该混合物中铁的质量分数为________。解析:n(H2)=VVm=2.24L22.4L·mol-1=0.1molFe+2HCl===FeCl2+H2↑121n(Fe)n(HCl)0.1mol所以n(Fe)=0.1mol,m(Fe)=5.6g,n(HCl)=0.2mol,c(HCl)=0.2mol0.1L=2mol·L-1。混合物中铁的质量分数为5.6g10g×100%=56%。答案:(1)0.1(2)2mol·L-1(3)56%6.已知10g铁铜混合物与100mL一定浓度的盐酸恰好完全反应,得到标准状况下2.24L的H2。请计算:(1)反应生成H2的物质的量为________mol。(2)该盐酸的物质的量浓度为________。(3)该混合物中铁的质量分数为________。解析:n(H2)=VVm=2.24L22.4L·mol-1=0.1molFe+2HCl===FeCl2+H2↑121n(Fe)n(HCl)0.1mol所以n(Fe)=0.1mol,m(Fe)=5.6g,n(HCl)=0.2mol,c(HCl)=0.2mol0.1L=2mol·L-1。混合物中铁的质量分数为5.6g10g×100%=56%。答案:(1)0.1(2)2mol·L-1(3)56%反应物中有一种过量的计算[难度增一点][典例1]将28g铁粉放入100mL0.1mol·L-1的CuSO4溶液中,充分反应后析出的铜的质量为()A.32gB.6.4gC.0.64gD.3.2g反应物中有一种过量的计算[难度增一点][典例1]将28g铁粉放入100mL0.1mol·L-1的CuSO4溶液中,充分反应后析出的铜的质量为()A.32gB.6.4gC.0.64gD.3.2g[解析]溶液中n(CuSO4)=0.1L×0.1mol·L-1=0.01mol。设28g铁粉完全反应需要CuSO4的物质的量为n(CuSO4),则Fe+CuSO4===FeSO4+Cu56g1mol28gn(CuSO4)解得n(CuSO4)=0.5mol>0.01mol,所以CuSO4不足,根据CuSO4的量计算。Fe+CuSO4===FeSO4+Cu1mol64g0.01molm(Cu)解得m(Cu)=0.64g。[答案]C[解析]溶液中n(CuSO4)=0.1L×0.1mol·L-1=0.01mol。设28g铁粉完全反应需要CuSO4的物质的量为n(CuSO4),则Fe+CuSO4===FeSO4+Cu56g1mol28gn(CuSO4)解得n(CuSO4)=0.5mol>0.01mol,所以CuSO4不足,根据CuSO4的量计算。Fe+CuSO4===FeSO4+Cu1mol64g0.01molm(Cu)解得m(Cu)=0.64g。[答案]C[知能深一点]反应物中有一种过量的计算在化学反应中,反应物之间是按化学方程式所确定的量(包括质量、物质的量等)进行反应的。如果某反应中两种反应物的量都已给出,则应先判断两种反应物是否恰好完全反应,然后选择不足量的那种反应物的量作为计算标准进行计算。判断方法:假设一种反应物A完全反应,计算需要另外一种反应物B的量,并与已知B的量进行比较,若B(已知)>B(需要),则B过量,根据A的量计算。若B(已知)=B(需要),则二者恰好反应,根据A或B的量计算均可。若B(已知)<B(需要),则B不足,根据B的量计算。[知能深一点]反应物中有一种过量的计算在化学反应中,反应物之间是按化学方程式所确定的量(包括质量、物质的量等)进行反应的。如果某反应中两种反应物的量都已给出,则应先判断两种反应物是否恰好完全反应,然后选择不足量的那种反应物的量作为计算标准进行计算。判断方法:假设一种反应物A完全反应,计算需要另外一种反应物B的量,并与已知B的量进行比较,若B(已知)>B(需要),则B过量,根据A的量计算。若B(已知)=B(需要),则二者恰好反应,根据A或B的量计算均可。若B(已知)<B(需要),则B不足,根据B的量计算。[选考难一点]1.已知Na与S在常温下可化合生成Na2S,现将4.6gNa与1.6g硫粉迅速混合,并放在石棉网上加热,反应后生成的固体是()A.Na和Na2SB.S和Na2SC.Na2S和Na2O2D.Na2S和Na2O解析:n(Na)=4.6g23g·mol-1=0.2mol,n(S)=1.6g32g·mol-1=0.05mol,n(Na)∶n(S)>2∶1,所以Na过量。但在加热条件下,过量的Na会继续与空气中的O2反应生成Na2O2,所以反应后生成的固体物质是Na2S和Na2O2。答案:C[选考难一点]1.已知Na与S在常温下可化合生成Na2S,现将4.6gNa与1.6g硫粉迅速混合,并放在石棉网上加热,反应后生成的固体是()A.Na和Na2SB.S和Na2SC.Na2S和Na2O2D.Na2S和Na2O解析:n(Na)=4.6g23g·mol-1=0.2mol,n(S)=1.6g32g·mol-1=0.05mol,n(Na)∶n(S)>2∶1,所以Na过量。但在加热条件下,过量的Na会继续与空气中的O2反应生成Na2O2,所以反应后生成的固体物质是Na2S和Na2O2。答案:C2.将6.5gZn加入500mL1.00mol·L-1HCl溶液中,计算:(1)生成H2的体积为________(标准状况)。(2)若反应完毕后溶液体积仍为500mL,溶液中ZnCl2的物质的量浓度为________。解析:n(Zn)=0.1mol,n(HCl)=0.5mol。由化学方程式可知0.1molZn可消耗0.2molHCl,而提供的HCl为0.5mol,所以HCl过量,则应按Zn的量来计算:Zn+2HCl===ZnCl2+H2↑1mol1mol22.4L0.1moln(ZnCl2)V(H2)列式计算得:n(ZnCl2)=0.1mol,V(H2)=2.24L,c(ZnCl2)=0.2mol·L-1。答案:(1)2.24L(2)0.2mol·L-12.将6.5gZn加入500mL1.00mol·L-1HCl溶液中,计算:(1)生成H2的体积为________(标准状况)。(2)若反应完毕后溶液体积仍为500mL,溶液中ZnCl2的物质的量浓度为________。解析:n(Zn)=0.1mol,n(HCl)=0.5mol。由化学方程式可知0.1molZn可消耗0.2molHCl,而提供的HCl为0.5mol,所以HCl过量,则应按Zn的量来计算:Zn+2HCl===ZnCl2+H2↑1mol1mol22.4L0.1moln(ZnCl2)V(H2)列式计算得:n(ZnCl2)=0.1mol,V(H2)=2.24L,c(ZnCl2)=0.2mol·L-1。答案:(1)2.24L(2)0.2mol·L-1化学计算中的常用方法[难度增一点][典例2]将质量为56g的铁棒插入500mL0.5mol·L-1的CuSO4溶液中,充分反应后铁棒的质量为()A.57gB.58gC.59gD.60g化学计算中的常用方法[难度增一点][典例2]将质量为56g的铁棒插入500mL0.5mol·L-1的CuSO4溶液中,充分反应后铁棒的质量为()A.57gB.58gC.59gD.60g[解析]n(CuSO4)=0.25mol,n(Fe)=1mol,由反应的化学方程式可知,铁棒过量,根据CuSO4的量计算:Fe+CuSO4===FeSO4+Cu质量差56g1mol1mol64g-56g=8g0.25mol0.25molm解得m=2g,所以充分反应后铁棒的质量为56g+2g=58g。[答案]B[解析]n(CuSO4)=0.25mol,n(Fe)=1mol,由反应的化学方程式可知,铁棒过量,根据CuSO4的量计算:Fe+CuSO4===FeSO4+Cu质量差56g1mol1mol64g-56g=8g0.25mol0.25molm解得m=2g,所以充分反应后铁棒的质量为56g+2g=58g。[答案]B[典例3]将一定量的铁粉加入100mL稀硫酸中,为中和过量硫酸,且使Fe2+完全转化为Fe(OH)2,共消耗掉2mol·L-1NaOH溶液150mL。原硫酸溶液的浓度是()A.0.5mol·L-1B.1mol·L-1C.1.5mol·L-1D.2mol·L-1[典例3]将一定量的铁粉加入100mL稀硫酸中,为中和过量硫酸,且使Fe2+完全转化为Fe(OH)2,共消耗掉2mol·L-1NaOH溶液150mL。原硫酸溶液的浓度是()A.0.5mol·L-1B.1mol·L-1C.1.5mol·L-1D.2mol·L-1[解析]将一定量的铁粉加入100mL稀硫酸中,用NaOH溶液中和过量的硫酸并使Fe2+完全转化为Fe(OH)2,反应的化学方程式分别为Fe+H2SO4===FeSO4+H2↑、FeSO4+2NaOH===Fe(OH)2↓+Na2SO4、H2SO4+2NaOH===Na2SO4+2H2O,由反应方程式可知,反应后得到的是Na2SO4溶液,则n(Na2SO4)=12n(NaOH)=n(H2SO4)=12×2mol·L-1×0.15L=0.15mol,所以原硫酸溶液的浓度为c(H2SO4)=0.15mol0.1L=1.5mol·L-1。[答案]C[解析]将一定量的铁粉加入100mL稀硫酸中,用NaOH溶液中和过量的硫酸并使Fe2+完全转化为Fe(OH)2,反应的化学方程式分别为Fe+H2SO4===FeSO4+H2↑、FeSO4+2NaOH===Fe(OH)2↓+Na2SO4、H2SO4+2NaOH===Na2SO4+2H2O,由反应方程式可知,反应后得到的是Na2SO4溶液,则n(Na2SO4)=12n(NaOH)=n(H2SO4)=12×2mol·L-1×0.15L=0.15mol,所以原硫酸溶液的浓度为c(H2SO4)=0.15mol0.1L=1.5mol·L-1。[答案]C[知能深一点]化学计算中的2种常用方法1.差量法在化学反应前后,物质的质量差(或体积差)和该反应的反应物或生成物的量(质量或体积或物质的量)成正比例关系。将“差量”看作化学方程式右端的一项,将实际差量与化学方程式中的对应理论差量列成比例式计算求解。差量法计算的两种常见类型:[知能深一点]化学计算中的2种常用方法1.差量法在化学反应前后,物质的质量差(或体积差)和该反应的反应物或生成物的量(质量或体积或物质的量)成正比例关系。将“差量”看作化学方程式右端的一项,将实际差量与化学方程式中的对应理论差量列成比例式计算求解。差量法计算的两种常见类型:(1)质量差量法Fe+CuSO4===FeSO4+Cu质量差56g64g64g-56g=8gm(Fe)m(Cu)m(Cu)-m(Fe)(2)体积差量法2CO+O2=====点燃2CO2体积差2L1L2L3L-2L=1LV(CO)V(O2)V(CO2)V(CO)+V(O2)-V(CO2)(1)质量差量法Fe+CuSO4===FeSO4+Cu质量差56g64g64g-56g=8gm(Fe)m(Cu)m(Cu)-m(Fe)(2)体积差量法2CO+O2=====点燃2CO2体积差2L1L2L3L-2L=1LV(CO)V(O2)V(CO2)V(CO)+V(O2)-V(CO2)2.关系式法(守恒法)当已知物和未知物之间靠多个反应联系时,只需利用化学方程式或原子守恒直接确定已知量和未知量之间的比例关系(即关系式),然后根据关系式计算即可。例如,把一定量的CO还原Fe2O3生成的CO2通入澄清的石灰水中,求生成沉淀的质量时,可先根据发生的化学方程式:3CO+Fe2O3=====△2Fe+3CO2,CO2+Ca(OH)2===CaCO3+H2O,找到关系式3CO~3CO2~3CaCO3,即CO~CaCO3,也可根据C的守恒直接得到CO~CaCO3。2.关系式法(守恒法)当已知物和未知物之间靠多个反应联系时,只需利用化学方程式或原子守恒直接确定已知量和未知量之间的比例关系(即关系式),然后根据关系式计算即可。例如,把一定量的CO还原Fe2O3生成的CO2通入澄清的石灰水中,求生成沉淀的质量时,可先根据发生的化学方程式:3CO+Fe2O3=====△2Fe+3CO2,CO2+Ca(OH)2===CaCO3+H2O,找到关系式3CO~3CO2~3CaCO3,即CO~CaCO3,也可根据C的守恒直接得到CO~CaCO3。[选考难一点]3.将5.6LCO2气体缓缓通过一定量的Na2O2固体后,得到3.36L气体(气体均是在标准状况下测得),则所得气体的成分为()A.CO2B.O2C.1.68LCO2和1.68LO2D.1.12LCO2和2.24LO2解析:2Na2O2+2CO2===2Na2CO3+O2体积差2L1L2L-1L=1LV(CO2)V(O2)5.6L-3.36L=2.24L解得反应的V(CO2)=4.48L,生成的V(O2)=2.24L,剩余V(CO2)=5.6L-4.48L=1.12L。答案:D[选考难一点]3.将5.6LCO2气体缓缓通过一定量的Na2O2固体后,得到3.36L气体(气体均是在标准状况下测得),则所得气体的成分为()A.CO2B.O2C.1.68LCO2和1.68LO2D.1.12LCO2和2.24LO2解析:2Na2O2+2CO2===2Na2CO3+O2体积差2L1L2L-1L=1LV(CO2)V(O2)5.6L-3.36L=2.24L解得反应的V(CO2)=4.48L,生成的V(O2)=2.24L,剩余V(CO2)=5.6L-4.48L=1.12L。答案:D4.将26.4gNa2O与Na2O2的混合物投入足量的水中溶解,反应后水溶液增重24.8g,则原混合物Na2O与Na2O2的物质的量之比是()A.1∶3B.3∶1C.13∶31D.31∶134.将26.4gNa2O与Na2O2的混合物投入足量的水中溶解,反应后水溶液增重24.8g,则原混合物Na2O与Na2O2的物质的量之比是()A.1∶3B.3∶1C.13∶31D.31∶13解析:Na2O2与Na2O的混合物投入足量的水中溶解发生的反应为①Na2O+H2O===2NaOH、②2Na2O2+2H2O===4NaOH+O2↑,26.4gNa2O2与Na2O的混合物投入足量的水中溶解,称得水溶液增重24.8g,减少的1.6g为生成O2的质量,物质的量为0.05mol,根据反应②知,混合物中Na2O2的物质的量为0.1mol,质量为7.8g;混合物中Na2O的质量为26.4g-7.8g=18.6g,物质的量为0.3mol,则原混合物中Na2O与Na2O2的物质的量之比是3∶1。答案:B解析:Na2O2与Na2O的混合物投入足量的水中溶解发生的反应为①Na2O+H2O===2NaOH、②2Na2O2+2H2O===4NaOH+O2↑,26.4gNa2O2与Na2O的混合物投入足量的水中溶解,称得水溶液增重24.8g,减少的1.6g为生成O2的质量,物质的量为0.05mol,根据反应②知,混合物中Na2O2的物质的量为0.1mol,质量为7.8g;混合物中Na2O的质量为26.4g-7.8g=18.6g,物质的量为0.3mol,则原混合物中Na2O与Na2O2的物质的量之比是3∶1。答案:B5.加热分解7.9g固体甲,产生560mL(标准状况)气体乙,剩余7.1g固体丙,则乙的摩尔质量为_______________。解析:乙的物质的量n=0.56L22.4L·mol-1=0.025mol,固体减少的质量即是气体乙的质量m=7.9g-7.1g=0.8g,则乙的摩尔质量M=mn=0.8g0.025mol=32g·mol-1。答案:32g·mol-15.加热分解7.9g固体甲,产生560mL(标准状况)气体乙,剩余7.1g固体丙,则乙的摩尔质量为_______________。解析:乙的物质的量n=0.56L22.4L·mol-1=0.025mol,固体减少的质量即是气体乙的质量m=7.9g-7.1g=0.8g,则乙的摩尔质量M=mn=0.8g0.025mol=32g·mol-1。答案:32g·mol-16.有一在空气中放置了一段时间的KOH固体,经分析测定知其含水2.8%,含K2CO337.3%,取1g该样品投入25mL2mol·L-1的盐酸中后,多余的盐酸用1.0mol·L-1KOH溶液30.8mL恰好完全中和,蒸发中和后的溶液可得到固体_______g。解析:KOH+HCl===KCl+H2O①K2CO3+2HCl===2KCl+H2O+CO2↑②蒸发溶液后得到的固体为KCl,设质量为m,KCl~HCl74.5g1molm0.025L×2mol·L-174.5gm=1mol0.025L×2mol·L-1,m≈3.7g。答案:3.76.有一在空气中放置了一段时间的KOH固体,经分析测定知其含水2.8%,含K2CO337.3%,取1g该样品投入25mL2mol·L-1的盐酸中后,多余的盐酸用1.0mol·L-1KOH溶液30.8mL恰好完全中和,蒸发中和后的溶液可得到固体_______g。解析:KOH+HCl===KCl+H2O①K2CO3+2HCl===2KCl+H2O+CO2↑②蒸发溶液后得到的固体为KCl,设质量为m,KCl~HCl74.5g1molm0.025L×2mol·L-174.5gm=1mol0.025L×2mol·L-1,m≈3.7g。答案:3.7谢观看THANKYOUFORWATCHING谢



















