







《第二章·晶体化学基础PPT课件(共46页)》是由用户上传到老师板报网,本为文库资料,大小为2.44 MB,总共有46页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 46页
- 2.44 MB
- VIP模板
- ppt
- 数字产品不支持退货
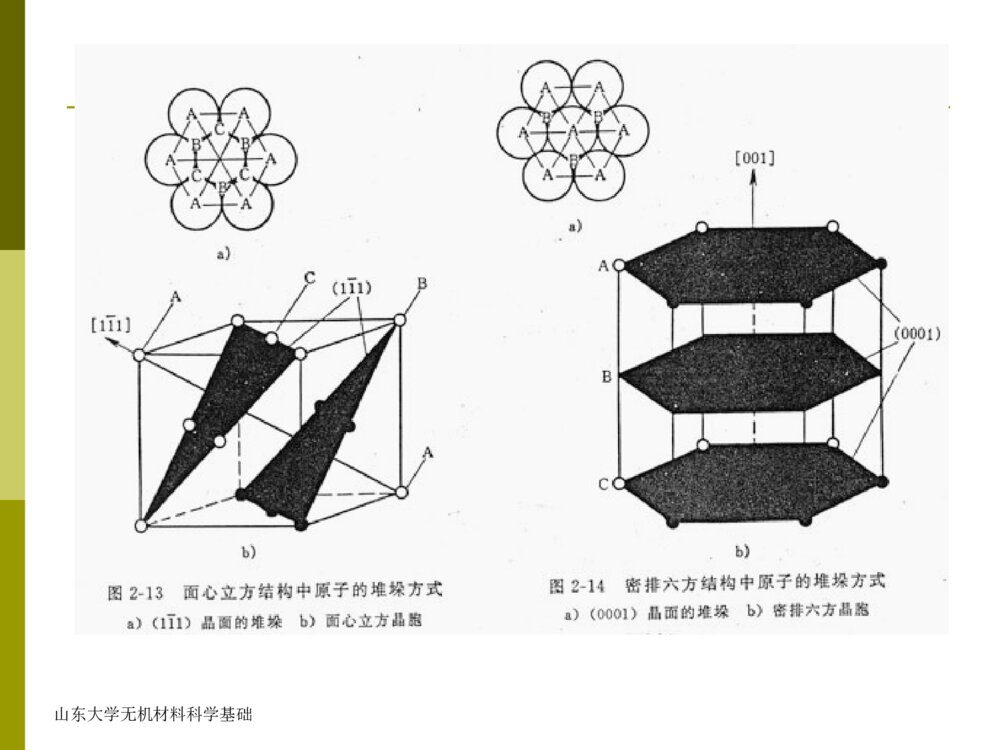
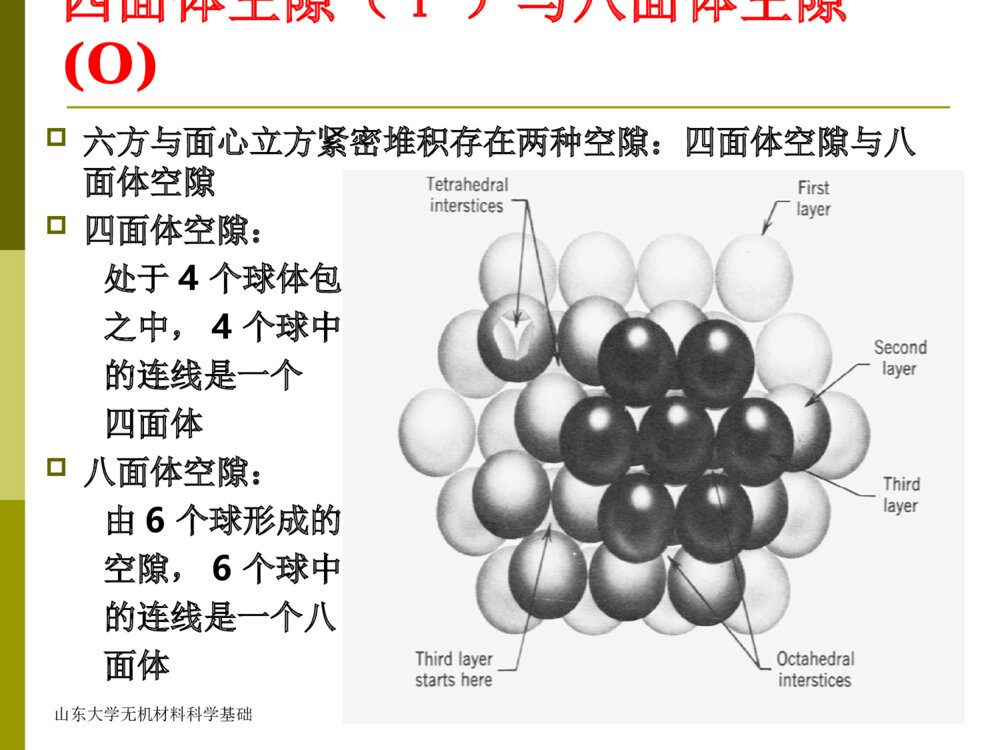
山东大学无机材料科学基础第二章晶体化学基础第一节晶体结构的键合一、离子键二、共价键三、范德瓦尔斯键四、氢键五、金属键六、极性共价键七、半金属共价键山东大学无机材料科学基础第二节球体的紧密堆积原理在晶体结构中,晶格上的原子或离子都有一定的有效半径,且可看成是具有一定大小的球体。由于离子键无方向性和饱和性,形式上可以视为球体间的相互堆积。当正、负离子之间引力与斥力达到平衡,正负离子处在平衡距离,体系处于最低能量状态,即稳定状态。这相当于离子互相靠近而占有最小的空间,作最紧密堆积,形成最稳定的结构。山东大学无机材料科学基础晶体堆积的球有两种:一是单质(原子)作等大球体最紧密堆积,如纯金属晶体;另一是离子作不等大球体的紧密堆积。等大球体最紧密堆积的六方(HCP)与面心立方(FCC)紧密堆积是晶体结构中最常见的方式山东大学无机材料科学基础一、等径球体的紧密堆积1、第一层球(A)球体点接触,两种空隙相间分布2、第二层球(B)放在第一层球的空隙位置上,形成两种空隙:穿透空隙未穿透空隙3、第三层球有两种方法:放在未穿透空隙上(ABABAB)放在穿透空隙上(ABCABC)山东大学无机材料科学基础放在未穿透空隙上山东大学无机材料科学基础六方密堆积该形式形成ABABAB…堆积方式,将球心连接起来形成六方格子,故称六方紧密堆积。金属的密排六方结构属于这种紧密堆积方式。如Mg,ZnHCP山东大学无机材料科学基础放在穿透空隙上该形式以ABCABCABC…方式堆积,将球心连接起来形成面心立方格子,故称面心立方紧密堆积。金属的面心立方结构属于这种紧密堆积方式,如Cu与Au。立方密堆积山东大学无机材料科学基础立方密堆积山东大学无机材料科学基础山东大学无机材料科学基础四面体空隙(T)与八面体空隙(O)六方与面心立方紧密堆积存在两种空隙:四面体空隙与八面体空隙四面体空隙:处于4个球体包围之中,4个球中心的连线是一个四面体八面体空隙:由6个球形成的空隙,6个球中心的连线是一个八面体山东大学无机材料科学基础四面体空隙(T)与八面体空隙(O)山东大学无机材料科学基础六方紧密堆积的空隙位置和数量每个球可与周围的球形成8个四面体空隙,6个八面体空隙n个等径球作六方紧密堆积,必定有n个八面体空隙和2n个四面体空隙山东大学无机材料科学基础面心立方格子八面体空隙(O)四面体空隙(T)山东大学无机材料科学基础山东大学无机材料科学基础六方与面心立方紧密堆积的空间占有率最高,达到74.05%(孔隙率25.95%),配位数12。山东大学无机材料科学基础除六方与面心立方紧密堆积外,尚有其它形式的堆积方式,如体心立方堆积、简单立方堆积等。山东大学无机材料科学基础体心立方次密堆积:该堆积形式不是最紧密堆积,空间利用率仅68%。配位数为8,如碱金属、Mo、Cr、α-Fe等具有此种结构。简单立方次密堆积山东大学无机材料科学基础二、不等径球体的紧密堆积在不等大球体的紧密堆积时,可以看成由较大的球体作等大球体的紧密堆积方式,而较小的球则按其本身大小充填在八面体或四面体空隙之中。在离子晶体中,一般,负离子半径较大,所以,负离子作最紧密堆积,正离子则充填在负离子密堆积的空隙中山东大学无机材料科学基础第三节、影响离子晶体结构的因素一、原子半径和离子半径二、配位数和配位多面体三、离子的极化四、电负性五、结晶化学定律山东大学无机材料科学基础第三节、影响离子晶体结构的因素一、原子半径和离子半径-晶体化学中最基本的参数之一。晶体结构中,采用原子或离子的有效半径,即在晶体结构中原子或离子处于相接触时的半径。在此情况下,原子或离子间的静电引力与斥力达到平衡。离子晶体:正、负离子相接触的中心距,即为正负离子的半径之和共价晶体:两个相邻键合的中心距,即是两个原子的共价半径之和纯金属晶体:两个相邻原子中心距的一半,就是金属的原子半径山东大学无机材料科学基础1920年,兰德设法从LiI晶体求得I-的半径(0.213nm)和卤离子半径。Bragg和Goldschmidt用类似方法求得80多个离子半径。Pauling提出了另一套求离子半径的方法:r=Cn/Z’,Z’为有效电荷;Z’=Z–S;S称屏蔽常数,称为Pauling离子半径。现常用是由香农(Shannon)等提供的一套关于离子晶体半径的数据,他们用了千余种金属氧化物和氟化物的正、负离子间距的实验数据,并采用比较合理的rF-=0.133nm和rO2-=0.140nm的值,还考虑了配位数对离子半径的影响。山东大学无机材料科学基础例:Ba2+O2-CN=40.138nmCN=60.135nm0.140nmCN=80.142nm0.142nmCN=120.161nm山东大学无机材料科学基础二、配位数和配位多面体1、配位数(CN):在晶体结构中,该原子或离子的周围与它直接相邻的原子个数或所有异号离子的个数。2、配位多面体:在晶体结构中,离子的周围与它直接相邻结合的原子或离子的中心连线所构成的多面体称为原子或离子的配位多面体。3.阳离子位于配位多面体的中心,阴离子位于多面体的角顶上。山东大学无机材料科学基础原子晶体(金属晶体)中,原子作等大球体紧密堆积,不论是六方还是面心立方紧密堆积,CN=12;体心立方堆积,CN=8共价晶体:因键的方向性和饱和性,配位数不受球体紧密堆积规则限制,配位数较低,一般不大可能超过4离子晶体:正离子填入负离子作紧密堆积所形成的空隙中,不同的空隙将有不同的配位数。山东大学无机材料科学基础一般,离子晶体配位数决定于正离子与负离子半径的比值正负离子半径比(r+/r-)直接影响体系的稳定性,正离子总是在自己半径所允许条件下,要具有尽可能高的配位数,使得正负离子相接触,而负离子之间稍有间隔。山东大学无机材料科学基础图中直角三角形ABC可以算出:Rk∕Ra=-1=0.414。此值是阳离子作为六次配位的下限值。2配位八面体山东大学无机材料科学基础配位多面体:在晶体结构中,离子的周围与它直接相邻结合的原子或离子的中心连线所构成的多面体称为原子或离子的配位多面体。正离子处在配位多面体的中心,而负离子处在配位多面体的顶角上。习惯上,以正离子为中心讨论负离子的配位多面体。山东大学无机材料科学基础正负离子半径比值与配位数的关系R+/r-值正离子配位数负离子配位多面体形状实例0.000∽0.1552直线型CO20.155∽0.2253平面三角形B2O30.225∽0.4144四面体形SiO20.414∽0.7326八面体形NaCl,TiO20.732∽1.0008立方体形ZrO2,CaF2,CsCl1.000以上12立方八面体形Cu山东大学无机材料科学基础作为配位原则:就是正离子总是力图与尽可能多的负离子相接触,这样晶体才会稳定。在晶体或玻璃体中,某些正离子的配位数往往不止一种。例:Al—O之间的配位数有4和6两种,B—O之间有〔BO3〕和〔BO4〕两种(硼反常)。山东大学无机材料科学基础在晶体化学中,采用配位多面体概念讨论晶体结构其意义为:将复杂的结构简化,抽象成由配位多面体连接起来的结构,可以直观、简明的看出结构的基本特点和相互关系;在配位多面体连接基础上进行对比分类、比较自然。山东大学无机材料科学基础三、离子的极化在外电场的作用下,离子的正、负电荷中心不再重合,产生偶极距,离子的形状和大小将发生改变,这种现象称为离子的极化。在离子晶体中,每个离子都有双重作用,即自身被其他离子极化和极化周围另一个离子。一个离子在其他离子电场作用下发生的极化称为被极化,被极化程度可以用极化率来表示:=/F(F-有效电场;-诱导偶极距)一个离子的电场作用于周围离子,使其发生极化称为主极化,主极化能力用极化力表示:=W/r2(W-离子电价;r-离子半径)山东大学无机材料科学基础阳离子的半径小,电价高,主要表现为主极化;阴离子的半径大,电价底、主要表现为被极化;阳离子最外层为18或18+2电子构型时,(如Cu+,Ag+,Pb2+,Cd2+等)极化率也较大,则需考虑阳离子的被极化。山东大学无机材料科学基础①由于极化,正负离子的间距缩短,甚至导致配位数下降,整个晶体的结构类型发生变化。例:ZnO:R+∕R-=0.63,CN=6(NaCl型)实际CN=4(ZnS型)CaO:R+∕R-=0.80,CN=8(CsCl型)实际CN=6(NaCl型)②由于极化,正负离子的电子云重叠,离子键的性质发生变化,向共价键过渡。例:硅离子r=0.4;氧离子r=1.40计算Si-O半径=1.80;O-O半径=2.80实测:=1.60=2.60离子极化对晶体结构具有重要影响山东大学无机材料科学基础四、电负性电负性是各种元素的原子在形成价键时吸引电子的能力,用来表示其形成负离子倾向的大小。元素的电负性值越大,越易取得电子,即越容易成为负离子。两个元素的电负性差值越大,形成的化学键合的离子键性越强,反之,共价键性就越强。电负性差值越小的两个元素形成化合物时,主要为非极性共价键或半金属共价键。大多数硅酸盐晶体都是介于离子键与共价键之间的混合键。山东大学无机材料科学基础五、结晶化学定律决定离子晶体结构的基本因素Y=F(离子的相对大小;相对含量;极化性能)R+∕R-;AX;α、βA2XA2X3AX2哥希密特结晶化学定律哥希密特结晶化学定律“晶体的结构,取决于其组成单位的数量、大小及极化性质”。山东大学无机材料科学基础第四节同质多晶同一化学组成在不同外界条件下(温度、压力、pH等),结晶成两种或两种以上不同结构的晶体的这一现象称为同质多晶或同质多象。化学组成相同、结构不同的晶体称为变体。从一种变体转变为另一种变体的现象,称为多晶转变。位移性转变-(高低温转变),不破坏原有原子间的化学键以及相邻原子的配位数,晶体结构仅发生畸变的多晶转变形式。所需能量低、转变速度快。重建性转变-原有原子间化学键破坏、原子最邻近配位数改变,使晶体结构完全变化的多晶转变。所需能量高,转变速度慢。山东大学无机材料科学基础根据多晶转变的方向可以分为:可逆转变(双向转变)-在一定温度下,同质多晶变体可以相互转变,位移性转变都属于可逆转变不可逆转变(单向转变)-在指定温度下,一种变体可以转变为另一种变体,而反向转变几乎不可能。少数重建性转变是不可逆转变山东大学无机材料科学基础第五节鲍林规则鲍林根据不同尺寸离子堆积的几何稳定性以及简单的静电稳定性观点总结了离子晶体结构的规律性,提出5条规则1)第一规则(配位体规则):在阳离子周围形成一个阴离子配位多面体,阴阳离子间的距离取决于它们的半径之和,而阳离子的配位数取决于它们的半径之比,与半径无关。山东大学无机材料科学基础山东大学无机材料科学基础rc/ra值正离子配位数负离子配位多面体形状实例0.000∽0.1552直线型CO20.155∽0.2253平面三角形B2O30.225∽0.4144四面体形SiO20.414∽0.7326八面体形NaCl,TiO20.732∽1.0008立方体形ZrO2,CaF2,CsCl1.000以上12立方八面体形Cu正负离子半径比值与配位数的关系山东大学无机材料科学基础2)第二规则(静电价规则)在一个稳定的结构中,从所有相邻接的正离子至一个负离子的静电键的总强度等于负离子的电荷数。即负离子电价被正离子电价所平衡。中心正离子至每一配位负离子的静电键强度(S)=正离子价数(Z)/配位数(n)S=Z/n实际上,静电价规则表明,多面体配位结构必须遵守静电平衡的原理。山东大学无机材料科学基础例:CaF2中,Ca2+的配位数为8,则Ca-F键的静电键强度=2/8=1/4。F-的电荷数为1,因此,氟离子的配位数是4,每一个F-的周围有4个Ca2+离子。利用这一规则可判断:晶体的稳定性推测负离子多面体的连接方式山东大学无机材料科学基础3)第三规则(阴离子配位多面体共顶、共棱和共面规则)在配位结构中,配位多面体共用棱,特别共用面会降低结构的稳定性。对于高电价和低配位的正离子,这种效应特别明显。配位多面体共棱或共面时,与共顶角相比,其中正离子之间距离缩短,斥力增加,稳定性下降。山东大学无机材料科学基础连接方式共用顶点数配位三角体配位四面体配位八面体配位立方体共顶11111共棱20.50.580.710.82共面3或4——0.330.580.58山东大学无机材料科学基础4)第四规则在含有一种以上正离子的晶体中,电价高而配位数低的正离子不倾向于相互共用配位多面体的几何元素(指共顶、共棱和共面)。实际上,该规则是第三规则在多离子晶体结构中的延伸。表明,有多种正离子时,高价、低配位数正离子配位多面体倾向于尽可能互不相连,它们之间由其它正离子的配位多面体隔开。山东大学无机材料科学基础5)第五规则(节约规则)在晶体中,本质上不同的结构单元数目趋向于最少。如对大量硅酸盐结构研究还未发现在某一结构中既有岛状硅氧骨干,又有链状的硅氧骨干。鲍林规则仅适用于离子晶体及带有不明显共价键性的离子晶体,并且还有少数例外情况。



















