







《化学PPT课件《3·1稀溶液的通行》》是由用户上传到老师板报网,本为文库资料,大小为911 KB,总共有66页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 66页
- 911 KB
- VIP模板
- ppt
- 数字产品不支持退货
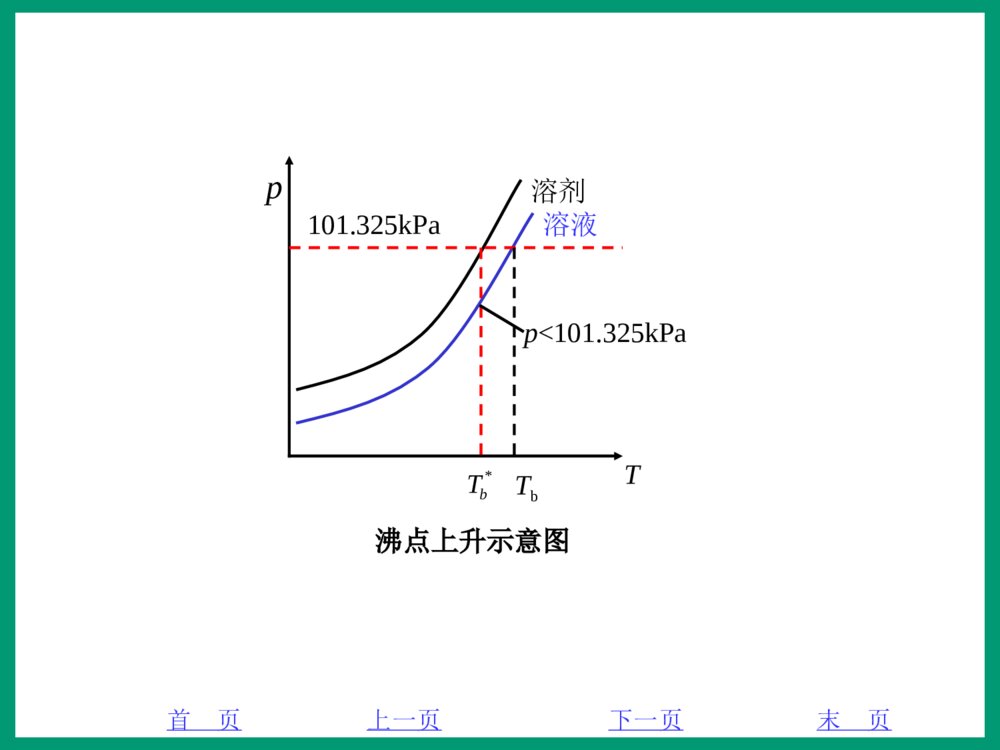
首页末页下一页上一页13.1稀溶液的通性溶液有两大类性质:1)与溶液中溶质的本性有关:溶液的颜色、酸碱性和导电性等;“依数性”是所有溶液都具有的共同性质,因此也称为“溶液的通性”。溶液越稀,依数性表现得越有规律,非电解质稀溶液的这些性质与粒子数目之间存在定量关系。电解质溶液或浓度较大的非电解质溶液也具有依数性,但是由于浓溶液中溶质粒子之间以及溶质和溶剂之间的相互作用大大增强,这些复杂因素使得依数性与溶质粒子数之间的定量关系发生了偏差。2)与溶液中溶质的数量有关:而与溶质的本身性质无关————溶液的依数性,如溶液的蒸气压下降、凝固点下降、沸点升高和渗透压等。首页末页下一页上一页2本节主要讨论难挥发的非电解质稀溶液的依数性。(1)质量百分比浓度溶质质量(溶质m)占溶液质量(溶液m)的百分数即为质量百分比浓度(w),也称为质量分数,其数学表达式为:w=%100溶液溶质mm(3.1)这种表示方法非常简便,常用于生产生活中。例如将5g蔗糖溶于95g水,其质量百分比浓度为w=%1009555=5%首页末页下一页上一页3(2)摩尔分数溶质的物质的量(溶质n)占整个溶液总的物质的量(溶液n)的百分数称为溶质的摩尔分数(溶质x),其数学表达式如下:溶质x=溶液溶质nn(3.2)例如10gNaCl溶于90g水配制成的溶液,NaCl的摩尔分数为:NaClx=OHNaCllNaC2nnn=1-1--1molg18g90mol58.5g10gmol58.5g10g=0.033首页末页下一页上一页4(3)质量摩尔浓度1000g溶剂中所含溶质的物质的量称为质量摩尔浓度,用m表示,单位1kgmol。m=1000溶剂溶质Wn(3.3)式中溶剂W——溶剂的质量,单位:g。例如40.0gNaOH溶于500g水中,其质量摩尔浓度为:m=1000溶剂溶质Wn=11kgg1000g500molg0.40/g0.40=1kgmol2首页末页下一页上一页5(4)物质的量浓度单位体积溶液中所含溶质的物质的量称为物质的量浓度,用c表示,单位1Lmol或3cmmol。如溶质B的物质的量浓度Bc为Bc=溶液VnB(3.4)物质的量浓度简便实用,是最常用的溶液浓度表示方法。首页末页下一页上一页63.1.1溶液蒸气压下降—拉乌尔定律1887年,法国物理学家拉乌尔(F.M.Raoult)根据实验得出如下结论:在一定温度下,难挥发非电解质稀溶液的蒸气压下降(p)与溶质的摩尔分数成正比。这就是著名的拉乌尔定律,其数学表达式为:p=Bxp0A=nnpB0A(3.5)式中,Bn表示溶质B的物质的量,n表示溶液中各物质的量之和,0Ap表示纯溶剂A的蒸气压。应用示例:干燥剂工作原理植物的抗旱性当蒸发和凝聚的速率相等时,液体和它的蒸气处于气液平衡状态,此时蒸气所具有的压力称为此温度下该液体的饱和蒸气压,简称蒸气压。蒸气压与温度有关。首页末页下一页上一页73.1.2溶液沸点上升液体的蒸气压随温度的升高而迅速增大,当蒸气压增大到与外界压力(若无特别说明,外界压力均指标准大气压)相等时,气、液两相达到平衡,液体开始沸腾,此时平衡系统的温度称为液体的沸点,以bT表示。实验表明,溶液的沸点比纯溶剂的沸点高,并且沸点的上升(bT)与溶质的质量摩尔浓度成正比。用数学式表示如下:bT=*bbTT=mKb(3.6)式中,bK为溶剂的摩尔沸点上升常数,m为溶质的质量摩尔浓度。菜汤烫伤与开水烫伤哪个更严重?首页末页下一页上一页8pT溶剂溶液101.325kPaTbp<101.325kPa沸点上升示意图*bT首页末页下一页上一页93.1.3溶液凝固点下降当某物质液态的蒸气压等于其固态的蒸气压时,该物质的液-固两相达到平衡,此时平衡系统的温度即为该物质的凝固点(或熔点),以fT表示。实验表明,溶液的凝固点比纯溶剂的低,并且凝固点的下降(fT)与溶质的质量摩尔浓度成正比。用数学式表示如下:fT=f*fTT=mKf(3.7)式中,fK为溶剂的摩尔凝固点下降常数,m为溶质的质量摩尔浓度。表3.1列出了几种常见溶剂的fK。首页末页下一页上一页10Tf溶液溶剂pT凝固点下降示意图*fT应用示例:冬天路面防冻冷冻剂测量分子量首页末页下一页上一页11例3.11.10g某固体试样溶于20.0g苯中,测得此溶液的凝固点为4.38℃。已知苯的凝固点为5.50℃,fK为5.10,计算试样的分子量。解:根据fT=f*fTT=mKf38.450.5=m10.5m=10.512.1=1kgmol220.0根据m=1000溶剂溶质Wn=1000/溶剂溶质溶质WMW溶质M=溶剂溶质1000mWW=0.20220.010.11000=1molg250因此,试样的分子量为2501molg。首页末页下一页上一页123.1.4渗透压图3.2渗透装置渗透压纯水蔗糖溶液半透膜有一种膜只允许溶剂分子通过,而溶质分子不能通过,这种膜称为半透膜。从宏观上看,当被半透膜隔开的两边溶液的浓度不相等时,溶剂穿过半透膜从纯溶剂向溶液或者从稀溶液向浓溶液扩散,这种现象称为渗透。渗透压是维持被半透膜所隔开的溶液与纯溶剂之间的渗透平衡所需的额外压力。首页末页下一页上一页131986年荷兰物理学家范特霍夫(J.H.VantHoff)根据实验结果发现:难挥发的非电解质稀溶液的渗透压与溶液的物质的量浓度(c)及热力学温度(T)成正比。若以表示渗透压(单位:kPa),c表示物质的量浓度,T表示绝对温度,n表示物质的量,V表示溶液的体积。则有V=nRT=RTVn=cRT(3.8)该方程式称为范特霍夫方程式,其形式与理想气体状态方程式相似,R的数值也相同,但气体的压力和溶液的渗透压产生的原因是不同的。气体的压力是由于气体分子碰撞器壁产生的,而溶液的渗透压是溶剂分子渗透的结果。应用示例:植物对水份的吸收盐碱地不利于植物生长海水淡化首页末页下一页上一页14例3.237℃时,血液的渗透压为775kPa。试计算与血液具有相同渗透压的葡萄糖(6126OHC)静脉注射液的浓度(1Lg)。解:根据=cRT有kPa775=K)37273(KmolmPa314.8113cc=3dmmol37)(273314.8775=0.31Lmol或c=0.311molg180Lmol=541Lg首页末页下一页上一页153.2水溶液中的单相离子平衡3.2.1水的离子积和水溶液的pH值OH2OHH水的解离平衡常数K为:K=)OH()OH()H(2eqeqeqccc对于纯水或稀溶液,水的浓度可看成常数,上式表示为:)OH()H(eqeqcc=)OH(2eqKc=wKwK称为水的离子积常数,与其他平衡常数一样,wK只与温度有关,而与H和OH的浓度无关,无论H和OH的浓度怎样变化,它们的乘积保持不变。在25℃时,wK=141000.1。首页末页下一页上一页16水的离子积常数反映了溶液中H浓度和OH浓度的相互依存关系,如果水溶液中)H(c=)OH(c,那么该水溶液为中性;若)H(c>)OH(c,则溶液呈酸性;反之,显碱性。水溶液的酸碱性统一用)H(c的负对数(pH值)表示,即pH=)H(lgc。当pH<7时,溶液为酸性;pH=7时溶液为中性;pH>7时溶液为碱性。25℃时,pOHpH=14。首页末页下一页上一页173.2.2弱酸弱碱在水溶液中的解离平衡1、酸碱的概念(1)酸碱质子理论酸碱质子理论认为:凡能给出氢质子的物质称为酸;凡能与氢质子结合的物质称为碱。简单地说,酸是质子的给体,碱是质子的受体。酸碱质子理论对酸碱的定义只以质子H的授受为依据。HClClHHAcAcH4NH3NHH3HCO23COH酸碱H首页末页下一页上一页18酸给出质子后余下的部分就是碱,碱接受质子后就成为酸。酸与碱的这种相互依存、相互转化的关系,叫做共轭关系。酸失去质子后形成的碱叫做该酸的共轭碱,碱结合质子后形成的酸叫做该碱的共轭酸。在酸碱质子理论中不存在盐的概念,因为在质子理论中,组成盐的离子已变成了离子酸和离子碱。由于酸碱是共轭的,弱酸与强碱共轭,弱碱与强酸共轭,因此我们已知某酸的强度,就可以知道其共轭碱的强度。酸碱质子理论把酸碱反应扩大到气相、液相、非水溶剂等反应,而且对于酸碱中和、盐的水解、酸的电离、水和液氨的自偶电离等,都可看成是质子的转移反应,因此酸碱质子理论具有更广泛的适用范围和更强的概括能力,并为pH的计算带来许多便利。故本书有关pH计算均以质子理论为依据。首页末页下一页上一页192、一元弱酸弱碱的解离平衡(1)一元弱酸以醋酸(HAc)为例,说明一元弱酸在水溶液中的解离平衡。OHHAc2AcOH3简写为:HAcAcH标准解离常数为Θa(HAc)K=cccccc(HAc)/])/(Ac[])/(H[eqeqeq由于c=11Lmol,一般在不考虑aK的单位时,可将上式简化为:(HAc)aK=(HAc))(Ac)(Heqeqeqccc首页末页下一页上一页20设一元弱酸的浓度为c,解离度为,则平衡时有:HAcAcH)1(ccc平衡常数为:aK=)1(ccc=12c(3.9)当c较大而很小(一般满足a/Kc>400或a<5%)时,1≈1,则aK≈2c≈cKa(3.10))(Heqc=c≈cKa(3.11)首页末页下一页上一页21式(3.10)表明:弱酸的解离度与其浓度的平方根成反比。溶液越稀,解离度越大,这个关系式叫做稀释定律。aK和都可用来表示酸的强弱,随c而变,但在一定温度时,aK不随c而变,是一个常数。首页末页下一页上一页22(2)一元弱碱OHNH23OHNH4标准解离常数为b3(NH)K=cccccc)/(NH])/(OH[])/(NH[3eqeq4eq上式可简化为:)(NH3bK=)(NH)(OH)(NH3eqeq4eqccc设一元弱碱的浓度为c,解离度为,与一元弱酸相仿,平衡时有:OHNH23OHNH4)1(ccc平衡常数为:bK=)1(ccc=12c首页末页下一页上一页23当c较大而很小(一般满足a/Kc>400或a<5%)时,1≈1,则bK≈2c≈cKb(3.13))OH(eqc=c=cKb(3.14)应当注意,在计算碱性溶液的pH时,应先求出溶液中的OH浓度,然后再求H浓度和pH。首页末页下一页上一页24例3.3已知HCN的解离常数aK=10108.5,计算0.51LmolHCN的H浓度、OH浓度、pH和解离度。解:因a/Kc=)108.5/(5.010=81062.8>>400故可利用式(3.11)近似计算:)(Hc=cKa=5.0108.510=15Lmol1070.1)(OHc=)(HwcK=5141070.1101=110Lmol1088.5pH=)H(lgc=)1070.1lg(5=4.77=5.01070.15=5104.3=%0034.0首页末页下一页上一页25强酸弱碱盐(例如ClNH4)在水溶液中显酸性,是因为这些盐溶于水后解离出的阳离子与水解离出的OH离子作用生成弱碱,导致水的解离平衡向右移动,从而使溶液中的H浓度大于OH浓度,所以溶液呈现出酸性。这种盐的离子与溶液中的水解离出的H或OH作用生成弱电解质的反应,叫做盐的水解。以ClNH4溶液中4NH的水解为例,根据酸碱质子理论,可将4NH视为一元弱酸,在水溶液中存在如下解离平衡:OHNH2432HNHHO简写为4NH3NHH)(NH4aK=)(NH)(H)(NH4eqeq3eqccc=)(OH)(NH)(OH)(H)(NH-eq4eq-eqeq3eqccccc=)(NH3bwKK首页末页下一页上一页26上式可以推广到其它共轭酸碱对。任何共轭酸碱对的解离常数之间都有下述关系,即baKK=wK(3.12)首页末页下一页上一页27例3.4计算浓度为0.051Lmol34NONH溶液的pH和解离度。解:34NONH在水溶液中完全解离,解离出来的4NH发生水解,将4NH视为一元弱酸,则)NH(4aK=)NH(3bwKK=1451101.7710=105.6510因为a/Kc>400,所以溶液中的H浓度可近似计算为)H(c≈cKa=105.65100.05=65.32101LmolpH=)H(lgc=6lg(5.3210)=5.27解离度为≈cKa=105.65100.05=81011.1=41.0610=0.0106%首页末页下一页上一页28例3.5计算0.0101LmolNaF溶液的pH值(已知HF的aK=4109.6)。解:NaF在溶液中完全解离后,F会发生水解。将F视为一元弱碱,)(F-bK=(HF)awKK=414109.6101=1110449.1因为b/Kc>400,所以溶液中的OH浓度可近似计算为)OH(c≈cKb=010.010449.111=71081.31Lmol)(Hc=)(OHwcK=7--14103.81101=8102.621LmolpH=)H(lgc=)1062.2lg(8=7.58首页末页下一页上一页293、多元弱酸弱碱的解离平衡以32COH的解离为例予以说明。一级解离32COH3HCOH1aK=)COH()HCO()H(32eq3eqeqccc=71030.4二级解离3HCO23COH2aK=)HCO()CO()H(3eq23eqeqccc=111061.51aK和2aK分别表示32COH的一级解离常数和二级解离常数。在一般情况下,二元弱酸的1aK>>2aK,这表明二级解离比一级解离困难得多。首页末页下一页上一页30对于多元弱酸,若1aK/2aK>310,则二、三级解离产生的H可以忽略,溶液中H浓度的计算按一元弱酸溶液中+H浓度的计算方法做近似处理。思考:根据反应式H2S(aq)=2H+(aq)+S2ˉ,H+浓度是S2ˉ离子浓度的两倍,此结论是否正确?是错误的,H2S(aq)以一级电离为主,因此H2S溶液中c(H+)≈c(HSˉ)。-首页末页下一页上一页31例3.6计算25℃时,饱和2CO水溶液(0.0401Lmol32COH溶液)中的H、3HCO、23CO的浓度及溶液的pH值。解:由附录4查出32COH的1aK=71030.4,2aK=111061.5。若不考虑水的解离,且1aK/2aK>310,因此在计算溶液中的H浓度时可当作一元弱酸的解离平衡来处理。一级解离平衡:32COH3HCOH因为a1/Kc>400,所以)(Hc=cKa1=040.01030.47=41031.11Lmol)(HCO3c=)(Hc=41031.11Lmol又2aK=)HCO()CO()H(3eq23eqeqccc=)CO(23eqe=111061.5首页末页下一页上一页32得)(CO23c=111061.51LmolpH=)H(lgc=)1031.1lg(4=3.88如果将二级解离的H考虑进来,根据二级解离平衡:3HCO23COH,二级解离的H浓度等于23CO的浓度,则H的总浓度应为:)(Hc=-1141061.51031.1≈4101.311Lmol由此可见,前面的近似处理是合理的。首页末页下一页上一页334、影响弱酸弱碱解离平衡的因素(1)盐效应在弱电解质溶液中加入其它强电解质时,导致弱电解质的解离度增大的现象称为盐效应。比如在弱电解质HAc溶液中加入强电解质NaCl后,NaCl解离出来的Na和Cl使溶液中的离子浓度增大,带相反电荷的离子间相互吸引、相互牵制的作用增强,形成了“离子氛”,束缚了离子的自由运动,减小了离子的有效浓度,从而阻碍了溶液中的H和Ac结合生成弱电解质HAc,使得HAc的解离平衡HAcH+Ac向右移动,解离度增大。首页末页下一页上一页34(2)同离子效应在弱电解质溶液中,加入与之具有相同离子的强电解质时,会使弱电解质的解离度降低,这种现象叫作同离子效应。例如,在氨水中加入ClNH4,溶液中的4NH浓度增大,使平衡OHNH23OHNH4逆向移动,氨水的解离度减小。首页末页下一页上一页35例3.7在0.101LmolHAc溶液中加入一定量固体NaAc,使NaAc的浓度等于0.101Lmol,求该溶液中H浓度、pH和HAc的解离度,并与0.101LmolHAc溶液的解离度进行比较。解:设加入NaAc后,达到平衡时已解离的HAc的浓度为x1Lmol。HAcAcH起始浓度/1Lmol0.1000.10平衡浓度/1Lmolx10.0xx10.0aK=(HAc))(Ac)(Hccc=xxx10.0)10.0(≈x=51076.1首页末页下一页上一页36所以)H(c=x1Lmol=51076.11LmolpH=)H(lgc=)1076.1lg(5=4.75=cx/=10.0/1076.15≈%018.0而在0.101Lmol的HAc溶液中,因为a/Kc>400,所以)(Hc≈cKa=10.01076.15=13Lmol1033.1pH=)H(lgc=)1033.1lg(3=2.88=cc/)H(=1.0/1033.13=1.33%经比较,同离子效应使HAc的解离度从1.33%降为0.018%,)H(c从31034.11Lmol减少到51076.11Lmol。首页末页下一页上一页373.2.3缓冲溶液和pH值的控制往纯水或一般溶液中加酸或碱,通常会使溶液的pH值发生改变。但有一种溶液,当在其中加入少量的强酸、强碱或加少量水稀释时,pH值改变很小。这种能抵抗外加少量强酸、强碱或稍加稀释而保持溶液pH值基本不变的溶液称为缓冲溶液。缓冲溶液稳定溶液pH值的作用称为缓冲作用。按酸碱质子理论,缓冲溶液是由浓度足够大的共轭酸碱对组成的,一般由弱酸及其弱酸盐(例如NaAcHAc)或弱碱及其弱碱盐(例如ClNHOHNH423)组成,这两种物质合称为缓冲系或缓冲对。首页末页下一页上一页38表3.3常见的缓冲对缓冲对弱酸共轭碱apK(25)℃缓冲范围(pH)氨基乙酸HClCOOHNCHH22COONCHH222.352.35±1一氯乙酸NaOHCOOHClCH2COOClCH22.862.86±1甲酸NaOHHCOOHHCOO3.743.74±1NaAcHAcHAcAc4.754.75±1六亚甲基四胺HClHN)CH(462462N)CH(5.135.13±14242HPONaPONaH24HPO24HPO7.207.20±1三羟乙胺HCl322)OHCHCH(HN322)OHCHCH(N7.767.76±1三羟甲基甲胺HCl323OH)NC(CHH322OH)NC(CHH8.088.08±1ClNHNH43+4NH3NH9.259.25±1323CONaNaHCO3HCO23CO10.3310.33±1NaOHHPONa4224HPO34PO12.3512.35±1首页末页下一页上一页39Ac-H+H+OH-以HAc和NaAc的混合溶液为例:NaAc=Na++Ac-HAc(aq)H+(aq)+Ac-(aq)HAcH2OAc-对抗加进来的酸,而HAc对抗加进来的碱,最终维持溶液的pH值基本保持不变。首页末页下一页上一页40设弱酸(HA)的初始浓度为共轭酸c,共轭碱(A)的初始浓度为共轭碱c,解离平衡时溶液中的H浓度为x1Lmol。根据弱酸的解离平衡:HAAH平衡浓度xc共轭酸xxc共轭碱平衡常数aK=)HA()A()H(ccc=xcxcx共轭酸共轭碱)(由于同离子效应,x很小,所以xc共轭酸≈共轭酸c,xc共轭碱≈共轭碱caK=共轭酸共轭碱cxc)H(c=x=共轭碱共轭酸ccKa首页末页下一页上一页41对等式两边分别取负对数:pH=共轭碱共轭酸ccKlgpa(3.15)式(3.15)即为计算弱酸与其共轭碱组成的缓冲溶液pH的公式。同理可得弱碱与其共轭酸组成的缓冲溶液pH的计算公式:pOH=共轭酸共轭碱ccKlgpbpH=pOH14=共轭酸共轭碱ccKlgp14b(3.16)式(3.15)、(3.16)可统一由下式表达:pH=共轭碱共轭酸ccKlgpa(3.17)首页末页下一页上一页42例3.8计算由200mL0.201Lmol3NH和100mL0.301LmolClNH4组成的混合溶液的pH。并分别计算在此混合溶液中加入20mL0.101LmolHCl、20mL0.101LmolNaOH和50mLOH2后,混合溶液的pH。解:(1)忽略两溶液混合所引起的体积变化,原混合液的pH可根据式(3.17)计算:pH=)NH()NH(lgp34accK=0.30100/(200100)9.25lg0.20200/(200100)=9.37首页末页下一页上一页43(2)加入20mL0.101LmolHCl后,会消耗掉0.002mol3NH,并生成0.002mol4NH,故有OHNH23OHNH4平衡浓度/(1Lmol)2010020020100200200..2010020020100100300..所以pH=)NH()NH(lgp34accK=2010.010020.02010.010030.0lg25.9=9.32可见,加入20mL0.101LmolHCl后,溶液的pH由9.37降为9.32,只减小了0.05,说明缓冲溶液具有抵抗外来少量强酸的能力。首页末页下一页上一页44(3)加入20mL0.101LmolNaOH后,会消耗掉0.002mol4NH,并生成0.002mol3NH,故有OHNH23OHNH4平衡浓度/(1Lmol)2010020020100200200..2010020020100100300..所以pH=)NH()NH(lgp34accK=2010.010020.02010.010030.0lg25.9=9.43可见,加入20mL0.101LmolNaOH后,溶液的pH由9.37增为9.43,只增加了0.06,说明缓冲溶液具有抵抗外来少量强碱的能力。首页末页下一页上一页45(4)加入50mLOH2后,缓冲溶液中的共轭酸碱的浓度同时降低相同的幅度,而共轭酸、碱的物质的量和缓冲比不变,据式(3.17)可知,pH基本不变,说明缓冲溶液具有抵抗稀释的能力。首页末页下一页上一页46例3.9现有250mL2.01Lmol的NaAc溶液,欲配置500mLpH=5.0的缓冲溶液,需加入6.01Lmol的HAc溶液多少mL?解:缓冲溶液的pH计算公式为:pH=共轭碱共轭酸ccKlgpaHAc的电离常数aK=51076.1,则apK=)1076.1lg(5=4.75。配成缓冲溶液后,溶液中NaAc的浓度为共轭碱c=50.00.225.0=1.01Lmol将pH=5.0,apK=4.75,共轭碱c=1.01Lmol代入上述pH计算公式:5.0=00.1lg75.4共轭酸c首页末页下一页上一页47则共轭酸c=0.561Lmol设加入V毫升6.01LmolHAc溶液,则5000.6V=0.56得x=46.7mL故需加入6.01LmolHAc溶液的体积为46.7mL,其余为去离子水。首页末页下一页上一页48工业:金属电镀、制革、染料、半导体工业;农业:土壤中多种有机酸及其共轭碱组成的缓冲系统,使土壤维持一定pH值保证植物的正常生长;生物学:H2CO3-NaHCO3形成的缓冲系统使人体血液维持在pH≈7.4。缓冲溶液的应用首页末页下一页上一页49思考:缓冲溶液的缓冲能力与哪些因素有关?缓冲能力主要与以下因素有关:缓冲溶液中共轭酸的pKa值:缓冲溶液的pH在其pKa值附近时,缓冲能力最大。缓冲对的浓度比:为1:1或相近(0.1~10)时,缓冲能力较大。缓冲对的浓度:缓冲对的浓度均较大时,缓冲能力较大。首页末页下一页上一页503.3难溶电解质的多相离子平衡可溶电解质的解离平衡是单相体系的离子平衡。难溶电解质在水溶液中,存在固体和溶液中离子之间的平衡,即多相离子平衡。3.3.1溶度积常数所谓“难溶”电解质并非在水中完全不溶。化学上把在100gOH2中溶解度小于0.01g的物质称作难溶物,所以难溶电解质仍有很少量的物质溶解。在难溶固体和溶液中的离子之间存在一个动态的沉淀-溶解平衡:AgClClAg平衡时溶液中各离子的浓度(严格讲是活度)不再改变,溶液达到饱和。其标准平衡常数表达式为:K=spK=cccc)Cl()Ag(首页末页下一页上一页51若不考虑平衡常数的单位,则上式可以化简为:K=spK=)Cl()Ag(ccspK称为溶度积常数,简称溶度积。表示在难溶电解质饱和溶液中,有关离子浓度幂(每种离子浓度的指数与化学计量式中的计量数相等)的乘积在一定温度下是一个常数。它反映了物质的溶解能力,其大小与物质的本性和温度有关,而与离子浓度的改变无关。首页末页下一页上一页523.3.2溶度积和溶解度的关系对于一般的沉淀-溶解平衡:)s(BAnm)aq(B)aq(Amnnm平衡浓度/(1Lmol)mSnSS与spK之间的关系为spK=nmnSmS)()(对于AB型难溶电解质:S=)AB(spK首页末页下一页上一页53对于2AB型(或BA2型)难溶电解质:S=32sp4)AB(K对于3AB型难溶电解质:S=43sp27)AB(K必须指出,上面的换算方法,只适用于已溶解部分能全部解离的难溶电解质,并且解离出的阴离子、阳离子在水溶液中不发生水解等副反应或副反应程度不大。首页末页下一页上一页54例3.10已知25℃时,3CaCO的溶解度为510327.91Lmol,求3CaCO的溶度积。解:假设溶解的3CaCO完全解离,)s(CaCO3)aq(CO)aq(Ca232平衡浓度/(1Lmol)SS)CaCO(3spK=)CO()Ca(232cc=2S=25)10327.9(=1010699.8首页末页下一页上一页55例3.11已知25℃时,)AgCl(spK=10108.1,)CrOAg(42spK=12101.1。通过计算说明哪一种银盐在水中的溶解度较大?解:AgCl为AB型难溶电解质,设其溶解度为1S1S=)AgCl(spK=10108.1=51034.11Lmol42CrOAg为BA2型难溶电解质,设其溶解度为2S2S=342sp4)COAg(K=3124101.1=5105.61Lmol计算结果表明1S<2S,因而AgCl在水中的溶解度比42CrOAg要小。通过例3.11可以看出,溶度积的大小与溶解度有关,它反映了物质的溶解能力。对同类型难溶电解质,在相同温度下,可用spK值判断溶解度的大小,但对于不同类型的难溶电解质,则不能直接用spK值判断溶解度的相对大小。首页末页下一页上一页563.3.3溶度积规则对于任一难溶电解质的多相离子平衡,在任意条件下:)s(BAnm)aq(B)aq(Amnnm其反应商Q为Q=nmmncc)B()A(根据化学平衡移动的一般原理,可以利用离子积Q与溶度积spK的相对大小来判断沉淀能否溶解或生成:(1)Q>spK,平衡向左移动,有沉淀生成;(2)Q=spK,处于平衡状态,溶液为饱和溶液;(3)Q)PbCl(2spK,因此)Cl(c>)Pb()PbCl(22spcK=20.01017.15=31065.71Lmol3.3.4溶度积规则的应用(1)沉淀的生成首页末页下一页上一页59(3)当)Cl(c=2100.61Lmol时,)Pb(2c=)Cl()PbCl(22spcK=225)100.6(1017.1=3103.31Lmol残留在溶液中的2Pb的百分数为:%10020.0103.33=1.65%首页末页下一页上一页60例3.13若某酸性溶液中3Fe和2Mg浓度均为0.011Lmol,试计算说明能否控制一定的pH值,使其分别沉淀以达到分离的目的。(提示:一般认为溶液中待沉淀离子的浓度≤5100.11Lmol时,即可认为该离子沉淀完全了。)解:查附录7知:])Fe(OH[3spK=391064.2,])Mg(OH[2spK=121061.5。根据3)Fe(OH和2)Mg(OH的spK值,可以推知溶液中3Fe沉淀所需的OH浓度低,所以往溶液中加OH时,3Fe先沉淀析出。应该控制溶液的pH,使3Fe沉淀完全后,2Mg才沉淀析出,这样才能达到分离的目的。首页末页下一页上一页61当3)Fe(OH沉淀完全时,必须满足Q>spK[Fe(OH)3],且)Fe(3c≤5100.11Lmol,所以)OH(c>3539100.11064.2=121042.61LmolpH=)OH(lg14c>2.81当2Mg(OH)开始沉淀时,必须有Q=)OH()Mg(22cc>])Mg(OH[2spK,所以)OH(c>)Mg(])OH(Mg[22spcK=01.01061.512=52.37101LmolpH=)OH(lg14c>9.37首页末页下一页上一页62当2Mg(OH)完全沉淀时,必须满足Q>])Mg(OH[2spK,且)Mg(2c≤5100.11Lmol,所以)OH(c>512100.11061.5=41049.71LmolpH=)OH(lg14c>10.87由计算可知,只要控制pH在2.81~9.37之间,就可使3Fe完全沉淀,而2Mg不沉淀。待3Fe完全沉淀后,调节溶液pH>10.87,即可使2Mg完全沉淀,从而使3Fe和2Mg得到分离。首页末页下一页上一页63(2)沉淀的溶解(A)利用酸碱反应例如往含有3CaCO固体的饱和溶液中加入HCl,能使3CaCO溶解,产生2CO气体。)aq(H2)s(CaCO3O(l)H)g(CO)aq(Ca222该反应的实质是H与23CO生成32COH,而32COH不稳定分解为2CO和OH2,从而降低了溶液中的23CO的浓度,使Q小于溶度积)CaCO(3spK,促使平衡向溶解的方向进行。可见,当难溶电解质能通过酸碱反应生成弱酸、水等弱电解质时,这些难溶电解质就可能溶解。如难溶金属氢氧化物、部分不太活泼金属的硫化物(FeS、ZnS等)都可用稀酸溶解。首页末页下一页上一页64(B)利用氧化还原反应有一些难溶于酸的硫化物,如CuS、PbS等,不能像FeS那样溶于非氧化性的酸,但能溶于氧化性酸(如3HNO)。例如下列反应:)(8HNO3PbS(s)3稀===O(l)H4)g(NO2)s(S3)NO(Pb3223(C)利用配位反应当难溶电解质中的金属离子与某些试剂形成配离子时,降低了金属离子的浓度,使Q



















