






《九年级化学下册 第十单元 酸和碱 课题1 常见的酸碱课件PPT下载》是由用户上传到老师板报网,本为文库资料,大小为3.16 MB,总共有61页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 61页
- 3.16 MB
- VIP模板
- pptx
- 数字产品不支持退货
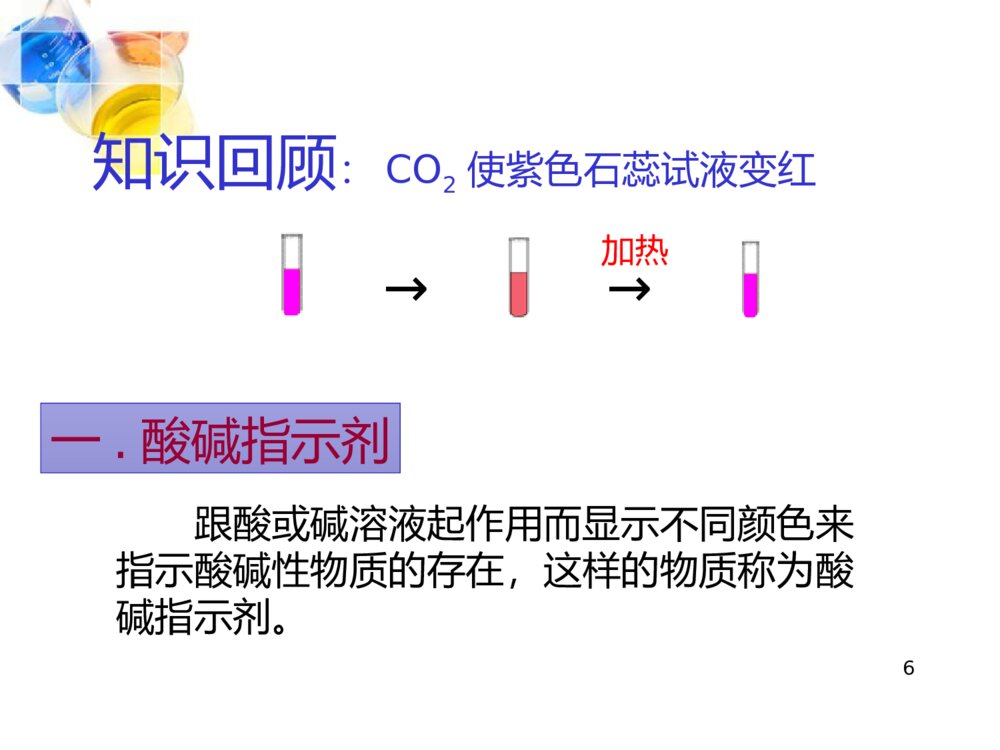
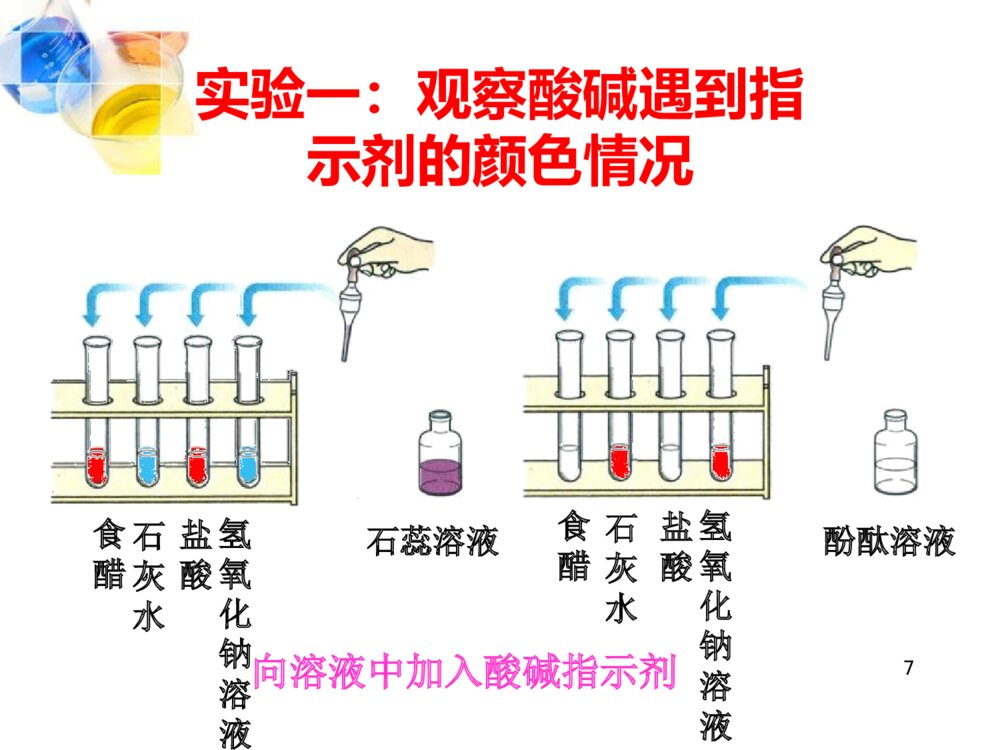
1第十单元酸和碱课题1常见的酸和碱21、认识一些常见的酸和碱的主要性质和用途;2、会用酸碱指示剂检验溶液的酸碱性;3、认识酸和碱的腐蚀性及使用时的安全注意事项。3常见的酸有盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)和醋酸(CH3COOH)。常见的碱有氢氧化钙Ca(OH)2氢氧化钠NaOH请你说一说你所认识的酸和碱:预习检测家中的两种洗洁剂,含的物质相同吗?各属于什么类物质?有什么区别?41、人的胃液里含有盐酸;2、汽车电瓶里含有硫酸;3、食醋里含有醋酸,也叫乙酸;4、酸雨里含有亚硫酸,也可能含有硝酸。5食醋→醋酸柠檬、柑橘等→柠檬酸酸奶→乳酸6一.酸碱指示剂 跟酸或碱溶液起作用而显示不同颜色来指示酸碱性物质的存在,这样的物质称为酸碱指示剂。知识回顾:CO2使紫色石蕊试液变红→加热→7食醋酚酞溶液石蕊溶液氢氧化钠溶液石灰水盐酸食醋氢氧化钠溶液石灰水盐酸向溶液中加入酸碱指示剂实验一:观察酸碱遇到指示剂的颜色情况8加入紫色石蕊溶液后的颜色变化加入无色酚酞溶液后的颜色变化食醋石灰水盐酸氢氧化钠溶液变红变红变蓝变蓝无颜色变化无颜色变化变红变红9石蕊和酚酞溶液能跟酸和碱的溶液起作用而显示不同的颜色,叫做酸碱指示剂,通常也简称指示剂。石蕊溶液遇酸,溶液变红。遇碱,溶液变成蓝色。酚酞溶液遇酸,溶液不变色。遇碱,溶液变成红色。酸碱指示剂101112能用酚酞溶液吗?13活动与探究 石蕊指示剂是从石蕊地衣中提取的紫色浸液,是化学上最早广泛用来鉴别溶液酸碱性的一种试剂。 它是17世纪被英国化学家波义耳首先发现的。 还有很多植物色素也可以做酸碱指示剂试一试将石蕊和酚酞溶液分别加入下面四种溶液中,会出现什么现象? 溶液指示剂紫色石蕊溶液无色酚酞溶液白醋苹果汁石灰水氢氧化钠溶液探究:自制酸碱指示剂。阅读教材51页资料卡片14二.常见的酸盐酸硫酸硝酸醋酸碳酸HClH2SO4HNO3CH3COOHH2CO31.几种常见的酸15探究一:浓硫酸和浓盐酸的物理性质观察浓硫酸和浓盐酸的状态、颜色,比较它们与同体积水的质量大小,打开瓶塞,观察发生的现象;闻一闻是否有气味?注意:闻气体的方法16探究一:浓硫酸和浓盐酸的物理性质浓硫酸浓盐酸溶质的化学式颜色状态气味密度(与水比较)打开瓶口的现象其它H2SO4HCl无色无色液态液态无剌激性气味有剌激性气味大大无现象瓶口有白雾有吸水性有挥发性油状、粘稠、液体17讨论:敞放久置于空气中的浓硫酸和浓盐酸,各成分怎样变化?溶质质量溶剂质量溶液质量溶质质量分数浓盐酸浓硫酸减少不变减少减少不变增加增加减少提示:由于浓硫酸有吸水性,实验室常用来作干燥剂18点拔:打开浓盐酸的瓶盖后,看到有白雾出现,原因是浓盐酸挥发了氯化氢气体,该气体溶于空气中水分,形成盐酸小液滴。由此得出浓盐酸有挥发性和氯化氢气体易溶于水的性质。拓展:雾的产生原理:液态小液滴悬浮于空气中形成的。烟的产生原理:固态小颗粒悬浮于空气中形成的。191.浓盐酸具有挥发性,打开瓶盖,挥发出的氯化氢遇到空气中的水蒸气,在瓶口形成白雾,因此,敞口久置后质量会减轻。2.浓硫酸具有吸水性,但无挥发性,所以打开瓶盖时瓶口没有白雾,但敞口久置于空气中,会吸收空气中的水分,质量增加。浓盐酸浓硫酸↑↓实验探究202.盐酸和硫酸的用途:用途盐酸硫酸讨论:盐酸、硫酸有哪些主要用途?重要化工产品。用于金属表面除锈、制药等;人体胃液中含有盐酸,可帮助消化。重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、冶炼石油和金属除锈等。浓硫酸有吸水性,在实验室中常用它做干燥剂。213、浓硫酸的腐蚀性[实验10-3]实验时要注意安全,不要将浓硫酸沾到皮肤和衣服上,实验物品应在玻璃片上进行实验。纸张的笔画部分变黑木棒上蘸有浓硫酸的部分变黑滴到酸的布由黄变黑,容易破损启发结论或原因一段时间后的现象将浓硫酸滴到布上用木棍蘸浓硫酸浓硫酸在纸上写字实验内容浓硫酸有很强的腐蚀性,能使纸张、木条、布甚至皮肤脱水而腐蚀使用浓硫酸时要特别小心点拔:浓硫酸的强腐蚀性实质是浓硫酸将物质中氢氧两元素按水的组成比脱去,这种作用通常叫做脱水性。结论:浓硫酸有很强的腐蚀性(脱水性),能使纸张、木条、布甚至皮肤脱水而炭化。2223正确稀释浓硫酸的方法:一定要把浓硫酸沿器壁慢慢注入水中,并不断搅拌。(酸入水)!事故处理:如果浓硫酸沾到皮肤或衣服上,应该怎么办? 应立即用布擦掉,再用大量水冲洗,然后涂上3%-5%的碳酸氢钠溶液。24稀释浓硫酸现象:水浮在浓硫酸上面,并迅速沸腾,液体向四周飞溅。→稀释时,如果将水倒入酸中将会十分危险!25稀释浓硫酸时应该:酸入水(或大入小),沿内壁,慢慢倒,不断搅。强调:用玻璃棒搅拌的目的是加快热量散发,防止液体暴沸,发生危险。讨论:浓硫酸有很强的腐蚀性,万一不慎将浓硫酸沾到皮肤或衣服上,应如何处理?应立即用布擦掉,再用大量的水冲洗,然后涂上3%-5%的碳酸氢钠溶液。点拔:1、用大量水冲洗的目的:使浓硫酸稀释且带走稀释时放出的热量2、涂上3%—5%的碳酸氢钠溶液的目的:碳酸氢钠溶液与硫酸反应从而除去硫酸。小结:26归纳:浓硫酸的特性•吸水性(干燥剂:O2、H2、N2、CO2、CO)(NH3不行)•脱水性•强烈的腐蚀性•强氧化性27三.酸的化学性质联系生活:菜刀上的铁锈,水很难洗净,但用醋擦洗,会很容易,为什么?*酸与活泼金属的反应*使指示剂变色能与金属活动顺序表中氢前的金属反应,KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu金属活动顺序由强到弱---------------------------------------------------------------------28探究二:稀硫酸和稀盐酸的化学性质实验内容现象与结论在稀盐酸与稀硫酸中分别加入紫色石蕊和无色酚酞将镁、锌、铁、铜分别放入稀硫酸、稀盐酸中稀硫酸、稀盐酸分别与铁锈、氧化铜作用稀盐酸、稀硫酸分别与氢氧化铜、氢氧化铁作用稀盐酸与石灰石作用用稀硫酸和稀盐酸做几个简单的实验,把观察到的现象填入下表,并与同学们讨论以下问题:石蕊:变红酚酞:不变色除铜外,有气泡产生,反应速率:镁>锌>铁铁锈溶解,溶液黄色氧化铜溶解,溶液蓝色氢氧化铜溶解,溶液蓝色氢氧化铁溶解,溶液黄色石灰石溶解,产生大量气泡29写出盐酸、硫酸分别与铁、镁、锌、铝发生化学反应的方程式Mg+2HCl==MgCl2+H2↑Mg+H2SO4==MgSO4+H2↑2Al+6HCl==2AlCl3+3H2↑2Al+3H2SO4==Al2(SO4)3+3H2↑Zn+2HCl==ZnCl2+H2↑Zn+H2SO4==ZnSO4+H2↑Fe+H2SO4==FeSO4+H2↑Fe+2HCl==FeCl2+H2↑30*酸与金属氧化物的反应实验现象化学方程式铁锈+盐酸红色铁锈消失,溶液变为黄色Fe2O3+6HCl==2FeCl3+3H2O铁锈+硫酸红色铁锈消失,溶液变为黄色Fe2O3+3H2SO4=Fe2(SO4)3+3H2O31写出硫酸与氧化铜的化学方程式•写出盐酸与氧化镁的化学方程式•硫酸与氧化钙32*与含有碳酸根离子的物质发生化学反应CaCO3+2HCl=CaCl2+H2O+CO2↑33补充1:盐酸跟硝酸银的反应现象分析有白色沉淀生成AgNO3+HCl=AgCl↓+HNO3实验步骤:在盛有少量稀盐酸的试管中滴入几滴硝酸银溶液,观察现象。34补充2:硫酸跟氯化钡的反应现象分析有白色沉淀生成实验步骤:在盛有少量稀硫酸的试管中滴入几滴氯化钡的溶液,观察现象H2SO4+BaCl2=BaSO4↓+2HCl35酸的通性1、使指示剂变色2、可以与活泼金属发生化学反应而生成氢气3、可以与金属(碱性)氧化物发生反应4、可以与盐发生反应5、可以与碱发生361.将紫色石蕊试液滴入石灰水中,溶液的颜色变成()A、无色B、蓝色C、红色D、紫色2.下列物质的性质中,属于化学性质的是()A、浓硫酸有吸水性B、硫酸有酸性C、浓盐酸有挥发性D、食盐溶于水3.“使用硫酸要十分小心”的原因是什么?回答最准确的()A、硫酸无色、黏稠、油状、不易挥发B、具有吸水性,一般用作干燥剂,不宜与人直接接触C、具有吸水性,又能夺取一些物质的水分D、硫酸对皮肤或衣服有很大的腐蚀性,浓硫酸还能夺取皮肤、衣服里的水分,使其炭化BBD随堂练习37随堂练习4.一定量的空气依次通过足量石灰水及浓硫酸,分别被除去的是()A、氮气和氧气B、氮气、氧气和稀有气体C、二氧化碳和水蒸气D、二氧化碳和氧气5.向某溶液中滴入无色酚酞溶液后不显色,向该溶液中滴入紫色石蕊试液,则()A、一定显红色B、可能仍为紫色,也可能显红色C、可能显蓝色D、一定显无色38分析:此题涉及酸与金属、酸与金属氧化物反应,据化学方程式Zn+H2SO4==ZnSO4+H2↑2Zn+O2==2ZnOZnO+H2SO4=ZnSO4+H2OZn~ZnSO42Zn~2ZnO~2ZnSO4列出关系式,锌元素守恒,所以硫酸锌质量相等,选C6.将一Zn片等分为质量相等的两块,一块溶于足量稀硫酸中,另一块在空气中煅烧为ZnO后再溶于稀硫酸中,两种方法制得的ZnSO4质量()A、前者多B、后者多C、一样多D、无法判断点燃随堂练习39四、常见的碱1.氢氧化钠(NaOH)实验现象分析观察放表面皿上放入水中白色块状固体表面潮湿试管外壁温度较高氢氧化钠吸收空气中的水分溶解时放热40①氢氧化钠是白色的固体。②氢氧化钠暴露在空气中容易吸收水分,表面潮湿并逐渐溶解。这种现象叫做潮解。③氢氧化钠可用做某些气体的干燥剂(如:H2、O2、NH3等)。④氢氧化钠极易溶于水,溶解时会放出大量的热。小结:(1)氢氧化钠(NaOH)物理性质41(1)、氢氧化钠有强烈的腐蚀性,其俗名叫苛性钠、火碱或烧碱。(2)、如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。(3)、易吸水而潮解。(2)氢氧化钠的特性422.氢氧化钙[Ca(OH)2]CaO+H2O=Ca(OH)2(1)氢氧化钙也有腐蚀性,使用时应注意安全。(2)常见的碱还有氢氧化钾(KOH)、氢氧化钡Ba(OH)2 、氨水(NH3·H2O)、Cu(OH)2、Fe(OH)3等。431.碱溶液能使紫色的石蕊溶液变蓝色,使无色的酚酞溶液变红色。2.碱能与某些非金属氧化物反应(酸性氧化物)五、碱的化学性质2NaOH+CO2=Na2CO3+H2O(吸收CO2)Ca(OH)2+CO2=CaCO3↓+H2O(检验CO2)氢氧化钠放置在空气中会发生变质,所以氢氧化钠必须密封保存。44【思考】不同的酸为什么有相似的化学性质? 不同的碱为什么也有相似的化学性质?2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2OCa(OH)2+SO2=CaSO3+H2OCa(OH)2+SO3=CaSO4+H2O45导电性实验46酸盐酸、硝酸和硫酸都能够导电,说明在水溶液中电离生成了能够自由移动的离子。电离方程式:HNO3=H++NO3-HCl=H++Cl-H2SO4=2H++SO4-电离时生成的阳离子全部是氢离子的化合物叫做酸。47碱碱溶液通电前碱溶液通电后碱溶液的导电演示实验48通过演示实验可知氢氧化钾和氢氧化钡的溶液也能够导电,说明在水溶液中电离出能够自由移动的离子。电离方程式:KOH=K++OH-Ba(OH)2=Ba2++2OH-NaOH=Na++OH-电离时生成的阴离子全部是氢氧根离子的化合物叫做碱。注意电荷守恒49盐•氯化钠溶液导电性演示实验50由课堂演示实验可知,氯化钠、硫酸镁和氯化钡的溶液也能够导电,说明在水溶液中电离出能够自由移动的离子。电离方程式:NaCl=Na++Cl-MgSO4=Ba2++SO42-BaCl2=Ba++2Cl-电离时生成金属离子和酸根离子的化合物叫做盐。包括铵根离子51巩固联系•1.下列各组离子,属于酸的电离产物的是()•A.H+、Na+、SO42-B.Na+、OH-•C.H+、Cl-、NO3-D.Na+、SO42-•2.碱溶液中一定含有的离子是()•A.H+B.Na+C.OH-D.SO42-•3.下列物质属于盐的是()•A.H2SO4B.H2O•C.NaOHD.NaCl52•4.下列电离方程式正确的是()•A.Ba(OH)2=Ba2++2OH-•B.H2SO4=H2++SO42-•C.FeCl3=Fe2++SO42-•D.Cu(NO3)=Cu2++2(NO3)-•5.下列说法正确的是()•A.能电离出氢离子的化合物一定是酸•B.电离出的阳离子全部是氢离子的物质叫酸•C.碱中必含氢氧两种元素•D.盐中必含金属元素53某溶液中含Fe3+、Mg2+、SO42-、NO3-,其中Fe3+、Mg2+、SO42-的个数比为3:3:1,可推知溶液中Fe3+、SO42-、NO3-的个数比是()。 A、3:2:1B、1:2:1C、3:1:15D、3:1:135455【题1】若将潮湿的空气依次通过烧碱溶液、浓硫酸和红热的铜网,将会依次除去空气中的_____、________、和________,最后剩余的气体主要是_______。【题2】下列气体中,既能用固体NaOH干燥又能用浓H2SO4干燥的是( ) A.CO2B.HClC.SO2D.O2随堂练习56随堂练习【解析】干燥原理:干燥剂只吸收水分,但不能与被干燥的气体发生反应。CO2、SO2、HCl都能与NaOH反应,故三者均不能用NaOH来干燥,而O2既不能与NaOH反应,也不能与浓H2SO4反应,故用浓H2SO4、NaOH干燥都可以。【题3】将混有少量氧化铜的铁粉,加入到盛有稀硫酸的烧杯中,充分反应,有部分铁剩余,过滤后,滤液中含有的溶质是( ) A.H2SO4B.FeSO4C.FeSO4和CuSO4D.H2SO4和FeSO457学完本课题你应该知道酸的化学性质•1、跟指示剂的反应•2、跟金属的反应•3、跟金属氧化物的反应•4、跟碱的反应•5、跟某些盐反应酸的化学性质石蕊试液遇酸变成红色,酚酞试液遇酸不变色。酸+金属==盐+氢气↑Fe2O3+6HCl=2FeCl3+3H2O•金属氧化物+酸==盐+水NaOH+HCl=NaCl+H2O酸+碱==盐+水2、碱能与酸性氧化物反应1、碱能与指示剂反应3、碱中电离出来的阴离子全部为OH-离子4、酸中电离出来的阳离子全部为H+离子碱的化学性质学完本课题你应该知道58HCl→H++Cl-H2SO4→2H++SO42-NaOH→ Na++OH-Ca(OH)2→Ca2++2OH-酸在水溶液中都能解离出H+和酸根离子,即在不同的酸溶液中都含有相同的H+,所以酸有一些相似的性质。这种在水溶液中解离出的阳离子全部是H+化合物,叫酸。碱溶液中也含有相同的OH-,所以,碱也有一些相似的性质。在水溶液中解离出的阴离子全部是OH-的化合物叫碱5960由课堂演示实验可知,氯化钠、硫酸镁和氯化钡的溶液也能够导电,说明在水溶液中电离出能够自由移动的离子。电离方程式:NaCl=Na++Cl-MgSO4=Ba2++SO42-BaCl2=Ba++2Cl-电离时生成金属离子和酸根离子的化合物叫做盐。包括铵根离子61课后练一练请同学们独立完成配套课后练习题。



















