






《《第2节 化学反应的限度》化学平衡转化率PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为294.5 KB,总共有8页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 8页
- 294.5 KB
- VIP模板
- ppt
- 数字产品不支持退货
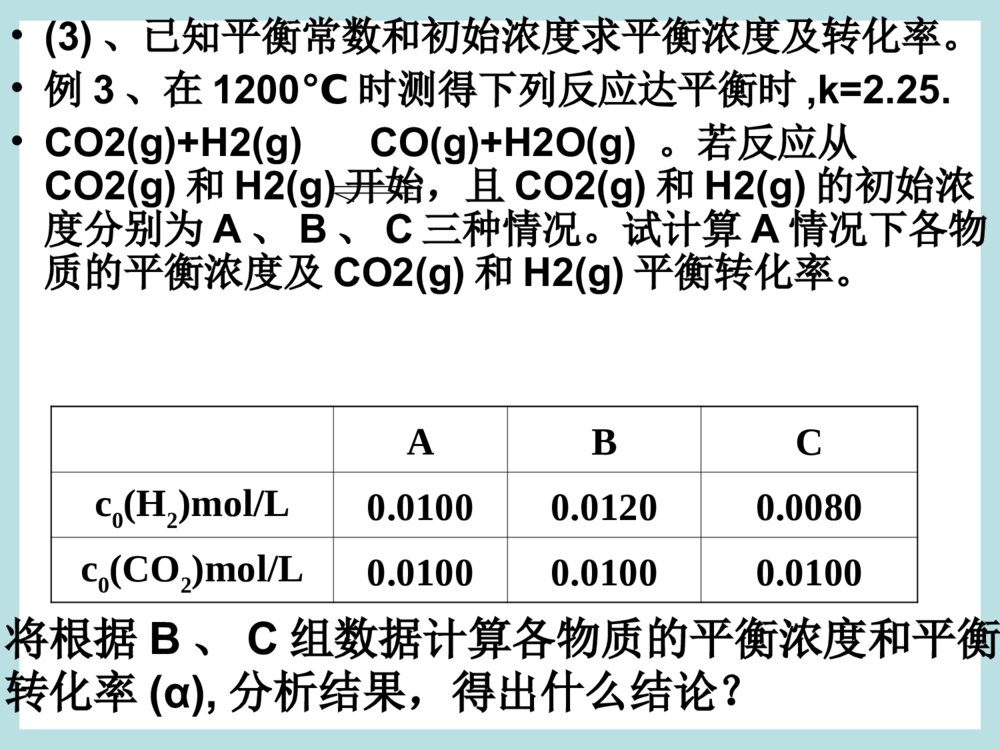
第二课时第2节化学反应的限度•二、平衡转化率(α)•1、表达式:对于化学反应aA+bBcC+dD,反应物A的平衡转化率可表示为:α(A)=A的初始浓度-A的平衡浓度A的初始浓度×100%=c0(A)–[A]c0(A)×100%2、平衡转化率的有关计算关于平衡常数和平衡转化率的计算主要有以下三种类型(1)、已知初始浓度和平衡浓度求平衡常数和平衡转化率•例1:对于反应2SO2(g)+O2(g)2SO3(g),若在一定温度下,将0.1mol的SO2(g)和0.06molO2(g)注入一体积为2L的密闭容器中,当达到平衡状态时,测得容器中有0.088mol的SO3(g)试求在该温度下•(1)此反应的平衡常数。•(2)求SO2(g)和O2(g)的平衡转化率•由例1可知,一个已标明化学方程式的化学反应,在温度一定时虽然只有一个平衡常数,但是不同反应物的平衡转化率可能不同。因此,脱离具体的反应物谈化学平衡转化率是没有意义的。•(2)、已知平衡转化率和初始浓度求平衡常数•例2:反应SO2(g)+NO2(g)SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。•(1)此反应的平衡常数。•(2)若SO2(g)的初始浓度增大到3mol/L,NO2(g)的初始浓度仍为2mol/L,则SO2(g)的转化率变为多少?(1)K=1(2)SO2的转化率为40%•(3)、已知平衡常数和初始浓度求平衡浓度及转化率。•例3、在1200℃时测得下列反应达平衡时,k=2.25.•CO2(g)+H2(g)CO(g)+H2O(g)。若反应从CO2(g)和H2(g)开始,且CO2(g)和H2(g)的初始浓度分别为A、B、C三种情况。试计算A情况下各物质的平衡浓度及CO2(g)和H2(g)平衡转化率。ABCc0(H2)mol/L0.01000.01200.0080c0(CO2)mol/L0.01000.01000.0100将根据B、C组数据计算各物质的平衡浓度和平衡转化率(α),分析结果,得出什么结论?•化学平衡常数与转化率的区别和联系•由化学平衡常数K可以推断反应进行的,K越大,说明反应进行的越,反应物的转化率也越,但K只与有关;转化率也可以表示某一可逆反应进行的,α越大,反应进行的越,但是α与反应物的起始浓度等因素有关,转化率变化了,K变化。程度完全高温度程度完全不















