







《高中化学必修二第一章第二节《元素周期律》PPT课件》是由用户上传到老师板报网,本为文库资料,大小为419 KB,总共有27页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 27页
- 419 KB
- VIP模板
- ppt
- 数字产品不支持退货
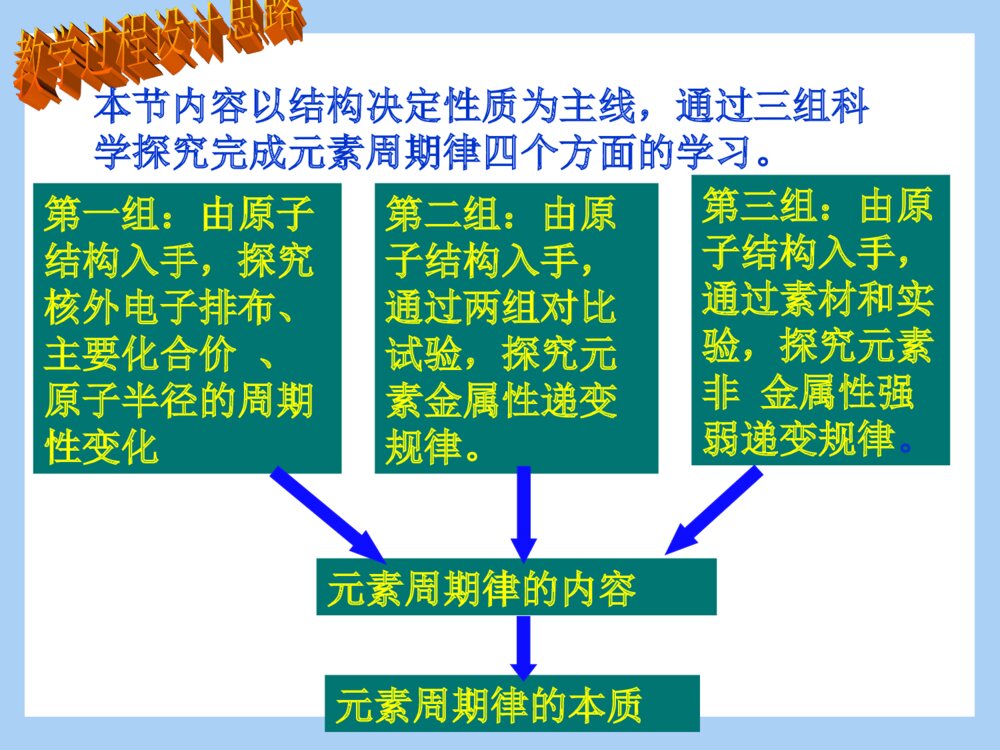
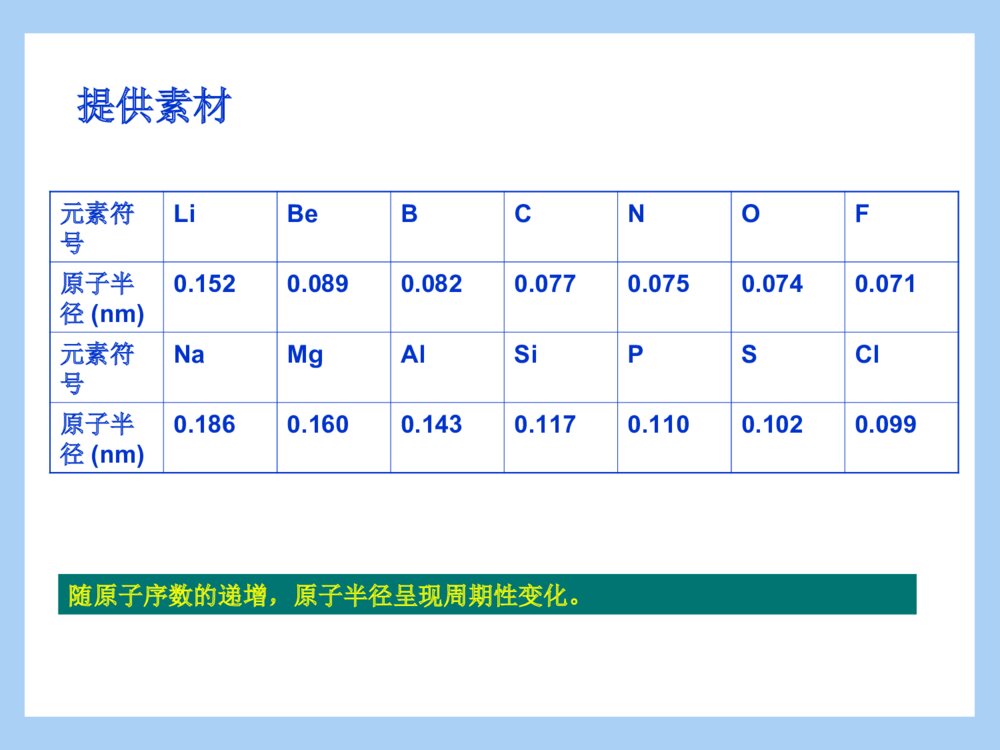
必修二第一章第二节元素周期律(第二课时)郏县二高化学组 张红侠一本节内容的地位与作用二教学目标的及重难点的确定三教学过程设计思路四教学过程五归纳总结在本章的第一节,学生学习了元素周期表,并研究了碱金属及卤族元素性质递变规律,了解了一些科学探究的方法。第二节的第一课时学习了原子核外电子排布知识,为元素周期律的学习奠定了理论基础,在此基础上,应该说元素周期律已经水到渠成了,本节内容为元素周期律的归纳、提炼过程。通过本节的学习,学生树立起结构决定性质的化学学科思想,便于学生系统地掌握元素化合物的知识。根据《课程标准》《考试大纲》的要求、及学生的实际情况,拟定以下教学目标:知识与技能:能结合有关数据和实验事实认识元素周期律,了解原子结构与元素性质的关系。过程与方法:本节教学设计的宗旨是增大学生在课堂上的参与度与思维量,使学生在课堂上处于深刻学习状态,培养学生探究问题的能力,让学生充分体会知识的发现过程。情感态度与价值观:使学生树立量变引起质变的唯物思想,培养探究、合作交流等现代意识。重点:元素周期律的含义和实质,元素性质与原子结构的关系难点:与元素金属性非金属性相关的事实。本节内容以结构决定性质为主线,通过三组科学探究完成元素周期律四个方面的学习。第一组:由原子结构入手,探究核外电子排布、主要化合价、原子半径的周期性变化第二组:由原子结构入手,通过两组对比试验,探究元素金属性递变规律。第三组:由原子结构入手,通过素材和实验,探究元素非金属性强弱递变规律。元素周期律的内容元素周期律的本质分组画出第二周期、第三周期元素的原子结构示意图:核外电子排布【问题1】观察第二周期元素的原子结构示意图:电子层数:,最外层电子数:观察第三周期元素的原子结构示意图:电子层数:,最外层电子数:结论:主要化合价【问题2】分析第三周期元素的原子结构示意图,从Na到Cl,元素的最高正化合价分别是:最低负化合价分别是:分析第二周期元素的化合价是否得到同样的结论?注意:【结论】:同周期元素,最高正价递变规律,最低负价递变规律为:由于学生没有接触过最高正化合价、最低负化合价的概念,在此需要铺垫总结完通性后引导学生注意到特性:即OF没有最高正价原子半径【问题3】根据原子结构示意图,猜测电子层数与原子半径的关系是,最外层电子数与原子半径的关系是:,根据所给材料,验证你的猜测是否正确?原子半径与原子结构的关系是:试比较K和Cl的半径:比较的方法是:你在这还有什么疑问吗?【结论】同周期元素的原子半径递变规律是:这是一个完整的科学探究示例,包括依据已有理论对问题做出猜测,寻找素材或实验事实验证猜测,得出结论。为后面金属性、非金属性的探究奠定了方法基础提供素材元素符号LiBeBCNOF原子半径(nm)0.1520.0890.0820.0770.0750.0740.071元素符号NaMgAlSiPSCl原子半径(nm)0.1860.1600.1430.1170.1100.1020.099随原子序数的递增,原子半径呈现周期性变化。【练习1】下列递变情况不正确的是:ANa、Mg、Al最外层电子数依次增多BP、S、Cl最高化合价依次升高。CNaK、Rb原子半径依次增大DC、N、O最高正化合价依次升高巩固练习同周期元素金属性递变规律推测:Na、Mg、Al金属性的强弱,从原子结构角度解释你的推论。哪些实验事实能证明你的推论:。分析这些实验是否可行?比较好的实验方案是:。【对比试验1】【对比试验2】思路依然为根据原子结构知识推测,并用原子结构知识解释推论,学生讨论举出验证金属性强弱的实验,此处如果学生有障碍,用现象揭示本质的思路进行点拨,提示同学们从现象入手。学生可能会考虑置换反应及金属和氧气的反应,评价这些方案是否可行,选择最优方案。基于高一学生实验常识较少,不易把握反应物的用量,在学生讨论后投影给出两组实验的具体方案,然后学生操作。【对比试验1】取两支试管,向一支试管中投入一段打磨过的镁条,另一试管中投入一片磨去了表面氧化膜的铝片,向两支试管中分别加入2毫升蒸馏水,滴入两滴酚酞,观察现象。将两支试管分别加热观察现象。【对比试验2】取两支试管,向其中一试管中投入一段除去表面氧化膜的镁条,另一试管中投入一小片除去了氧化膜的铝片,向两试管中分别加入2毫升1mol/L的盐酸,观察现象。实验过程中注意观察学生试管夹使用等基本操作是否正确NaMgAl与水或酸反应的现象与冷水反应:与冷水反应:与沸水反应:与盐酸反应:与冷水反应:与沸水反应:与盐酸反应:。最高氧化物对应水化物的碱性NaOH是碱Mg(OH)2为中强碱Al(OH)3是:结论:实验完成后,用图表分析实验现象,目的是突出现象即性质的差别【问题】根据表中事实,什么性质还能证明元素金属性的强弱?【总结】同周期元素从左到右,元素金属性依次。在周期表中,随原子序数的递增,元素的金属性呈现的变化。问题思考的目的是通过学生观察表中氢氧化钠、氢氧化镁、氢氧化铝的碱性递变规律,发现最高价氧化物对应水化物的碱性也能说明金属性的强弱。最后总结得出同周期元素金属性递变规律。【练习2】我国报道的高温超导体中,铊(Tl)是组成元素之一,已知铊和铝一样,最外层有3个电子,但铊比铝多三个电子层,关于铊的性质判断错误的是:A银白色质软金属B氢氧化铊是两性氢氧化物C能置换出盐酸中的氢D氢氧化铊的碱性比氢氧化铝强练习2是金属性强弱判断依据的练习。同周期元素非金属性的递变规律【问题探究5】卤族元素的非金属性递变规律是,从原子结构解释这种递变什么实验可以证明卤族元素非金属性的强弱?。推测:Si、P、S、Cl非金属性的强弱,从原子结构上解释你的推论。以复习卤族元素性质递变规律及实验事实,结合原子结构知识引导推测同周期元素非金属性递变规律。SiPSCl单质与H2反应的条件高温磷蒸气与氢气能反应加热光照或点燃时发生爆炸而化合氢化物的稳定性SiH4常温易自燃PH3常温易自燃H2S受热分解HCl高温仍稳定最高价氧化物对应的水化物酸性强弱H2SiO3弱酸H3PO4中强酸H2SO4强酸HClO4比硫酸酸性更强的酸通过提供素材,让学生验证对非金属性递变规律的猜测是否正确,同时明确能证明非金属性强弱的实验事实有哪些。【实验验证】设计最简单的实验验证你的推测:根据学生已有知识应该能想到置换反应,实验操作氯水和硫化钠溶液的反应。验证猜测是否正确。【总结】同周期元素从左到右,元素非金属性依次。在周期表中,随原子序数的递增,元素的非金属性呈现的变化。通过总结得出随原子序数的递增,元素非金属性呈现周期性变化的规律【练习3】(08江苏卷)下列排列顺序正确的是()①热稳定性:H2O>HF>H2S②原子半径:Na>Mg>O③酸性:H3PO4>H2SO4>HClO4④碱性:LiOH



















