








《高一化学必修一《化学实验安全》复习课件PPT下载》是由用户上传到老师板报网,本为文库资料,大小为733.48 KB,总共有41页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 41页
- 733.48 KB
- VIP模板
- pptx
- 数字产品不支持退货
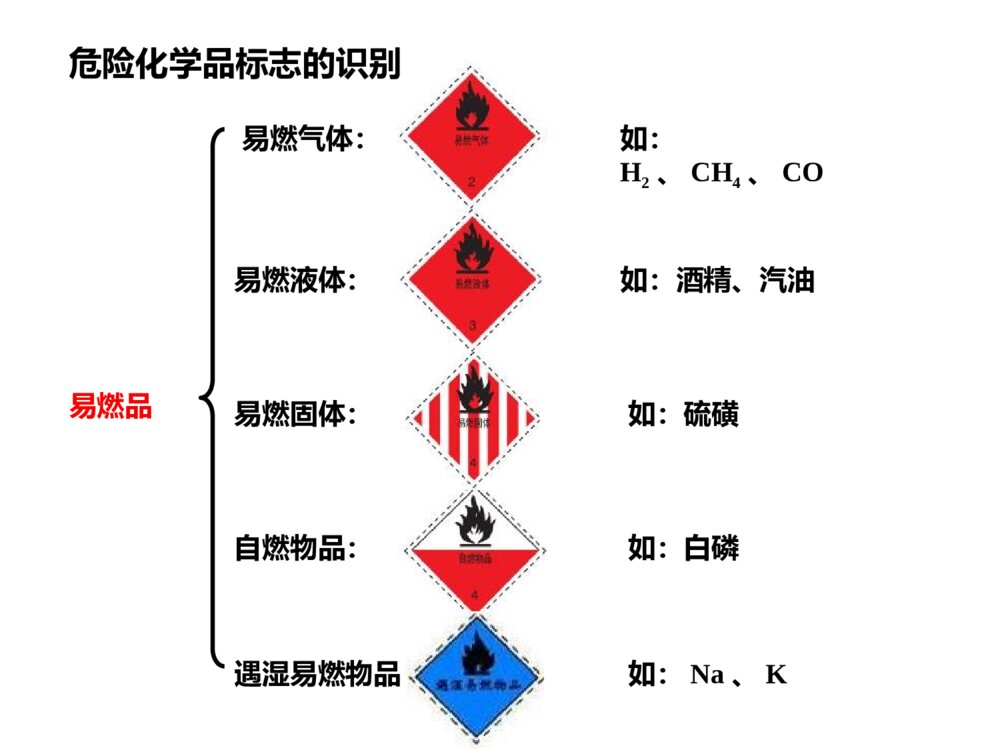
第一章复习课第一节化学实验基本方法第一课时化学实验安全一、化学实验安全1、遵守实验室规则2、了解安全措施3、掌握正确的操作方法4、重视并逐步熟悉污染物和废弃物的处理方法如:H2、CH4、CO如:酒精、汽油如:白磷如:Na、K易燃品危险化学品标志的识别自燃物品:遇湿易燃物品:易燃固体:如:硫磺易燃液体:易燃气体:腐蚀品:有毒品:氧化剂:如:浓硫酸、浓硝酸、NaOH固体如:砒霜As2O3、Hg、Pb如:KMnO4、KClO3、H2O2如:镁粉、黑火药等爆炸品:放射性物品:如:镭、铀第一节化学实验基本方法第二课时混合物的分离和提纯一:混合物提纯和分离方法知识回顾1.过滤过滤适用于:所需仪器有:装置组装和操作时应做到“一贴二低三靠”一贴:二低:三靠:分离固体和液体混合物时,除去液体中不溶性固体,即难溶物与可溶性物质的分离烧杯、漏斗、玻璃棒、滤纸、铁架台滤纸紧贴漏斗内壁滤纸边缘低于漏斗边缘,漏斗中的液面低于滤纸边缘烧杯紧靠玻璃棒,玻璃棒紧靠三层滤纸,漏斗的下端紧靠接收滤液的烧杯内壁。适用于可溶性固体溶质与溶剂的分离(1)蒸发皿的液体不超过容积的2/3(2)加热时,用玻璃棒不断搅拌(3)有较多溶质析出时,利用余热加热(4)取下未冷却的蒸发皿时,要放在石棉网上。2.蒸发步骤现象1.溶解2.过滤3.蒸发烧杯内为无色透明溶液,滤纸有残物有白色晶体析出粗盐溶解有少量不溶物操作步骤及现象:对于粗盐水(NaCl)要除去可溶杂质离子是:Ca2+Mg2+SO42-选择要加入的除杂试剂:Na2CO3NaOHBaCl2引入了新的离子:CO32-OH-Ba2+1、BaCl2过量的处理:加入Na2CO3BaCl2+Na2CO3=BaCO3↓+2NaCl2、Na2CO3、NaOH过量的处理:加入盐酸NaOH+HCl=NaCl+H2ONa2CO3+2HCl=2NaCl+H2O+CO2↑►1.BaCl2→NaOH→Na2CO3HCl►2.BaCl2→Na2CO3→NaOHHCl►3.NaOH→BaCl2→Na2CO3HCl加入除杂试剂的顺序可以是:1、只要Na2CO3加在BaCl2之后便合理2、加盐酸前必须过滤,弃去沉淀。最后加入的盐酸必须适量过滤过滤过滤[除杂原则]不增:不减:易分离:不增加入新的物质不减少被提纯的物质如:不能减少NaCl成分杂质转换为沉淀、气体等易分离除去如:将NaCl溶液中可能存在的Na2SO4转换为沉淀BaSO4例题:某KNO3溶液中含杂质KCl、K2SO4和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是()A.Ba(NO3)2、K2CO3、AgNO3、HNO3B.K2CO3、Ba(NO3)2、AgNO3、HNO3C.Ba(NO3)2、AgNO3、K2CO3、HNO3D.AgNO3、Ba(NO3)2、K2CO3、HNO3CD第一节化学实验基本方法第三课时蒸馏与萃取1、蒸馏利用液体混合物中各物质的沸点不同(一般来说沸点相差30℃以上),用加热的方法将沸点低的物质变成气态挥发而分离出来。温度计冷凝管牛角管蒸馏烧瓶[注意事项]①所盛液体不超过蒸馏瓶球部容积的1/3~2/3,加热时,不能将液体蒸干,需要垫石棉网。②温度计的水银球应位于蒸馏烧瓶的支管口处。③蒸馏瓶内要加几粒沸石或碎瓷片,防止液体暴沸。④冷凝管中通冷却水时,下口(),上口()。进水出水利用某物质在两种互不相溶的溶剂中溶解性的差别,使该物质从溶解度较小的溶剂转移到溶解度较大的溶剂中,这种方法叫萃取。2、萃取溶剂、溶质萃取剂萃取萃取剂、溶质原溶剂化学哲理:爱情好似萃取,一旦魅力不够,另一半很可能被拐走+3.分液分液是__________________________的操作。所用的主要仪器是:__________分液时________________________________分离两种互不相溶的液体混合物分液漏斗上层液体应从上口倒出,而下层液体应从下口放出【实验1-4】用CCl4萃取碘水(饱和)中的I2实验步骤:混液---振荡---静置---分液仪器:分液漏斗,带铁圈的铁架台,烧杯【注意事项】1、使用前检查上口和活塞是否漏水。2、加入萃取液后要先倒转分液漏斗用力振荡,再静置。每次振荡后,须放气,以减少分液漏斗内的气压。3、分液时,分液漏斗下端紧贴烧杯内壁。当分液漏斗内的下层液体恰好流尽时,立即关闭分液漏斗的活塞,防止上层液体流出。上层液体由上口倒出。实验现象:液体分层,上层液体显()色,下层液体显()色浅黄紫作为萃取剂的条件•1、萃取剂与原溶剂互不相溶;•2、溶质在萃取剂中的溶解度远远大于在原溶剂中的溶解度;•3、与溶质、溶剂均不反应;小结:混合物的分离和提纯分离、提纯方法适用范围分离的物质过滤不溶固体和液体的分离从液体中分离出不溶性固体蒸发可溶性固体和液体的分离从液体中分离出可溶性溶质蒸馏沸点不同的互溶液体混合物的分离分离沸点不同的互溶液体混合物萃取溶质在两种互不相溶的溶剂中溶解度不同把溶质提取到萃取剂中分液分离互不相溶、密度不同的液体混合物两种不互溶的液体实例粗盐提纯用海水制盐用海水制纯水、蒸酒从碘水中提取碘分离油和水练习1.对于混合物的分离和提纯,常采用的方法有①过滤②蒸发③蒸馏④萃取⑤分液⑥加热分解实验室中的石灰水久置,液面上常悬浮有碳酸钙微粒,可可采用________方法除去Ca(OH)2溶液中的CaCO3微粒.可用_________方法除去氧化钙中的碳酸钙可用________方法分离水和汽油的混合物,可用_________方法提取碘水中的碘,可用_______方法除去食盐溶液中的水,可用________方法从海水中获取淡水.可用__________方法分离四氯化碳(沸点76.75)℃和甲苯(沸点为110.6)℃的混合物.①②⑤④③⑥③小结:离子的检验离子试剂现象化学方程式SO42-Cl-CO32-加盐酸酸化后加入BaCl2溶液,产生白色沉淀Na2SO4+BaCl2=BaSO4↓+2NaCl盐酸澄清石灰水加入盐酸产生无色无味、使澄清石灰水变混浊的气体。Na2CO3+2HCl=2NaCl+H2O+CO2↑CO2+Ca(OH)2=CaCO3↓+H2O稀HNO3和AgNO3先加HCl再BaCl2出现白色沉淀NaCl+AgNO3=AgCl↓+NaNO3第二节计量在实验中的应用第一课时物质的量的单位——摩尔1.物质的量(n)是国际单位制中七个基本物理量之一,表示含有一定数目粒子的集合体。其单位是摩尔(mol)。2.阿伏加德罗常数是指0.012kg12C中所含有的碳原子数。其单位是每摩尔(mol-1)。3.摩尔质量(M)是单位物质的量的物质所具有的质量。其单位是g/mol4.物质的量浓度(CB)是用来表示单位体积溶液中所含溶质B的物质的量。其单位是mol/L5.气体摩尔体积是单位物质的量气体所占的体积。其单位是升每摩尔(L/mol)一、物质的量相关概念摩尔质量的数值=相对分子(原子)质量的数值数值:NA≈6.02×1023记住了吗♦物质的量与质量、摩尔质量之间存在什么关系?♦气体的物质的量与体积之间存在什么关系?♦物质的量与粒子数之间存在什么关系?♦溶质的物质的量与物质的量浓度及溶液体积之间存在什么关系?MmnmVVnANNnVnCBBMmnmVVnANNnVnCBB物质的粒子数N物质的量浓度C(mol/L)气体体积V(L)物质的量n(mol)物质的质量m(g)÷NA×NA×V÷M×M×Vm÷Vm÷V1.在标准状况时,含有2.408×1024个O原子的O2,所占有的体积是多少升?其质量为多少克?2.向36g镁加过量盐酸,反应完全后,可以得到多少摩尔的氢气,其在标准状况下的体积将是多少升?3.使在标准状况时体积为5.6L的HCl气体溶于500ml水,所得溶液的物质的量浓度是多少?练一练44.8L64g1.5mol33.6L0.5mol/L试试看标准状况下11.2LHCl气体的物质的量是多少?质量是多少?含有多少个HCl分子?将其溶于水制成1L稀盐酸,此溶液的物质的量浓度是多少?这种溶液中含多少个离子?取这种溶液100mL加水稀释到500mL,稀释后盐酸溶液的物质的量浓度为多少?解:()()11.20.522.4HClHClmLmolLLVnmolV()()()0.536.5/18.25HClHClHClmolgmolngmM()()[()]0.50.51HClHClHClaqnCVmolmolLL因为HClHCl所以溶液中含离子数为6.01×1023个123(3))2(0.56.0210mol3.0110HClHClANnmNol()()[()[][()]()]0.5/0.10.1\'0\'\'\'.5HClHClHClHHClClaqqaCVmolLLmolLVnLCV取=()()11.20.522.4HClHClmLmolLLVnmolV()()()0.536.5/18.25HClHClHClmolgmolngmM()()[()]0.50.51HClHClHClaqnCVmolmolLLHClHCl123(3))2(0.56.0210mol3.0110HClHClANnmNol()()[()[][()]()]0.5/0.10.1\'0\'\'\'.5HClHClHClHHClClaqqaCVmolLLmolLVnLCV取=二、决定物质体积大小的因素:(1)粒子大小(2)粒子数目(3)粒子之间的距离液体、固体体积气体体积主要决定于温度和压强决定三、阿伏伽德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。四同:同温——同压——同体积——同物质的量TPVn阿伏加德罗定律:(1)同温同压下,V1/V2=n1/n2(2)同温同压下,M1/M2=ρ1/ρ2(3)同温同压同体积时,m1/m2=M1/M2(4)同温同压等质量时,V1/V2=M2/M1(5)同温同体积时,p1/p2=n1/n2三、定物质的量浓度溶液的配制用固体直接配制用浓溶液稀释为稀溶液①计算②量取③稀释④转液⑤洗涤振荡⑥定容⑦摇匀⑧装瓶①计算②称量③溶解④转液⑤洗涤振荡⑥定容⑦摇匀⑧装瓶主要仪器:容量瓶2.特点:①容量瓶上标有温度和容积②容量瓶上有刻线而无刻度3.常用规格:100ml,250ml,500ml,1000ml1.构造:细颈、平底玻璃瓶,瓶口配有磨口玻璃塞【练习】欲配制1mol/L的氢氧化钠溶液250mL,完成下列步骤:①用天平称取氢氧化钠固体克。②将称好的氢氧化钠固体放入中加少量蒸馏水将其溶解,待________后将溶液沿____移入____mL的容量瓶中。③用少量蒸馏水洗涤烧杯和玻璃棒次,并将洗液移入容量瓶中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏(高或低)。10烧杯冷却玻璃棒2502~3低④向容量瓶内加水至刻度线____时,改用__小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏。⑤最后盖好瓶盖,,将配好的溶液移入试剂瓶中并贴好标签。1~2厘米胶头滴管低摇匀溶液配制的误差分析1.天平的砝码上沾有其他物质或已生锈( )3.量取液体溶质时,俯视读数()4.定容时俯视刻度线( )5.所配溶液未冷却至室温即转入容量瓶定容( )偏高偏高偏高偏低下列操作对溶液浓度造成的误差是分析的关键:从n和V入手若n偏大,则浓度偏高;反之,则偏低。若V偏大,则浓度偏低;反之,则偏高。C=—Vn=——mMV5.转移溶液时不洗涤烧杯或未将洗涤液转入容量瓶( ) 6.溶解、转移、洗涤时有溶液流出容器外,使溶质减小( )7.容量瓶在使用前,用蒸馏水洗净,在瓶内有少量水残留( )8.定匀摇匀后,静止时发现液面低于刻度线,再加水到刻度线( )9.定容时加水过量越过刻度线,又取出部分溶液,使液面降至刻度线( )偏低偏低偏低偏低无影响物质的量浓度与质量分数的换算:CB=1000×ρ×ωMBρ的单位:g/cm3浓溶液的稀释c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液)练一练:1.将20mL物质的量浓度为0.5mol/L的NaOH溶液加480mL水稀释,求稀释后所得溶液的物质的量浓度。2、将500mL物质的量浓度为0.10mol/L的KNO3溶液蒸发到200mL后(未有晶体析出),求所得溶液中KNO3的物质的量浓度。0.02mol/L0.25mol/L



















