





《化学反应与能量PPT课件下载(共31页)》是由用户上传到老师板报网,本为文库资料,大小为1.42 MB,总共有28页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 28页
- 1.42 MB
- VIP模板
- ppt
- 数字产品不支持退货
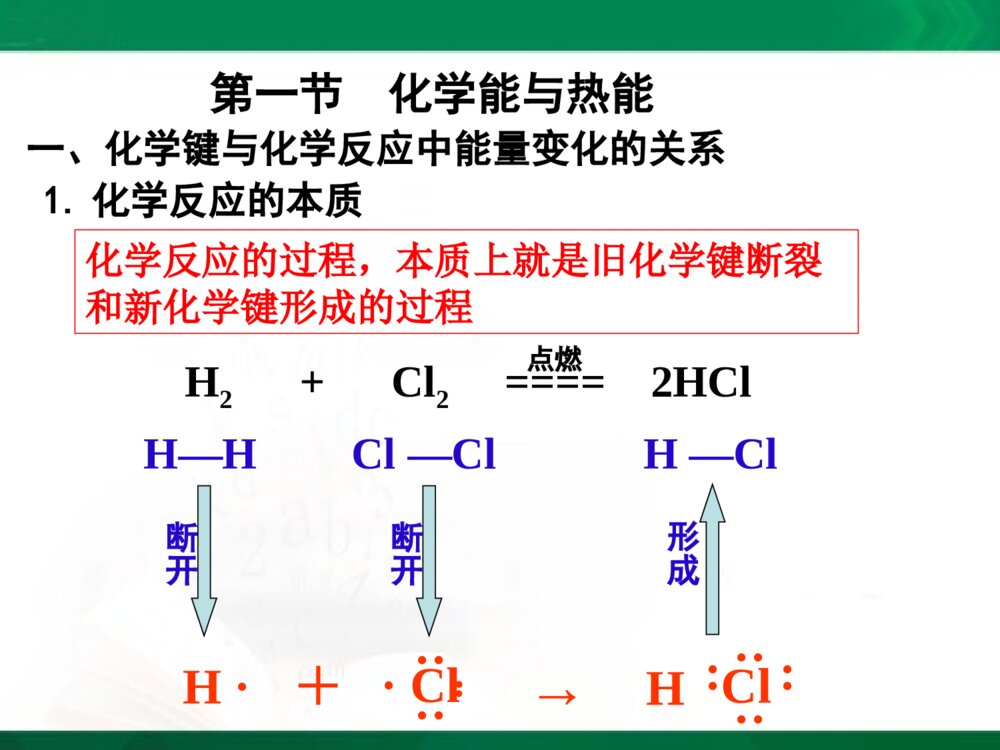
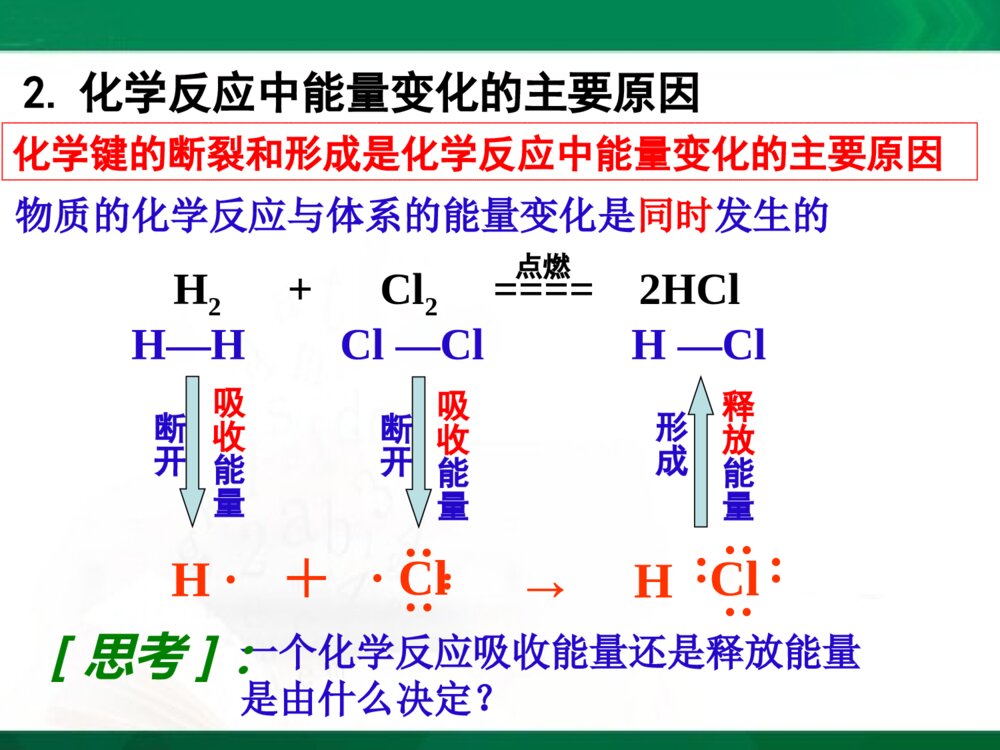
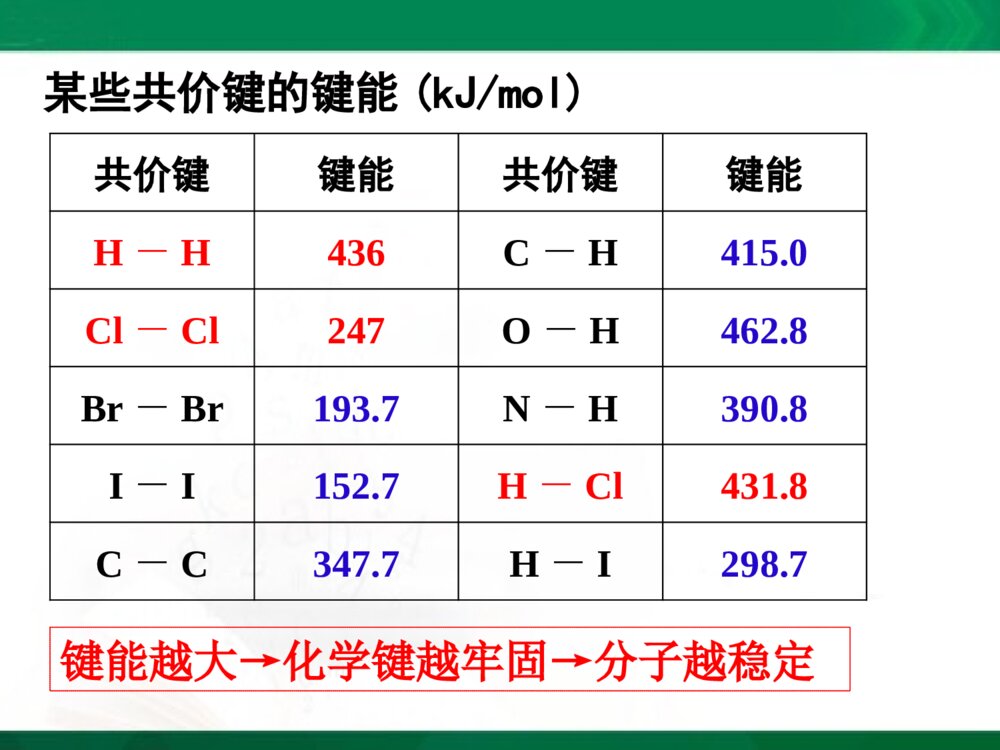
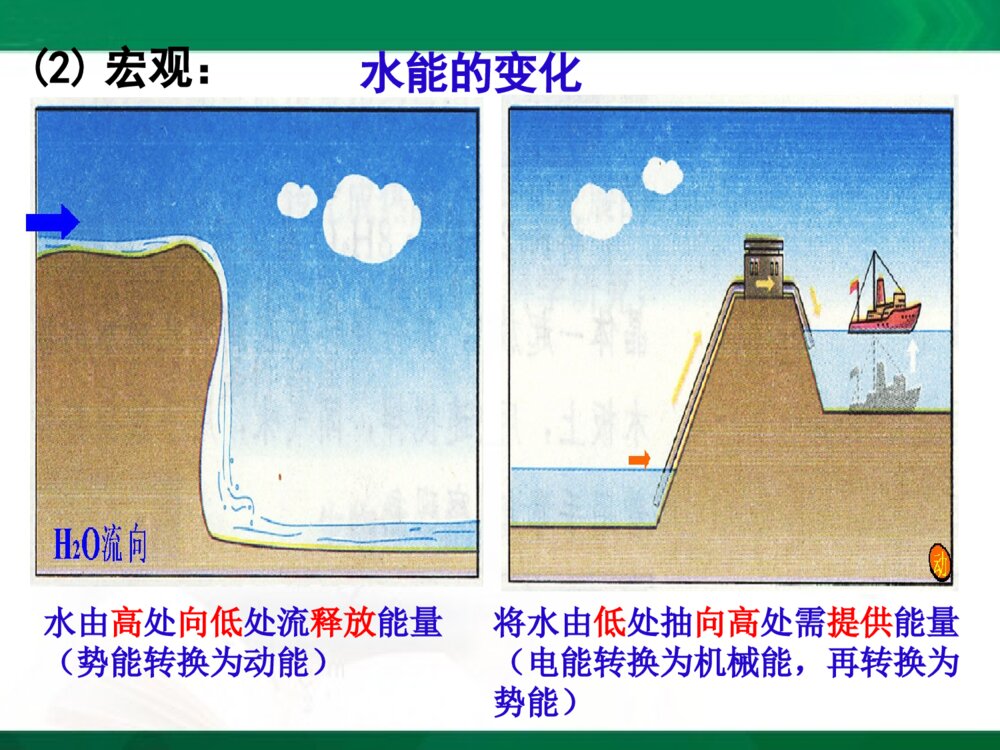
[2023729年月日]第一课时实验:盐酸和铝片反应现象:有气泡产生,试管外壁温度升高化学反应方程式:必修2P34实验2-12Al+6HCl====2AlCl3+3H2↑实验:Ba(OH)2·8H2O和NH4Cl反应现象:有刺激性气味的气体产生,烧杯外壁温度降低化学反应方程式:224232()82210BaOHHONHClBaClNHHO结论:化学反应不仅有物质的变化,也有能量的变化必修2P34实验2-2第一节化学能与热能一、化学键与化学反应中能量变化的关系化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程1.化学反应的本质H····Cl··:+→Cl····H····H—HCl—Cl断开H2+Cl2====2HCl点燃形成H—Cl断开化学键的断裂和形成是化学反应中能量变化的主要原因2.化学反应中能量变化的主要原因H····Cl··:+→Cl····H····H—HCl—Cl吸收能量断开H2+Cl2====2HCl点燃H—Cl吸收能量断开形成释放能量物质的化学反应与体系的能量变化是同时发生的一个化学反应吸收能量还是释放能量是由什么决定?[思考]:3.决定化学反应吸收能量还是放出能量的因素取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小在25,101KPa℃条件下,断开1molH-H键要吸收436kJ的能量,而由H原子形成1molH-H键要放出436kJ的能量,这个能量就是H-H的键能键能(1)微观键能一般是用来衡量共价化合物中键的强弱键能定义:在101.3kPa,298K条件下,断开1molAB过程中的能量变化,称为A-B键的键能。某些共价键的键能(kJ/mol)共价键键能共价键键能H-H436C-H415.0Cl-Cl247O-H462.8Br-Br193.7N-H390.8I-I152.7H-Cl431.8C-C347.7H-I298.7键能越大→化学键越牢固→分子越稳定已知H-H:键能为436kJ/mol,Cl-Cl:键能为247kJ/mol,H-Cl:键能为431kJ/mol,则反应H2+Cl2=2HCl是吸收能量还是释放能量?(1)化学键断裂时要吸收能量,吸收的总能量为:Q吸=436kJ+247kJ=683kJ(2)化学键形成时要释放能量,释放的总能量为:Q放=431kJ×2=862kJ(3)反应中能量的变化——释放能量:ΔQ=Q吸—Q放=862kJ—683kJ=179kJ(2)宏观:水由高处向低处流释放能量(势能转换为动能)将水由低处抽向高处需提供能量(电能转换为机械能,再转换为势能)水能的变化反应物的总能量<生成物的总能量化学反应吸收能量反应物的总能量>生成物的总能量化学反应释放能量化学能的变化取决于反应物的总能量与生成物的总能量的相对大小二、化学能与热能的相互转化1.两条基本的自然定律(1)质量守恒定律(2)能量守恒定律一种形式的能量可以转化为另一种形式的能量,总能量保持不变化学能是能量的一种形式,可以转化为其他形式的能量,如热能和电能等2.化学反应中的能量变化通常主要表现为热量的变化——吸热或放热放出热量的化学反应吸收热量的化学反应(1)放热反应:(2)吸热反应:常见的放热反应和吸热反应放热反应物质与氧气的反应燃烧中和反应金属与酸反应活泼金属与水的反应生石灰和水反应大部分化合反应吸热反应C+CO2C+H2OH2+CuOBa(OH)2·8H2O+NH4ClFe+H2O(g)Na2CO3·10H2O+NH4NO3大部分分解反应电离1、物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。2、化学键的断裂和形成是化学反应中能量变化的主要原因。3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小(宏观)。4、化学反应中能量转化遵循能量守衡原则。【小结】小结:能量公式化E(反应物)=E(生成物)+ΔQ(能量守恒定律)E(反应物)-E(生成物)=ΔQΔQ>0为放热反应ΔQ<0为吸热反应1、当物质发生化学反应时,断开反应物中的化学键要;而形成生成物中的化学键要。一个化学反应是释放能量还是吸收能量取决于。吸收能量放出能量反应物总能量与生成物总能量的相对大小课堂练习:2、若反应物的总能量>生成物的总能量,化学反应能量。若反应物的总能量<生成物的总能量,化学反应能量。放出吸收3已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是()A.A的能量一定高于CB.B的能量一定高于DC.A和B的总能量一定高于C和D的总能量D.该反应为放热反应,故不必加热就一定能发生C4、氢气在氧气中燃烧产生蓝色火焰,在反应中,破坏1molH-H键消耗的能量为Q1kJ,破坏1molO=O键消耗的能量为Q2kJ,形成1molH-O键释放的能量为Q3kJ。下列关系式中正确的是()A.2Q1+Q2>4Q3B.2Q1+Q2<4Q3C.Q1+Q2



















