






《环境化学《第四章 土壤环境化学》教学PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为1.78 MB,总共有101页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 101页
- 1.78 MB
- VIP模板
- ppt
- 数字产品不支持退货
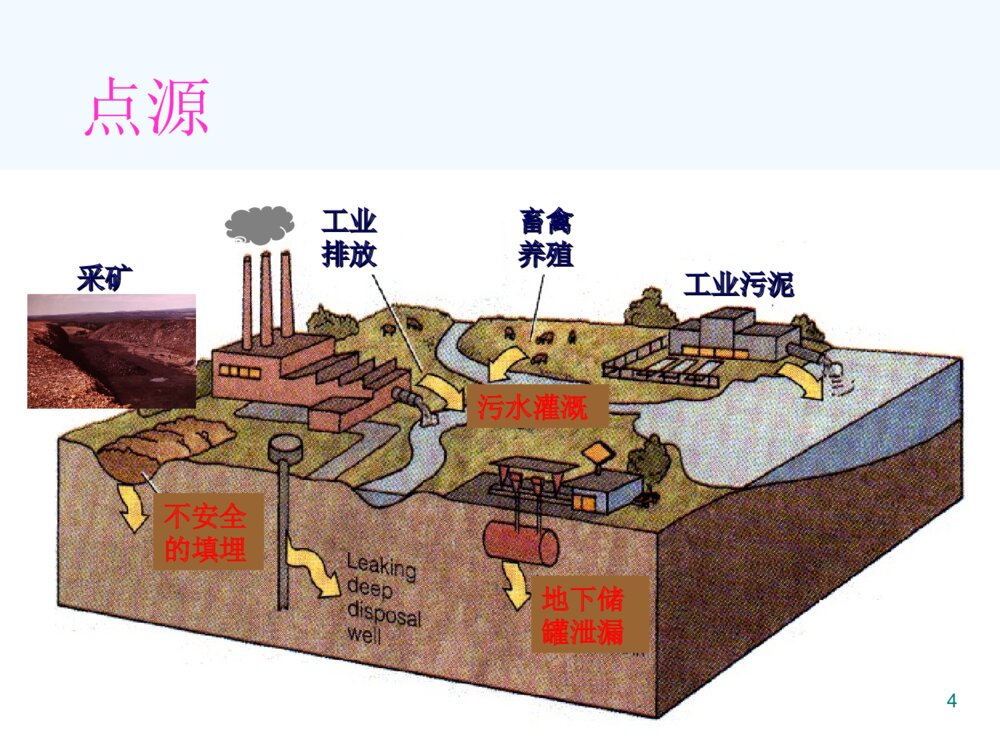
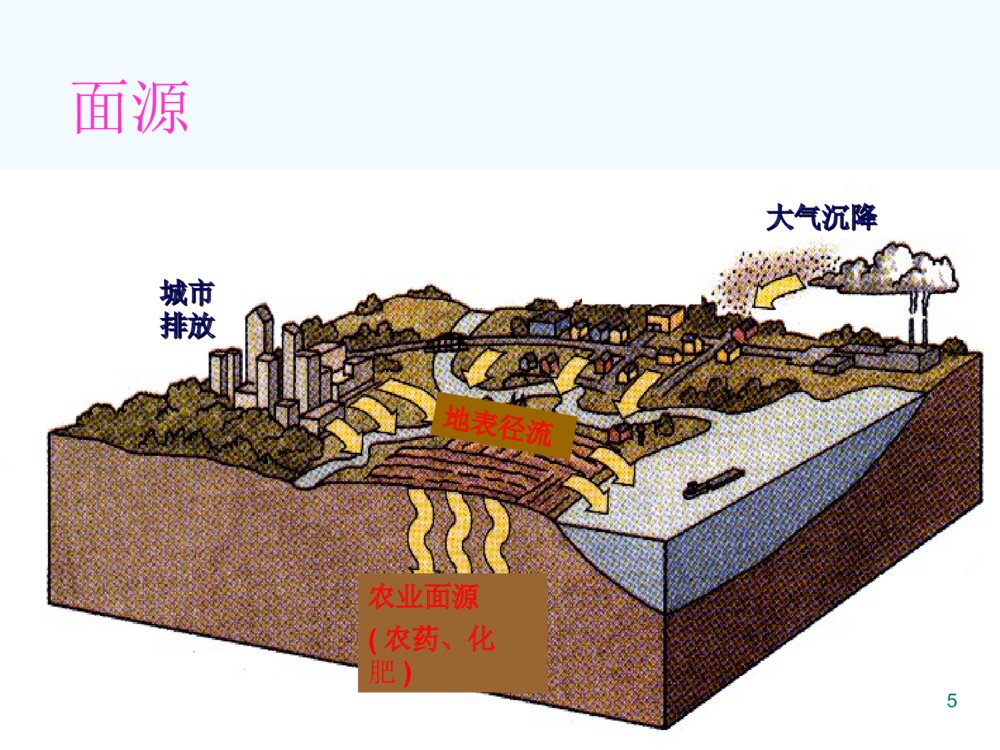
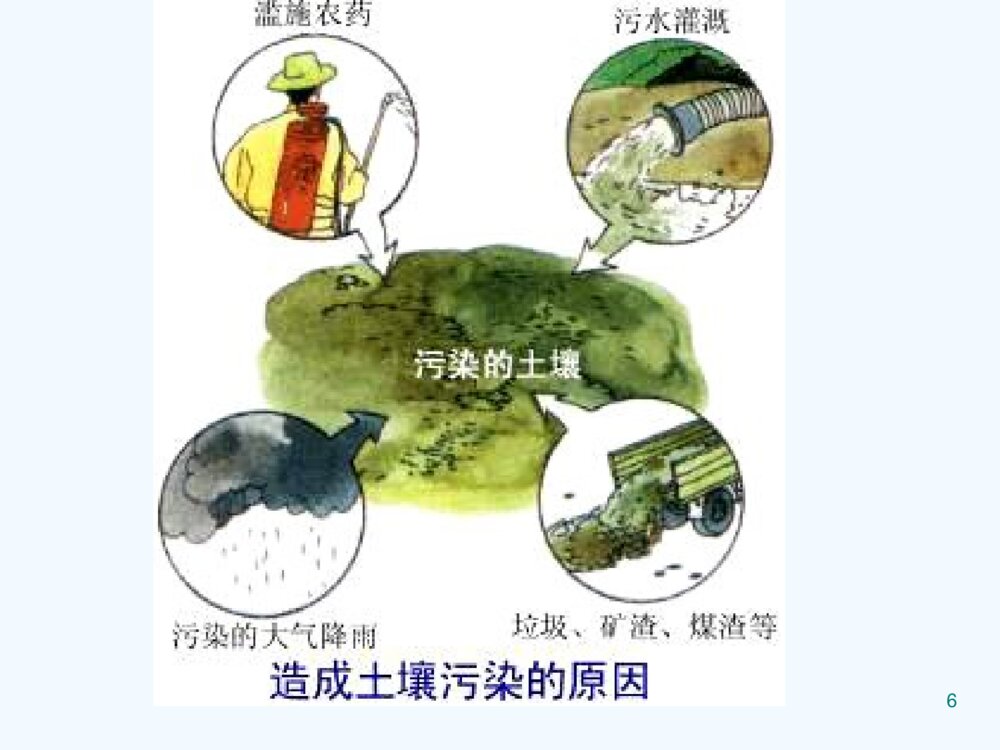
第四章土壤环境化学(SoilEnvironmentalChemistry)1大气圈土壤圈岩石圈水圈生物圈蒸发元素循环土壤植物和动物土壤水能量交换气体散发土壤形成淋洗土壤圈与大气圈、生物圈、水圈和岩石圈之间的物质和能量交换2重金属西欧:100多万个点位重金属污染我国:2000多万hm2土壤污染1200万吨污染粮食/年有机污染物PAHs、PCB、农药、石油烃、有机洗涤剂、酚类化合物3点源工业工业排放排放畜禽畜禽养殖养殖工业污泥工业污泥不安全的填埋地下储罐泄漏采矿采矿污水灌溉4面源城市城市排放排放大气沉降大气沉降农业面源(农药、化肥)地表径流56本章重点:1、土壤的组成与性质;2、污染物质在土壤—植物体系中的迁移和它的作用机制;3、主要农药在土壤中的迁移、转化和归趋。7土壤的两个重要的功能:1.具有支持植物和微生物生长繁殖的能力。2.具有同化和代谢外界进入土壤的物质能力。8全球范围的土壤环境问题(EnvironmentalProbleminSoil)1.土壤酸化、盐碱化、土壤污染2.土壤沙漠化(石漠化)3.陆地植被破坏4.水土流失94.1土壤的组成和性质4.1.1土壤组成(SoilConstitution) 固相(土壤矿物质、土壤有机质) 液相(水分及水溶物) 气相(空气)10土壤中固、液、气相结构图111.土壤气体(AtmosphereinSoil)特性:(1)不连续性,存在于土粒间隙之间;(2)湿度更高;(3)O2少,CO2多,有机质腐烂分解; 大气土壤O221%(v/v)15%CO20.03%0.15-0.65%(4)有还原性气体(H2S、NH3、H2、CH4)、厌氧细菌和污染物等存在。122.土壤溶液(WaterinSoil)土壤溶液的意义: 土壤水分既是植物营养物的来源,也是污染物向其他圈层迁移的媒介。131)土壤水 包括气态水,固态水和液态水 土壤水气态水—存在于土壤空气中的水汽固态水液态水化学结合水土壤水冻结形成的冰吸附(束缚)水吸湿水膜状水自由水毛细管水重力水地下水142)土壤溶质包括(1)可溶性气体(2)无机盐类离子(3)无机胶体(4)可溶性有机物(5)配合物153.土壤矿物质(MineralsinSoil)土壤矿物质是岩石经过物理风化和化学风化形成的。按成因类型分类:原生矿物次生矿物各种岩石受到程度不同的物理风化而未经化学风化的碎屑物,其原来的化学组成和结晶构造都没有改变。大多数是由原生矿物经化学风化后形成的新矿物,其化学组成和晶体结构都有所改变。161)原生矿物(1)硅酸盐矿物:常见长石类、云母类、辉百石类和角闪石等,大都不很稳定比较容易风化而释放出钠、钾、钙、镁、铁等元素,同时形成次生矿物。(80%)(2)氧化物类矿物:包括石英(SiO2)、赤铁矿(Fe2O3)、金红石(TiO2)等,相当稳定,不易风化。石英是土壤中分布最广的一种矿物力砂粒的主要成分。(3)硫化物类矿物:在土壤中通常只有铁的硫化物矿物,即黄铁矿和白铁矿。二者是同质异构物,分子式均为FeS2。极易风化,成为土壤中硫的主要来源。(4)磷酸盐类矿物:土壤中分布最广的是磷灰石,包括氟磷灰石[Ca5(PO4)3F]和氯磷灰石[Ca(PO4)3Cl]两种,是土壤中无机磷的重要来源。172)次生矿物:(1)简单盐类:属水溶性盐,易淋溶流失,一般土壤中较少,多存在于盐渍土中。如方解石(CaCO3)、白云石[Ca、Mg(CO3)2]、石膏(CaSO4·2H2O)、泻盐(MgSO4·7H2O)、芒硝(Na2SO4·10H2O)、水氯镁石(MgC12·6H2O)等。是原生矿物经化学风化后的最终产物,结晶构造也较简单,常见于干旱和半干旱地区的土壤中。(2)三氧化物类:土壤矿物质中最细小部分,粒径小于0.25µm,称之为次生粘土矿物。如针铁矿(Fe2O3·H2O)、褐铁矿(2Fe2O3·3H2O)、三水铝石(A12O3·3H2O),是硅酸盐矿物彻底风化后产物,结晶构造较简单,常见于湿热的热带和亚热带地区土壤中。(3)次生铝硅酸盐类:土壤矿物质中细小部分,粒径小于0.25µm。土壤很多重要物理、化学过程和性质都和次生铝硅酸盐种类和数量有关。这类矿物在土壤中普遍存在,种类很多,是由长石等原生硅酸盐矿物风化后形成。是构成土壤的主要成分,故又称为粘土矿物。由于母岩和环境条件的不同,使岩石风化处在不同的阶段。18伊利石(或水云母)[(OH)4Ky(Al4·Fe4·Mg4·Mg6)(Si8-y·Aly)O20]风化程度较低,一般土壤中均有分布,但以温带干旱地区土壤中含量最多。其颗粒直径小于2µm,膨胀性较小,具有较高的阳离子代换量,并富含钾(K2O4%~7%)。蒙脱石[A14SiO20(OH)4]为伊利石迸一步风化产物,是基性岩在碱性环境条件下形成的,在温带干旱地区的土壤中含量较高。其颗粒直径小于1µm,阳离子代换量极高。所吸收的水分植物难以利用,富含蒙脱石土壤,植物易感水分缺乏。高岭石194.土壤有机质(SoilOrganicMatter,SOM) 土壤有机质是土壤形成的主要标志,土壤肥力的表现,土壤中含碳有机物的总称。活体 (根系、土壤中的生物) 细菌、藻类和原生动物等 非腐殖质非活体 腐殖质204.1.2土壤的粒级分组(SizeClassificationofMineralsinSoil) 不同粒径的土壤矿物质颗粒(即土粒),其性质和成分都不一样。 人们常按粒径的大小将土粒分为若干组,称为粒组或粒级,同组土粒的成分和性质基本一致,组间则有明显差异。2122234.1.3土壤的性质(QualityClassificationofSoilandCharacteristic) 由不同的粒级混合在一起所表现出来的土壤粗细状况,称为土壤质地(或土壤机械组成)。241.土壤的吸附性(SoilAdsorption)1)土壤胶体的性质(直径1-100nm)(1)大的比表面积和表面能比表面积:单位重量(或体积)物质的表面积。 一定体积的物质被分割时,随着颗粒数的增多,比表面也显著地增大。25蒙脱石比表面积最大(600-800m2/g)高岭石最小(7-30m2/g)有机胶体比表面积也大(~700m2/g)26 胶体表面分子与内部分子所处的状态不同,受到内外部两种不同的引力,因而具有多余的自由能即表面能,这是土壤胶体具有吸附作用的主要原因。 比表面积愈大,表面能愈大,胶体的吸附性愈强。27(2)表面带有电荷(ColloidsofSoil) 土壤胶体微粒内部一般带负电荷,形成一个负离子层(决定电位离子层),其外部由于电性吸引而形成一个正离子层(反离子层或扩散层),即合称双电层。①永久电荷:由黏土矿物晶格中的同晶置换所产生的电荷。②可变电荷:指土壤胶体表面电荷,其数量和性质会随着介质pH值的改变而改变。28(3)凝聚性和分散性 由于胶体的比表面和表面能都很大,为减小表面能,胶体具有相互吸引、凝聚的趋势,这就是胶体的凝聚性。 由于土壤胶体微粒带负电荷,胶体粒子相互排斥,具有分散性,负电荷越多,负的电动电位越高,相互排斥力越强,分散性也越强;29土壤胶体的凝聚性主要取决于其电动电位的大小和扩散层的厚度;此外,土壤溶液中的电解质和pH值也有影响。阳离子对带负电荷的土壤胶体的凝聚能力随离子的价数增加、半径增大而增强,常见阳离子凝聚力的强弱顺序:33224FeAlCaMgHNHKNa302)土壤胶体的离子交换吸附离子交换(或代换):土壤胶体扩散层中的补偿离子,可以和溶液中相同电荷的离子以离子价为依据作等价交换。离子交换作用包括阳离子交换吸附和阴离子交换吸附。31(1)土壤胶体的阳离子交换吸附(可逆过程)(CationExchangeAdsorption)NaCaCaNa2222-土壤胶体土壤胶体土壤胶体阳离子交换吸附过程以离子价为依据进行等价交换,且受质量作用定律支配。32影响阳离子交换吸附的因素:阳离子(电荷数,离子半径,水化程度)土壤(胶体,颗粒,SiO2/R2O3、pH等)33可交换性阳离子致酸离子(Al3+、H+)盐基离子(Ca2+、Mg2+、K+、Na+、NH4+等)34盐基饱和土壤:土壤胶体吸附的阳离子全部是盐基阳离子时,这种土壤称为盐基饱和土壤。%100%阳离子交换量可交换性盐基总量)盐基饱和度(35阳离子交换量(CationExchangeCapacity,CEC)CEC表示每千克干土中所含全部阳离子的总量,是表示土壤吸附性质的重要指标。单位:厘摩尔/每千克土(cmol/kg)测定:用Ca2+作指示剂,Ba2+作萃取剂,原子吸收分光光度法测定。36不同土壤的阳离子交换量不同:(1)不同种类的胶体的阳离子交换量顺序有机胶体>蒙脱石>水化云母>高岭土>水合氧化铁、铝(2)土壤质地越细,阳离子交换量越高;(3)土壤胶体中SiO2/R2O3比值越大,阳离子交换量越高;(4)pH值下降,阳离子交换量降低。37(2)土壤胶体的阴离子交换吸附带正电荷的胶体吸附的阴离子与土壤溶液中的阴离子交换。吸附顺序:F->C2O42->柠檬酸根>PO43->HCO3->H2BO3->Ac->SCN->SO42->Cl->NO3-382.土壤的酸碱性(Acidity-AlkalinityofSoil)1)土壤的酸度(AcidityofSoil)根据土壤中H+存在的形式:活性酸度(或有效酸度)(ActivityAcidity)土壤溶液中氢离子浓度的直接反映出来的酸度,通常用pH表示(通常描述土壤性质时表示作土壤pH值)潜性酸度(PotentialAcidity)是由土壤胶体吸附的可代换性H+、Al3+离子造成的。交换性酸度水解性酸度39交换性酸度用过量中性盐(KCl、NaCl等)溶液淋洗土壤,溶液中金属离子与土壤中H+、Al3+发生离子交换作用:|土壤胶体|-H++KCl→|土壤胶体|-K++HCl40|土壤胶体|-Al3++3KCl→|土壤胶体|-3K++AlCl3AlCl3+H2O→Al(OH)3+3HCl水解性酸度用弱酸强碱盐淋洗土壤,溶液中金属离子可将土壤胶体吸附的H+、Al3+离子代换出来,同时生成弱酸(醋酸),此时所测定出的该弱酸的酸度称水解性酸度。41(NaAc+H2O→HAc+Na++OH-)交换性酸度只是水解性酸度的一部分,因此水解性酸度高于交换性酸度。42|土壤胶体|-Al3+、H++4NaAc→|土壤胶体|-4Na++Al(OH)3+4HAc活性酸度和潜性酸度二者的关系:*活性酸度与潜性酸度是存在于同一平衡体系的两种酸度,二者可以相互转换,一定条件下可处于暂时平衡。*活性酸度是土壤酸度的现实表现,土壤胶体是H+Al3+的储存库,因此潜性酸度是活性酸度的储备。432)土壤的碱度(AlkalinityofSoil)土壤溶液中的OH-离子,主要来源于碱金属和碱土金属的碳酸盐类,即碳酸盐碱度和重碳酸盐碱度的总量称为总碱度,可用滴定法测定。44不同溶解度的碳酸盐和重碳酸盐对碱度的贡献不同:CaCO3、MgCO3难溶,石灰性土壤pH7.5-8.5,45Na2CO3pH>10,NaHCO3、Ca(HCO3)2pH7.5-8.5土壤胶体上吸附阳离子(Na+、K+、Mg2+)的饱和度增加,可引起交换性阳离子的水解作用:土壤胶体|-xNa++yH2O→土壤胶体|-(x-y)Na+、yH++yNaOH结果在土壤溶液中产生NaOH,使土壤呈碱性。463)土壤的缓冲性能(BufferActionofSoil)土壤溶液中含有碳酸、硅酸、磷酸、腐殖酸和其它有机酸及其盐类,构成很好的缓冲体系。47有机酸的缓冲作用(BufferActionofOrganicAcid)48NH2NH3ClR-CH+HClR-CHCOOHCOOHNH2NH2R-CH+NaOHR-CH+H2OCOOHCOONa土壤胶体的缓冲作用(BufferActionofColloidsofSoil)土壤胶体中存在有代换性阳离子土壤胶体|-M++HCl→土壤胶体|-H++MCl(缓冲酸)土壤胶体|-H++MCl→土壤胶体|-M++HCl(缓冲碱)49土壤胶体的数量和盐基代换量越大,土壤的缓冲能力越强;代换量相当时,盐基饱和度越高,土壤对酸的缓冲能力越大;反之,盐基饱和度减小,土壤对碱的缓冲能力增加。50铝离子对碱的缓冲作用OHOHOHAIOHOHAI2482223624])()([2])([2Al对土壤的危害:三价Al与土壤胶体结合能力强,易排挤其它阳离子使其进入土壤溶液而遭受淋溶损失;研究表明,土壤对植物的酸害实际是铝害,过多的铝离子抑制植物生长。513.土壤的氧化还原性(OxidationandReductionofSoil)土壤氧化还原能力的大小可以用土壤的氧化还原电位(Eh)来衡量。氧化还原反应是土壤中无机物和有机物发生迁移转化并对土壤生态系统产生重要影响的化学过程。52主要氧化剂:氧气、NO3-离子和高价金属离子,如Fe(III)、Mn(IV)、V(V)、Ti(IV)等。主要还原剂:有机质和低价金属离子。此外,土壤中植物的根系和土壤生物也是土壤发生氧化还原反应的重要参与者。主要氧化还原体系如下:铁体系Fe(III)-Fe(II),锰体系Mn(IV)-Mn(II),硫体系SO42—H2S氮体系NO3—(NO2-、N2、NH4+)。碳体系CO2-CH4土壤氧化还原能力的大小可以用土壤的氧化还原电位(Eh)来衡量,其值是以氧化态物质与还原态物质的相对浓度比为依据的。由于土壤中氧化态物质与还原态物质的组成十分复杂,因此计算土壤的实际氧化还原电位(Eh)很困难。主要以实际测量的土壤氧化还原电位(Eh)衡量土壤的氧化还原性.53一般旱地土壤的氧化还原电位(Eh)为+400—+700mV;水田的Eh值在+300—-200mV。根据土壤的Eh值可以确定土壤中有机物和无机物可能发生的氧化还原反应和环境行为。当土壤的Eh值>700mV时,土壤完全处于氧化条件下,有机物质会迅速分解;当Eh值在400—700mV时,土壤中氮素主要以NO3-形式存在;当Eh值<400mV时,反硝化开始发生;当Eh<200mV时,NO3-开始消失,出现大量的NH4+。当土壤渍水时,Eh值降至-l00mV,,Fe2+浓度已经超过Fe3+;Eh值再降低,<-200mV时,H2S大量产生,Fe2+就会变成FeS沉淀了,其迁移能力降低了。54影响土壤氧化还原作用的主要因素:①土壤通气性②土壤无机物的含量③易分解有机质的含量④土壤的pH值⑤植物根系的代谢作用⑥微生物活动554.土壤的配合和螯合作用土壤中的有机和无机配体能与金属离子发生配合或螯合作用,从而影响金属离子在环境中的迁移、转化等物理化学行为.564.2污染物在土壤中的迁移转化4.2.1土壤污染物①化学污染物②物理污染物③生物污染物④放射性污染物等特点:①隐蔽性②滞后性③累积性④不可逆转性⑤治理难度大574.2.2土壤的化学肥料污染及氮磷的迁移转化1.氮污染及其迁移转化1)氮污染2)土壤中氮的来源大气(生物固氮)人类的活动(肥料的制造、燃料的燃烧、增加豆科植物的耕种等)30~40%。大气中的自然雷电现象(使氮、氧转化成氮氧化物,最后随雨水带入土中,成为土壤中氮的经常来源之一)人为源(化肥及有机肥(包括粪肥、堆肥、绿肥等)的施用,死亡的动植物的生物降解产物也是有机氮的主要来源。)583)土壤中氮的形态有机氮(90%以上),氮绝大多数是以有机氮贮存而以无机氮被植物吸收。无机氮土壤中无机氮主要是铵态氮(NH4+)和硝态氮(NO3-),是植物摄取的主要形态。①铵态氮是由土壤有机质通过微生物的铵化作用而生成,能被带负电荷的土壤胶体所吸附,成为交换性离子,也不易流失,在水田中比较稳定而有可能积累。②硝态氮能直接被植物吸收,由于是阴离子,不能被土壤吸附而易流失③亚硝态氮、N2O、NO、NO2等在土壤中停留时间短,只是在特殊条件下作为微生物转化氮的中间物而存在,如硝化、反硝化过程及硝酸盐还原④量不大且化学上不稳定仅以过渡态存在,如NH2OH59有机氮土壤中的有机态氮可按其溶解度大小及水解难易分为三类。水溶性有机态氮(游离氨基酸、胺盐及酰胺类化合物,一般≤5%,)这类有机氮化合物不能直接被植物吸收,但很容易水解放出NH4+,植物的速效性氮源。水解性有机态氮(用酸、碱或酶处理时,能水解成为简单的易溶性化合物或直接生成铵化合物的有机态氮,水溶性有机态氮也包括在本类,约50~70%)非水解性有机态氮(既非水溶也不能用一般的酸碱处理来促使其水解,主要包括杂环氮化合物、糖类和铵类的缩合物以及铵或蛋白质和木质素类物质作用而成的复杂环状结构物质30~50%左右)604)氮在土壤中的迁移转化(1)土壤无机氮的微生物固持和有机氮的矿化(2)硝化作用氨在有氧条件下,通过微生物作用,氧化为硝酸盐的过程,硝化过程可逐渐形成亚硝酸盐和硝酸盐;2NH3+3O2=2H++2NO2-+2H2O+能量(亚硝酸盐)2NO2-+O2=2NO3-+能量(硝酸盐)(3)反硝化作用(生物的化学的)61生物反硝化作用:影响因素:水分含量、土壤有效氮含量,土壤有机质及土壤PH值等。化学反硝化作用:62(4)铵的矿物固定和释放在厌氧条件下,从牧场废物降解产生的氮多数以NH4+形式存在,NH4+与土壤的结合很强,只有小部分是以非交换的NH4+被固定在黏土矿物的晶格内。NO3-与土壤的结合较弱,易被水冲走,因此土壤的类型、湿度及有机物含量都能影响NH3及NO3-的产生、变化及分布。(5)淋失各种铵态氮肥和尿素进入土壤后,只要20天就可完全被硝化转化为硝酸盐(NO3-),硝酸根不能被土壤吸附,存在于土壤溶液中,易被灌溉水和雨水淋溶至还原层。我国各地气候比较复杂,土壤性质各异,淋失量差别很大。在干旱和半干旱地区,只有降雨量大于150mm的月份和灌溉水定额使水下渗超过30cm的土层时,质地轻的土壤才会发生硝态氮淋失。各地试验结果表明,氮肥淋失量为8.5~28.7%。结果将污染地下水源和部分地面水。63氮在土壤中的迁移转化642.磷污染及其迁移转化1)磷污染2)土壤中磷的来源磷的天然源主要来自岩石的风化作用,许多岩石中所含的磷通常以PO43-形态结合至矿物结构中。当岩石发生风化的时候,这些磷酸盐大量被溶解,变成可被植物利用。发育于不同母岩的土壤其含磷量也会有明显差异。人为源主要是磷矿废水及施用磷肥。我国磷肥总产量约300万吨P2O5,其中过磷酸钙和钙镁磷肥占总磷肥量的98.02%。自然界磷参与沉积循环。3)土壤中磷的形态无机态磷土壤中的无机态磷几乎全部是正磷酸盐,根据其结合的主要阳离子的性质不同,可把土壤通常存在的磷酸盐化合物分为四个类型:65(1)磷酸钙(镁)化合物(以Ca-P表示)钙盐溶解度小于镁盐而数量远远大于镁盐,是石灰性或钙质土壤中磷酸盐的主要形态。钙盐化合物中以磷灰石类溶解度最小,常见的有氟磷灰石Ca5(PO4)3F、羟基磷灰石Ca5(PO4)3OH等。共同特点是Ca/P为5/3,溶解度极小,对植物营养无效。土壤存在的磷灰石很多是从母岩转化而来。化学磷肥→一系列磷酸钙类化合物。如施用过磷酸钙肥料,其主要有效成分磷酸一钙可与石灰性土壤中的钙质成分作用依次转化为磷酸二钙Ca2HPO4、磷酸八钙Ca8H2(PO4)6和磷酸十钙Ca10(PO4)6(OH)2等。随着Ca/P比的增加,这些化合物在土壤中稳定性增加,溶解度迅速下降。(2)磷酸铁和磷酸铝类化合物(分别以Fe-P和Al-P表示)在酸性土壤中,无机磷大部分和土壤中的铁、铝化合物形成各种形态的磷酸铁和磷酸铝类化合物,如粉红磷铁矿Fe(OH)2H2PO4、磷铝石Al(OH)2H2PO4,溶解度极小。在水稻田土壤和其它沼泽型积水土壤中还有蓝铁矿Fe3(PO4)2·8H2O。66(3)闭蓄态磷(O-P表示)是由氧化铁胶膜包被着的磷酸盐。如粉红磷铁矿遇到土壤局部pH升高时,产生下列反应:结果释放出固相表面部分的固定磷,同时所形成的无定形Fe(OH)3胶体在粉红磷铁矿表面形成胶状薄膜,溶解度更远小于粉红磷铁矿,对内部的Fe-P起到了掩蔽作用。这种以Fe(OH)3或其它类似性质的不溶性胶膜所包被的磷酸盐统称为闭蓄态磷。闭蓄态磷在强酸性土壤中往往超过50%,而在石灰性土壤中也可达到15~30%以上。(4)磷酸铁铝和碱金属、碱土金属复合而成的磷酸盐类这种磷酸盐成分更复杂,种类也多,往往是由化学磷肥作用于土壤成分转化而成,溶解度也极小,对作物营养无多大效果。就中国而言,在风化程度很高的南方砖红壤和红壤中,O-P占无机磷总量的比重很高,最多的达90%以上,其次为Fe-P,而Ca-P和Al-P一般比较少。在风化程度低、有石灰性反应的北方和西北土壤中,Ca-P所占比例最大,约在60%以上,其次为O-P,Al-P很少,Fe-P小于1%。Fe(OH)2H2PO4OH-Fe(OH)3H2PO4-++67有机态磷有机磷在总磷中占的比例及其变化范围十分宽,一般地说,有机磷随土中有机质的含量增加而增加,而表层土又较次层土有机磷含量高,有机磷在表层土的含量不定。土壤中有机态磷主要有三类(约占总有机磷的70%左右,其中以植素磷和核酸磷两类为主,还有20~30%左右的有机磷形态需要进一步查明):(1)核酸类核酸是含有磷和氮的复杂有机化合物,多数认为是从动植物残体,特别是微生物中的核蛋白分解而来。这类核酸态磷在土壤有机态磷中所占比例一般在5~10%左右。此外还有少量核蛋白通过微生物酶作用后分解为磷酸盐为植物所用。ºËµ°°×ºËËáµ°°×ÖÊÁ×ËẬ°±µÄàÑßÊ»ù»òßÁऻùÖ²ÎïÎüÊÕºËÌÇ»òÍÑÑõºËÌÇË®½âºËËáø+++68(2)植素类植素是普遍存在于植物体中的含磷有机化合物,占土壤有机磷总量的1/5到1/3之间,有的甚至超过一半。植素在纯水中的溶解度可达10ppm左右,并且随溶液pH升高溶解度增大。但是对大部分植素来说,一般是先通过微生物的植素酶的水解产生磷酸。如植素钙、镁盐分解步骤为:(3)磷脂类是醇溶性和醚溶性的含磷有机化合物,其中较复杂的还含有氮,普遍存在于动植物及微生物中,土壤中磷脂类含量通常不到总有机磷量的1%,也必须经过微生物的分解才能成为有效磷。(CHOPO3)6Ca3Mg3[CHO-PO(OH)2]6[CHOPO(OH)2]2(CHOH)4H3PO44(CHOH)6H3PO42++Ö²ËØ£¨Ö²Ëá¸Æþ£©Ö²Ëá»·¼ºÁù´¼£¨¼¡´¼£©694)磷在土壤中的迁移转化1.有机磷的矿化和无机磷的生物固定(是两个相反的过程).①土壤中有机磷的矿化,主要是土壤中的微生物和游离酶磷酸酶共同作用的结果.②土壤中无机磷的生物固定作用主要是磷化合物的沉淀作用和吸附作用.2.土壤中磷的沉淀和溶解作用土壤中的磷和其他阳离子形成固体而沉淀,在不同的土壤中,由不同的系统所控制.70土壤磷循环示意图714.2.3土壤重金属污染及其迁移转化(Soil-PlantSystem)土壤背景值:指在未受污染的情况下,天然土壤中的金属元素的基线含量。72土壤背景值中含量较高的元素为:Mn、Cr、Zn、Cu、Ni、La、Pb、Co、As、Be、Hg、Se、Sc、Mo(mg/kg)73重金属污染土壤的特点:(CharacterofHeavyMetalPolluted)1.重金属不被土壤微生物降解,可在土壤中不断积累,也可以为生物所富集,并通过食物链在人体内积累,危害人体健康;2.重金属一旦进入土壤就很难予以彻底的清除。74几种重金属在土壤中的迁移转化:(1)汞(Hg)(金属汞、无机汞、有机汞)非微生物转化:Hg22+=Hg2++Hgo微生物转化:HgS(硫杆菌)→Hg2+(抗汞菌)→Hg0汞的甲基化:在有氧或好氧条件下,微生物使无机汞盐转变为甲基汞,称汞的生物甲基化。(水俣病)7576(2)镉(Cd)存在:在0-15米土壤表层积累,主要以Cd3(PO4)2和Cd(OH)2的形式存在。在pH>7的土壤中分为水溶性、难溶性和吸附态。吸收:根>叶>枝>花、果、籽粒蔬菜类叶菜中积累多,黄瓜、萝卜、番茄中少,镉进入人体,在骨骼中沉积,使骨骼变形,骨痛症。(痛痛病)77(3)铅(Pb)可溶态的含量很低,主要以Pb(OH)2、PbCO3、PbSO4铅的难溶盐形式存在。Pb2+可以置换黏土矿物上的Ca2+,在土壤中很少移动。植物吸收主要在根部,大气中的铅可通过叶面上的气孔进入植物体内,如蓟类植物能从大气中被动吸附高浓度的铅,现已确定作为铅污染的指示作物。78(4)铬(Cr)以含铬废水(物)进入土壤,常以三价形式存在,90%以上被土壤固定,难以迁移。土壤胶体强烈吸附三价铬,随pH的升高吸附能力增强。土壤对Cr(VI)的吸附固定能力低,约8.5-36.2%,进入土壤的Cr(VI)在土壤有机质的作用下很容易还原成三价。pH6.5-8.5,MnO2起催化作用,三价铬也可以氧化成Cr(VI):4Cr(OH)2++3O2+2H2O→4CrO42-+12H+79(5)铜(Cu)存在形态可分为可溶性铜,交换性铜,非交换性铜和难溶性铜.土壤中腐殖质能与铜离子形成螯合物.(6)锌(Zn)主要被富集在土壤表层,锌是植物生长发育不可缺少的元素.80(7)砷(As)土壤中砷的形态:水溶态、吸附态和难溶态。前二者又称可给态砷,可被植物吸收。吸收:有机态砷→被植物吸收→体内降解为无机态→通过根系、叶片的吸收→体内集中在生长旺盛的器官如:水稻,根>茎叶>谷壳>糙米81824.2.4土壤的农药污染及其迁移和转化(TransportandTransformationofPesticideinSoil)(1)有机氯农药(最主要的品种是DDT和六六六,化学性质稳定、在环境中残留时间长、短期内不易分解、易溶于脂肪并在脂肪中积蓄) (2)有机磷类农药(剧毒、较易分解) (3)氨基甲酸酯类农药(易分解、代谢)(4)除草剂831.土壤中化学农药的迁移转化1)吸附物理吸附、化学吸附、氢键结合和配位价键结合吸附。(移动性和生理毒性随之发生变化,净化,但这种净化作用是有限度的)。影响因素:(1)土壤胶体的种类和数量(2)胶体的阳离子组成(3)化学农药的物质成分和性质吸附能力越强,农药在土壤中的有效性越低,则净化效果越好。(1)土壤对农药的吸附机理①物理吸附,②离子交换吸附,③氢键吸附和④配位体交换吸附等。84(2)土壤中农药的吸附等温式Henry型等温吸附方程:x/m=KCx/m:单位土壤吸附农药的量,ug/cm3C:吸附平衡时溶液中农药的浓度,ug/cm3K:分配系数影响土壤对农药吸附作用的因素:①土壤胶体的性质②农药本身的化学性质③土壤的pH值852)挥发和淋溶挥发:以气体形式扩散淋溶:以水为介质进行迁移,其主要方式有两种:一是直接溶于水;二是被吸附于土壤固体细粒表面上随水分移动而进行机械迁移。一般来说,农药在吸附性能小的砂性土壤中容易移动,而在粘粒含量高或有机质含量多的土壤中则不易移动,大多积累于土壤表层30cm土层内。因此有的研究者指出,农药对地下水的污染是不大的,主要是由于土壤侵蚀,通过地表径流流入地面水体造成地表水体的污染。86(1)化学农药在土壤中的挥发土壤中农药的挥发速率可以用下式来表示:Vsw/a=Cw/Ca(1/r+Ka)Vsw/a:农药从土壤中的挥发速率Cw:农药在土壤溶液中的浓度Ca:农药在空气中的浓度r:土壤中土壤固相与水的质量比Ka:土壤对农药的吸附系数87(2)化学农药在土壤中的淋溶迁移农药在土壤气相-液相之间的移动计算公式:Kwa=Cw/Ca=8.29ST/pMKwa:农药在水相和气相之间的分配系数Cw:水相农药的浓度Ca:气相中农药的浓度S:农药在水中的溶解度P:农药的蒸气压M:农药的相对分子质量T:绝对温度883)降解农药在土壤中的降解,包括光化学降解、化学降解和微生物降解等在评价一种农药是否对环境有污染作用时,不仅要看药剂本身的毒性,而且还要注意降解产物是否有潜在危害性。89(1)化学降解(水解、氧化、离子化等反应)大多在水溶液中进行,水解是化学农药最主要的反应过程之一(2)光化学降解是指土壤表面接受太阳辐射能和紫外线光谱等能量而引起农药的分解作用.90NNNClHRHRSOM-COOH+NNNClHRHRNNNClHRHRNNNOHHRHRHOCOSOMH2OHOCOSOMSOM-COOH+氯代均三氮苯的吸附催化水解91NClClClOPOHOCH2CH3ONClClClOPOOCH2CH3CH2CH3OHOPOOCH2CH3CH2CH3OH2OOH-毒死蜱水解的二种可能反应机理92在土壤中,生物降解是主要的机制,而微生物又在生物降解中占首要地位。(3)(3)微生物降解微生物降解93①①氧化作用(羟基化、脱烷基、氧化作用(羟基化、脱烷基、ββ——氧化、脱氧化、脱羧基、醚键开裂、环氧化、氧化偶联、芳环羧基、醚键开裂、环氧化、氧化偶联、芳环或杂环开裂等)或杂环开裂等)②②还原作用还原作用③③水解作用水解作用④④苯环破裂作用苯环破裂作用⑤⑤脱氯作用脱氯作用⑥⑥脱烷基作用脱烷基作用94脱氯作用DDT952化学农药在土壤中的残留及危害土壤化学农药的残留积累毒害主要表现在两方面:①残留农药的转移产生的危害;②残留农药对靶生物的直接毒害。96土壤中农药残留量近似计算公式:R=C0exp(-kt)R:农药残留量C0:农药初始使用量k:衰减常数,取决于农药品种及土壤性质等因素t:化学农药施用后的时间974.3污染土壤的防治措施与修复技术4.3.1污染土壤的防治措施①控制和消除工业”三废”的排放②合理施用化肥和农药③提高土壤环境容量,增强土壤净化能力④建立土壤污染监测,预测和评价系统⑤其他措施984.3.2污染土壤的修复技术按照技术类别分类1.污染土壤的物理修复:加热方法;稳定固化法等2.污染土壤的化学修复:1)土壤淋洗法;2)化学钝化剂和改良剂3)氧化剂/还原剂4)光催化降解5)萃取3.污染土壤的电动修复1)电动修复污染物迁移机制(电迁移、电渗流、电泳)2)影响土壤电动修复的因素(PH值、土壤理化性质、污染物类型和浓度、电压和电流、电极材料布局和间距)3)几种电动力学修复方法和技术994.污染土壤的微生物修复1)有机污染土壤的微生物修复原理2)重金属污染土壤的微生物修复原理3)污染土壤的微生物修复技术与应用(1)原位微生物修复(2)异位微生物修复5污染土壤的植物修复1)植物修复技术的分类2)植物修复技术的应用100实例除草剂2,4,5-T难以降解,可利用苯酸脂而生长的细菌对其有共代谢作用。间-硝基酚难以降解,但利用对硝基酚而生长的黄杆菌可与其发生共代谢作用降解成硝基醌。101



















