






《人教版高二化学选修4《盐类的水解》PPT课件》是由用户上传到老师板报网,本为文库资料,大小为433.84 KB,总共有21页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 21页
- 433.84 KB
- VIP模板
- pptx
- 数字产品不支持退货
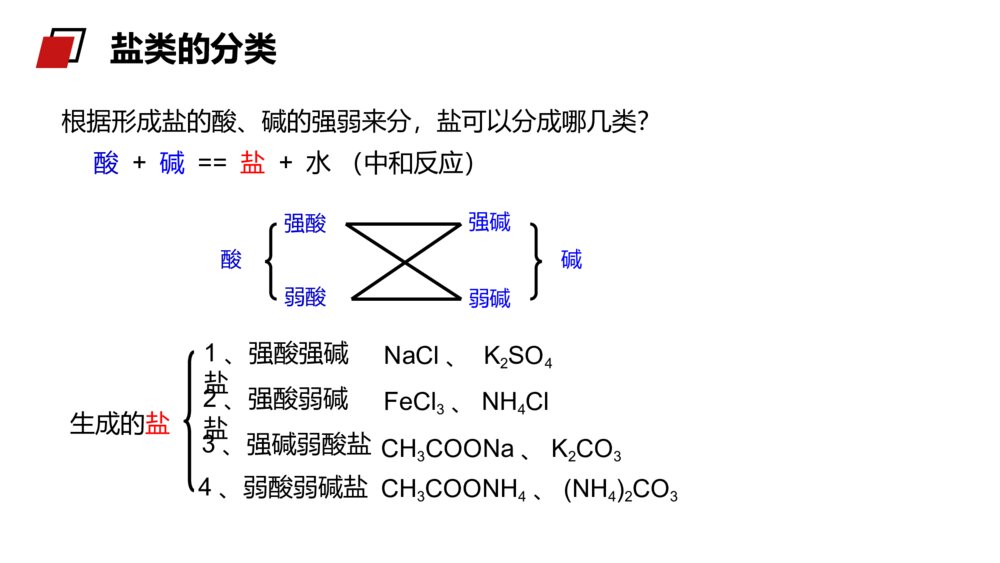
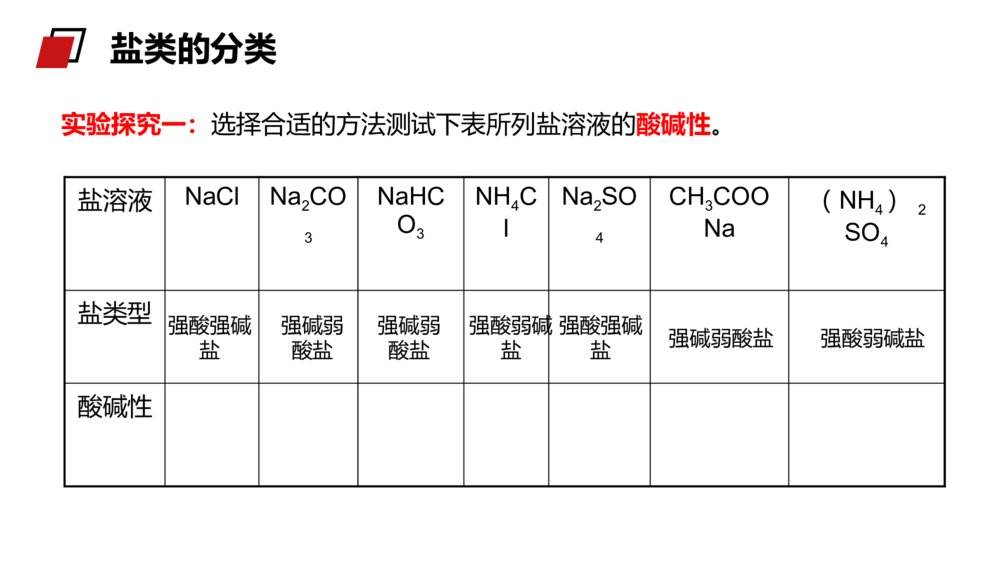
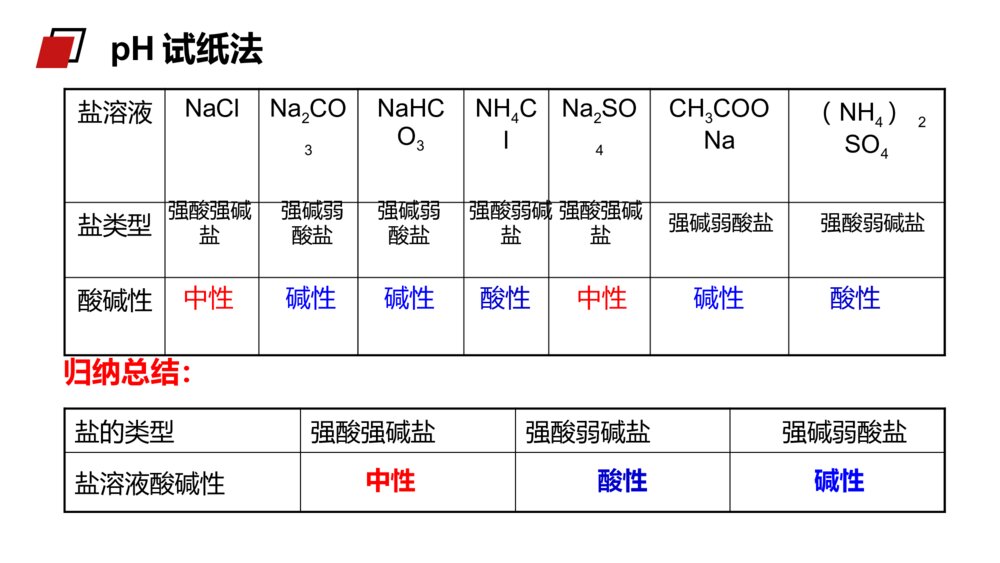
老师:xxxMENTALHEALTHCOUNSELINGPPT第三节 盐类的水解第三章水溶液中的离子平衡人教版高中化学选修4(高二)学习目标1、认识盐类水解的原理,能正确书写盐类水解的离子方程式。3、理解盐类水解的实质,能根据盐的组成判断盐溶液的酸、碱性。2、了解盐溶液呈酸、碱性的原因,掌握盐溶液呈酸、碱性的规律。被蜂蜇伤后,皮肤局部出现显著的烧灼感或痛痒感,周围潮红肿胀,中央常有一个刺蜇所致的淤点,较重者形成水疱。少数可伴有全身中毒现象,受蜇皮肤立刻红肿、疼痛。如果被成群的蜂蜇伤后,可出现头晕、恶心、呕吐,严重时可出现休克、昏迷甚至死亡。1、如果在被蜇伤处发现毒刺,首先要将它拔掉,可减少进入人体的毒液。拔的时候要小心,避免挤压使毒液深入扩散,可以借助胶布粘贴后揭起或用镊子将刺拔出。2、蜜蜂的毒液呈酸性,可选用纯碱溶液或肥皂水或5%~10%碳酸氢钠溶液洗敷伤口。生活小常识1、纯碱是什么?2、从组成上看是哪类物质?3、为什么叫纯碱?“纯碱”根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?酸+碱==盐+水(中和反应)酸强酸弱酸弱碱强碱碱生成的盐1、强酸强碱盐2、强酸弱碱盐3、强碱弱酸盐4、弱酸弱碱盐NaCl、K2SO4FeCl3、NH4ClCH3COONH4、(NH4)2CO3CH3COONa、K2CO3盐类的分类酸溶液显酸性,碱溶液显碱性,那么盐溶液显什么性?思考:盐类的分类实验探究一:选择合适的方法测试下表所列盐溶液的酸碱性。盐溶液NaClNa2CO3NaHCO3NH4ClNa2SO4CH3COONa(NH4)2SO4盐类型酸碱性强酸弱碱盐强碱弱酸盐强酸强碱盐强酸弱碱盐强碱弱酸盐强碱弱酸盐强酸强碱盐盐类的分类操作方法将一小片pH试纸放在表面皿上,用干燥的玻璃棒蘸取待测液点在pH试纸上,迅速和标准比色卡对比(读取整数)。注意:pH试纸不能用水湿润pH试纸法中性碱性碱性酸性中性碱性酸性盐的类型强酸强碱盐强酸弱碱盐强碱弱酸盐盐溶液酸碱性归纳总结:中性酸性碱性pH试纸法盐溶液NaClNa2CO3NaHCO3NH4ClNa2SO4CH3COONa(NH4)2SO4盐类型酸碱性强酸弱碱盐强碱弱酸盐强酸强碱盐强酸弱碱盐强碱弱酸盐强碱弱酸盐强酸强碱盐讨论1:为什么强碱弱酸盐(例CH3COONa溶液)显碱性?溶液显碱性,说明c(OH-)>c(H+)纯净的水中,c(OH-)=c(H+),CH3COONa溶液中是什么离子作用,使溶液中c(OH-)>c(H+)?CH3COONa溶于水,发生电离:CH3COONa=CH3COO-+Na+CH3COO-和Na+中是哪一个离子导致溶液中c(OH-)>c(H+)?探究二、分析盐溶液显酸碱性的原因:+CH3COOH总反应:CH3COONa+H2OCH3COOH+NaOH离子方程式:CH3COO-+H2OCH3COOH+OH-H2OH++OH-结论:强碱弱酸盐溶液呈碱性原因是由于盐电离产生的弱酸阴离子与水电离产生的阳离子(H+)结合生成弱电解质,使水的电离平衡右移,导致溶液中c(OH-)>c(H+)使溶液呈碱性。CH3COONa=CH3COO-+Na+溶液中:C(OH-)>C(H+),呈碱性。探究二、分析盐溶液显酸碱性的原因:NH4Cl==NH4++Cl-+NH3·H2O总反应:NH4Cl+H2ONH3·H2O+HCl离子方程式:NH4++H2ONH3·H2O+H+H2OOH-+H+结论:强酸弱碱盐溶液呈酸性原因,是由于盐电离产生的弱碱阳离子与水电离产生的阴离子(OH-)结合生成弱电解质,使水的电离平衡右移,导致溶液中c(H+)>c(OH-)而使溶液呈酸性。溶液中:c(H+)>c(OH‑),显酸性。探究二、分析盐溶液显酸碱性的原因:1.盐类的水解概念2.实质:盐电离产生的阳离子或阴离子与水电离产生的OH—或H+结合生成弱碱或弱酸从而促进电离向着正方向移动,导致溶液中的C(H+)和C(OH—)不相等,使溶液呈现出一定的酸性或碱性。盐电离产生的阴离子、阳离子分别与水电离产生的H+或OH—结合生成弱电解质的反应一、盐溶液呈现不同酸碱性的原因NH4++H2ONH3·H2O+H+3、盐类水解方程式的书写⑵一般盐类水解的程度很小,通常不生成沉淀或气体,一般不标“↓”或“↑”。HCO3-+H2OH2CO3+OH-Al3++3H2OAl(OH)3+3H+⑴盐类水解是可逆反应,反应方程式中要写“”符号一、盐溶液呈现不同酸碱性的原因⑷多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。⑶多元弱酸的盐分步水解,以第一步为主,水解方程式一般只写第一步。S2-+H2OHS-+OH-(主要)HS-+H2OH2S+OH-(次要)Fe3++3H2OFe(OH)3+3H+一、盐溶液呈现不同酸碱性的原因(a)NH4+与S2-、HCO3-、CO32-、CH3COO-等组成的盐虽然水解相互促进,但水解程度较小,仍是部分水解,书写时仍用“”表示(b)双水解:①Al3+和CO32-或HCO3-、S2-、HS-、AlO2-等组成的盐;②Fe3+和CO32-或HCO3-、AlO2-水解相互促进直至反应完全,生成气体或沉淀,书写时用“═”表示⑸弱酸弱碱盐中阴、阳离子水解相互促进NH4++CH3COO-+H2OCH3COOH+NH3·H2OAl3++3HCO3-═Al(OH)3↓+3CO2↑一、盐溶液呈现不同酸碱性的原因(2)将盐的电离方程式与盐类水解的离子方程式区别开来(1)盐类水解的离子方程式遵循质量守恒定律和电荷守恒定律(3)能发生双水解的离子,在同一溶液中不能大量共存HS-+H2OS2-+H3O+是HS-的电离方程式HS-+H2OH2S+OH-是HS-的水解方程式注意:1.在溶液中,不能发生水解的离子是()A、ClO–B、CO32–C、Fe3+D、SO42–D练习:D2、下列水解离子方程式正确的是()A、Fe3++3H2OFe(OH)3↓+3H+B、Br-+H2OHBr+OH-C、CO32-+H2OH2CO3+2OH-D、NH4++H2ONH3.H2O+H+练习:(1)盐类水解的实质:盐电离出来的阴、阳离子与水电离出来的H+或OH-结合生成了弱电解质,从而破坏了水的电离平衡。(2)水解方程式的书写:多元弱酸阴离子以第一步水解为主,多元弱碱阳离子的水解复杂,可一步写出。(3)盐类的水解规律:有弱即水解,无弱不水解,越弱越水解,谁强显谁性。课堂总结老师:xxxMENTALHEALTHCOUNSELINGPPT感谢各位的仔细聆听第三章水溶液中的离子平衡人教版高中化学选修4(高二)



















