








《化学平衡状态PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为688.5 KB,总共有26页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 26页
- 688.5 KB
- VIP模板
- ppt
- 数字产品不支持退货
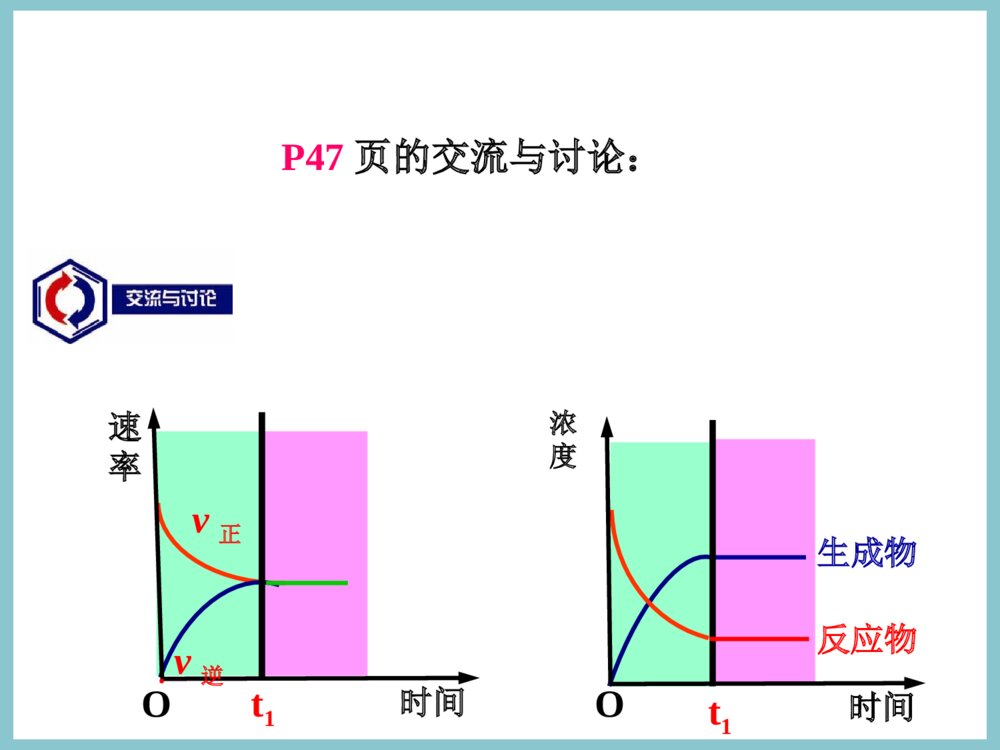
高温高炉炼铁的主要反应为:Fe2O3+3CO2Fe+3CO2;在19世纪后期,人们发现从炼铁高炉的炉口排出的尾气中含有一定量的CO。有的工程师认为,这是由于CO与铁矿石接触时间不够长的原因。于是在英国耗费了大量资金建造了一个高大的炼铁高炉,以增加CO和Fe2O3的接触时间。可后来发现,用这个高炉炼铁,排出的高炉气中CO的含量并未减少。这是为什么呢?历史资料教材P461、定义在同一条件下既可向正反应方向进行又可向逆反应方向进行的反应。2SO2+O22SO3催化剂3H2+N22NH3高温、高压催化剂Cl2+H2OHCl+HClO如:一、可逆反应→正反应方向;v正;此时反应物。←逆反应方向;v逆;此时反应物。事实上,大部分化学反应都是可逆反应。事实上,大部分化学反应都是可逆反应。只不过有的逆方向较弱,不太明显;而有的逆只不过有的逆方向较弱,不太明显;而有的逆方向很强,表现为明显的可逆反应。方向很强,表现为明显的可逆反应。SO2+O22SO3催化剂高温SO2O2SO3①相同条件下,正反应和逆反应同时发生②反应物、生成物共同存在③可逆反应有一定的限度(反应不能进行到底)任一组分转化率<100%2、可逆反应特点可逆反应练习1:下列为可逆反应的是()A氢气与氧气点燃可化合成水,水电解可生成氢气和氧气,因此氢气与氧气的反应是可逆反应B在催化剂的作用下,二氧化硫与氧气反应生成三氧化硫的同时,三氧化硫又有分解。C碳酸钙在高温下分解生成氧化钙和二氧化碳,氧化钙和二氧化碳在常温下生成碳酸钙,因此这二个反应互为可逆反应。D工业合成氨的反应BD可逆反应可逆反应能进行彻底吗?即2molSO2与1molO2在催化剂的作用下最终能得到2molSO3吗?不能⑴开始时刻各物质浓度,正、逆反应速率如何?⑵随着反应进行又有什么特征?⑶一段时间后有什么特征?c(SO2)、c(O2)最大,c(SO3)=0c(SO2)↓c(O2)↓c(SO3)↑;c(SO2)、c(O2)、c(SO3)均不再变化化学平衡状态的建立v(正)=v(逆)v(正)↓(逆)↑v(正)最大,v(逆)=0SO2+O22SO3催化剂高温P47页的交流与讨论:时间速率O··v正v逆t1时间浓度O··t1反应物生成物化学平衡状态11定义:定义:化学平衡状态,就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。二、注意三点前提(适用范围):可逆反应内在本质:v(正)=v(逆)≠0外在标志:反应混合物中各组分的浓度保持不变22、化学平衡状态的特征、化学平衡状态的特征动动动态平衡:动态平衡:v((正正)≠0)≠0;;v((逆逆)≠0)≠0等等定定变变v((正正))==v((逆逆)≠0)≠0c(B)c(B)或或n(B)n(B)或或ω(B)ω(B)一定一定条件改变→平衡改变条件改变→平衡改变逆逆化学平衡的研究对象是可逆反应化学平衡的研究对象是可逆反应练2.在一定条件下,向一固定容积的容器中投入2molNO2进行反应:2NO22NO+O2,一段时间后测得NO2、NO、O2的物质的量可能是()A.2molNO、0.75molO2B.1molNO2、1.2molNOC.2molNOD.0.7molO2D练3.当可逆反应2SO2+O22SO3达平衡时,通入18O2,再次平衡时,18O存在于()A.SO3O2B.SO2SO3C.SO2O2D.SO2O2SO3D(1)看能否得出v正=v逆的状态特征55、化学平衡状态的标志、化学平衡状态的标志③键的角度分析:单位时间某物质断裂与形成的化学键的物质的量相等①同一种物质:该物质的生成速率等于它的消耗速率;②不同种物质:一物质的正反应速率与另一物质的逆反应速率之比等于方程式中的计量数之比;即mA(g)+nB(g)pC(g)+qD(g)ひ(A正)׃ひ(B逆)==m׃n׃下列说法可以证明反应N2+3H22NH3已达平衡状态的是()(A)1个N≡N键断裂的同时,有3个H-H键形成(B)1个N≡N键断裂的同时,有3个H-H键断裂(C)单位时间内,生成1molN2的同时生成2molNH3(D)单位时间内,消耗1molN2的同时生成2molNH3知识应用AC(2)看能否得出反应混合物中各组成成分的含量保持不变的结果特征:①各组成成分的含量(浓度、质量、物质的量、体积分数等)保持不变;②容器体积一定时,有色气体的颜色不再变化;(3)看能否通过P总、n总、ρ、M的变化情况得出结论:①若反应往正方向或逆方向进行时P总或n总或ρ或M会发生改变的,则不变时说明达到平衡;②若反应往正方向或逆方向进行时P总或n总或ρ或M总是不变的,则不能判断是否达到平衡。如:I2、Br2、NO21.下列说法中可以充分说明反应:P(气)+Q(气)R(气)+S(气),在恒温下已达平衡状态的是()A.反应容器内压强不随时间变化B.P和S的生成速率相等C.反应容器内P、Q、R、S四者共存D.反应容器内总物质的量不随时间而变化B例题2.在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:A(s)+3B(g)2C(g)+D(g)已达平衡状态的是()A.混合气体的压强B.混合气体的密度C.B的物质的量浓度D.气体的总物质的量BC例题化学平衡的判断直接标志:A.V正=V逆B.各组分的m、n不变。C.通过含量:各组分的质量分数、物质的量分数、(恒温、衡压下)气体的体积分数不变。D.通过浓度:各组分的浓度不变。间接标志:A.通过总量:前提:气体反应Δn≠0时。体系的n(总)、p(总)、v(总)不变。B.通过复合量:、ρ不变。C.其他:如平衡体系颜色不变(实际是有色物浓度不变)191、在恒温恒容条件下可逆反应:A(g)+3B(g)2C(g)达到平衡的标志是()A.C的生成速率与C的分解速率相等B.单位时间生成nmolA,同时生成3nmolBC.A、B、C的物质的量浓度保持不变D.A、B、C的分子数之比为1:3:2E.容器中气体的密度保持不变F.混合气体的平均摩尔质量保持不变G.容器中气体的总压强保持不变ACFG练习202、某温度下,可逆反应:N2(g)+3H2(g)===2NH3(g)在恒容的容器中反应达到平衡的标志是()A.NH3的生成速率与NH3的分解速率相等。B.单位时间生成nmolN2,同时生成3nmolH2。C.N2、H2、NH3的分子数之比为1:3:2。D.N2、H2、NH3的物质的量浓度保持不变。E.容器中气体的密度保持不变。F.混合气体的平均摩尔质量保持不变。G.容器中气体的总压强保持不变。H.断裂3molH-H键的同时形成2molN-H键.I.3V正(H2)=2V逆(NH3)ADFG练习ABHI是速率范畴CD是含量范畴EFG是P、ρ、M范畴•Ⅰ.直接标志:{任何情况均适用}•((11)等)等————同一种物质同一种物质ひ正(B)=ひ逆(B)•(2)反应混合物中反应物和生成物反应物和生成物各组分的浓度或其百分含量保持不变•注意陷阱:•(1)同一反应中不同的物质的速率之比等于方程式中各物质的计量数之比。•(2)若反应前后总质量一直不变,则化学反应达到平衡状态。•(3)密闭容器中的气体反应如,若密度不变,则化学反应达到平衡状态。总结.化学平衡状态的标志:(难点)非标志非标志(错)(错)NN22+3H+3H222NH2NH33(错)Ⅱ.间接标志:{任何情况均适用}•(1)同一种物质:该物质的生成速率等于它的分解速率。ひ生成(B)=ひ分解(B)•(2)同一种物质:该物质的断键速率等于它的成键速率。ひ断键(B)=ひ成键(B)•(3)各组成的物质的量n(或物质的量分数)不随时间的改变而改变。•(4)各组成的质量m(或质量分数)不变。•(5)各气体的体积V(或体积分数)不变。•(6)各反应物的转化率或各产物的产率保持不变。项目mA(g)+nB(g)pC(g)+qD(g)是否平衡混合体系中各组分的含量各物质的物质的量或物质的量的分数一定各物质的质量或质量分数一定各气体的体积或体积分数一定总压强、总体积、总物质的量一定平衡平衡平衡不一定mA(g)+nB(g)pC(g)+qD(g)是否平衡正、逆反应速率关系在单位时间内消耗了mmolA的同时生成了mmolA在单位时间内消耗了nmolB的同时消耗了pmolC在单位时间内生成了nmolB的同时消耗了qmolD(均指ひ逆)ひ(A)׃ひ(B)׃ひ(C)׃ひ(D)=m׃n׃p׃q,ひ正不一定等于ひ逆平衡平衡不一定不一定mA(g)+nB(g)pC(g)+qD(g)是否平衡压强当m+n≠p+q时,总压力一定(其它条件一定)当m+n=p+q时,总压力一定(其它条件一定)混合气体的平均M当m+n≠p+q时,M一定当m+n=p+q时,M一定不一定不一定平衡平衡注意化学反应的特点密度ρC(s)+CO2(g)2CO(g)(ρ一定)N2(g)+3H2(g)2NH3(g)(ρ一定)H2(g)+I2(g)2HI(g)(ρ一定)平衡不一定不一定



















