








《高中化学《第3节 硫的转化》PPT课件》是由用户上传到老师板报网,本为文库资料,大小为2.67 MB,总共有55页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 55页
- 2.67 MB
- VIP模板
- ppt
- 数字产品不支持退货
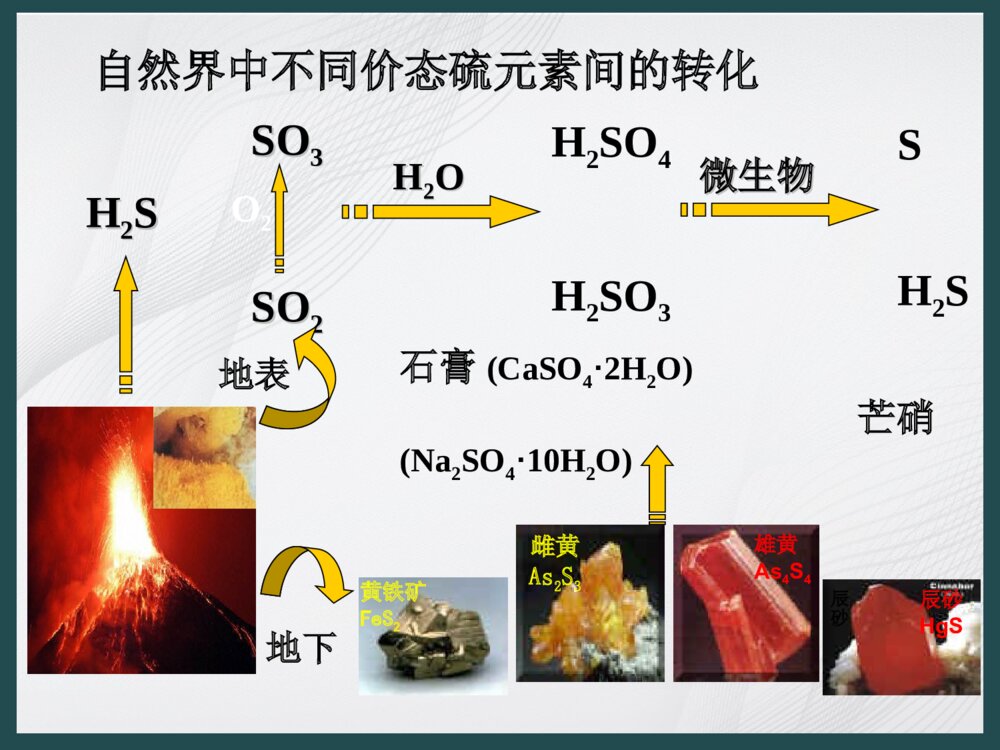
第三章自然界中的元素第3节硫的转化问题1:自然界中有哪些含有硫元素的物质?硫磺、二氧化硫、三氧化硫、硫酸、硫酸盐等硫元素的存在形态:游离态+化合态问题2:自然界中的含硫物质是怎样转化的?SOSO33SOSO22SH2S地下HH22SSH2SO4H2SO3石膏(CaSO4·2H2O)芒硝(Na2SO4·10H2O)地表O2HH22OO微生物微生物自然界中不同价态硫元素间的转化黄铁矿FeS2雄黄As4S4雌黄As2S3辰砂辰砂HgS实验1.观察硫黄样品2.在三个装有硫粉的试管中分别加入蒸馏水、酒精、二硫化碳3.加热硫粉不高不溶于水微溶于酒精易溶于CS2固体、很脆黄色或淡黄色熔沸点溶解性态色观察报告探究一:硫的物理性质探究一:硫的物理性质硫的同素异形体之间的相互转化低于95.4℃高于95.4℃熔点119℃硫和氯气一样都是典型的非金属单质,你能否根据氯气的性质预测硫单质可能具有哪些化学性质?方法导引实验探究1.铁与硫反应:实验现象:剧烈反应,生成黑色固体;产生刺激性气味气体。①反应开始后就移开玻璃棒,为什么反应仍能进行?③反应体现硫的什么性质?④对比金属铁与氯气、硫反应时的产物,比较氯气与硫氧化性强弱?②如何验证反应产物是三价铁还是二价铁?①反应开始后就移开玻璃棒,为什么反应仍能进行?②如何验证反应产物是三价铁还是二价铁?③反应体现硫的什么性质?反应放热体现硫的氧化性Fe+S==FeS△④对比金属铁与氯气、硫反应时的产物,比较氯气与硫氧化性强弱?硫的氧化性弱于氯气,是一种弱氧化剂,硫只能将变价金属氧化成低价态。试写出硫与钠、铜粉反应方程式2Cu+S==Cu2S△2Na+S==Na2S研磨实验探究硫与氧气的反应实验现象:剧烈燃烧;发出蓝紫色火焰;生成刺激性气味气体。S+O2==S02点燃体现硫的还原性问题3,试从原子结构、化合价角度解释硫单质的氧化性、还原性。问题探索2某同学取了一只试管准备做实验,发现里面沾了一些硫黄,便利用如下的反应原理进行清洗:3S+6NaOH=2Na2S+Na2SO3+3H2O那么洗涤硫的过程中硫表现了什么性质?(既表现氧化性又表现还原性)即学即用根据所学知识如何清洗沾有硫黄的试管?△热的NaOH溶液、二硫化碳0-2+41、可用于制备硫酸、化肥、火柴、杀虫剂等硫黄的用途2.制造火药,烟花爆竹S+2KNO3+3C点燃K2S+3CO2+N23.轮胎、胶管等橡胶制品硫化橡胶有很好的耐磨性和弹性。4.药用广东从化温泉长白山温泉广东从化温泉长白山温泉广东从化温泉硫黄温泉可以医治皮肤病。长白山温泉广东从化温泉二、二氧化硫1.物理性质•颜色:•状态:•气味:•毒性:•密度:•溶解性:•收集方法:无色气体有刺激性气味有毒比空气大易溶于水(1:40)向上排空气法(长进短出)2.化学性质二氧化硫属于哪种氧化物?根据二氧化硫中硫元素的化合价判断:二氧化硫具有什么样的性质?2、化学性质1、具有酸性氧化物的通性(1)、与H2O反应SO2+H2OH2SO3(亚硫酸)(2)、与碱反应SO2+2NaOH=Na2SO3+H2O酸性强弱为:HCl>H2SO3>H2CO3②二氧化硫通入澄清石灰水中会有什么现象?①实验室制取SO2时,为防止空气污染,用什么试剂吸收尾气?思考2、具有还原性(2)SO2+Cl2+2H2O=H2SO4+2HClSO2+Br2+2H2O=H2SO4+2HBr(4)2SO2+O22SO3催化剂△(1)SO2+H2O2=H2SO4(3)SO2+MnO4-SO42-+Mn2+总结:SO2、H2SO3、SO32-具有较强的还原性,能被双氧水、氯气、高锰酸钾、氧气、硝酸、氯化铁等氧化剂氧化。3、具有弱氧化性SO2+2H2S==3S↓+2H2O4、具有漂白性——能使品红褪色(用来检验SO2)原理:SO2跟某些有色物质化合生成无色不稳定的物质,受热恢复原来颜色。但不能漂白酸碱指示剂。它可以用来漂白纸浆、毛、丝、草编制品等。【讨论•交流】氯水和SO2都具有漂白作用,则将1molSO2和1molCl2通入同一容器水中,所得溶液的漂白作用加强吗?提示:SO2+Cl2+2H2O=H2SO4+2HCl【讨论•交流】SO2可以使①高锰酸钾褪色②品红③氯水褪色原理一样吗?①③表现还原性,②表现漂白性。酸性KMnO4溶液氯水或溴水向品红溶液通SO2,然后加热紫色石蕊试液实验结论实验现象实验内容变红溴水褪色紫色褪色先红色退去,后恢复红色SO2+Br2+2H2O=H2SO4+2HBr还原性SO2的漂白性是可逆的SO2的性质SO2+H2OH2SO3SO2+Cl2+2H2O=H2SO4+2HCl氯水褪色实验结论实验现象实验内容SO2的性质BaCl2溶液无现象不反应溶有SO2的BaCl2溶液中加入双氧水产生白色沉淀SO2++H2O2=H2SO4SO42-+Ba2+=BaSO4↓溶液中有浅黄色沉淀生成SO2+2H2S=3S↓+2H2O出现白色沉淀,加盐酸后沉淀溶解SO2+Ba(OH)2=BaSO3↓+H2OBaSO3+2HCl=BaCl2+H2O+SO2↑氢硫酸溶液氢氧化钡溶液SO2和CO2都是典型的酸性氧化物,在化学性质上既有相似性又有差异性,如何区分这两种气体?例如:SO2+Ca(OH)2=CaSO3↓+H2OSO2+CaSO3+H2O=Ca(HSO3)2易溶于水1.通入品红溶液,能使品红溶液褪色,且加热后又恢复红色的是二氧化硫,不褪色的是二氧化碳。2.通入酸性高锰酸钾溶液,溶液褪色的是二氧化硫,无明显现像的是二氧化碳。3.通入硫化氢溶液,有淡黄色沉淀生成的是二氧化硫,无明显现像的是二氧化碳。4.通入氯水,能使氯水褪色的二氧化硫,不褪色的是二氧化碳。5.通入溴水,能使溴水褪色的二氧化硫,不褪色的是二氧化碳。CO2、SO2的鉴别方法知识巩固:1.下列物质中,能在自然界中长期存在的是()A.SB.NaC.FeS2D.Cl2AC2.下列物质中,能通过单质间的化合反应直接得到的是()A.CuSB.FeCl2C.FeSD.Cu2SCD3.下列说法中,不正确的是()A.硫是一种淡黄色、不溶于水的固体.B.硫的化合物常存在于火山喷出的气体中和矿泉水里C.硫在氧气中的燃烧产物是三氧化硫D.1.6g硫与6.4g铜反应能得到8.0g硫化物C4、能够说明硫的氧化性比氯弱的事实有()①通常状况下硫为固体,氯气为气体②与金属单质反应,硫被还原为-2价,氯被还原为-1价③Cl2与铁反应生成FeCl3,S与铁反应生成FeS④将Cl2通入氢硫酸(H2S)中可置换出硫A、①②③B、②④C、②③④D、③④D5、请描述下述各步的实验现象,并写出②⑤的化学反应方程式。品红溶液实验:1、SO2通入紫色石蕊试液中,变红。2、SO2通入氯化钡溶液中,无现象;滴加双氧水,产生白色沉淀。3、SO2通入品红溶液中,红色退去;加热后,红色复原。4、SO2通入溴水中,黄色退去。5、SO2通入酸性KMnO4溶液中,溶液紫红色退去。6、实验完后,SO2通入氢氧化钠溶液中。7、将SO2与H2S混合,产生淡黄色固体。三、硫酸(一)、物理性质:纯硫酸为无色黏稠状液体,密度比水大,能与水互溶,溶于水时放出大量的热。浓硫酸易吸水,常用作干燥剂。问题探讨:如何稀释浓硫酸?(二)化学性质:1、强酸性(有酸的通性)3、脱水性:将有机物中的H和O按2:1脱去形成水。(原本无水)浓硫酸可以使蔗糖炭化2、吸水性(用作干燥剂)可以干燥:H2、O2、HCl、Cl2、CO、CO2、SO2等。不可干燥:NH3、H2S。4、强氧化性。Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O现象:有气体产生,产生气体使品红褪色:反应后试管中液体溶于水溶液呈蓝色思考:1、为何对SO2进行尾气吸收?吸收试剂用什么?2、向50mL18mol·L-1的H2SO4溶液中加入足量的铜片,充分加热后,被还原的H2SO4的物质的量是多少?小于0.45mol原因:随着反应的进行,浓硫酸浓度变稀,不再反应C+2H2SO4(浓)==CO2↑+2SO2↑+2H2O常温下,浓硫酸或浓硝酸可使铁、铝表面形成一层致密氧化物的保护膜而钝化b.非金属与浓硫酸的反应实验思考:如何检验某溶液中有CO32-?先加入氯化钙溶液产生白色沉淀,再加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体。思考:如何检验某溶液中有SO42-?先加入过量的盐酸无现象,再加氯化钡或氢氧化钡溶液,如果产生白色沉淀,证明原溶液中存在硫酸根离子三、酸雨及其防治(阅读课本90知识回答下属知识)空气中的二氧化硫在氧气和水蒸气的共同作用下形成酸雾。空气中的二氧化硫在氧气和水蒸气的共同作用下随雨水降落就成为酸雨。结论:氮氧化物和硫的氧化物是形成酸雨主要原因酸雾:酸雨:下酸雨后森林!1.SO2形成酸雨的产生原理原理一:2SO2+O22SO3SO3+H2O=H2SO42H2SO3+O2=2H2SO4SO2+H2OH2SO3原理二:粉尘等催化回忆:氮氧化物形成酸雨的原理?汽车尾气等产生NO、NO2等氮氧化物。形成酸雨的原理可简单表述为:2NO+O2=2NO23NO2+H2O=2HNO3+NO2.酸雨的防治•例题:为防治酸雨降低煤燃烧时向大气排放的二氧化硫,工业上将生石灰和含硫煤混合后使用。请写出燃烧时有关“固硫”(不使硫化合物进入大气)反应的化学方程式•_______________________________,•_______________________________。SO2+CaO===CaSO3高温O2+2CaSO3===2CaSO4高温要知道:由SO2形成的H2SO3、Na2SO3也具有较强的还原性。2H2SO3+O2=2H2SO42Na2SO3+O2=2Na2SO4不同价态硫之间的转化•SSO2SO3H2SO4Na2SO3Na2SO4①③②④⑤⑥⑦⑧⑨⑩•例题:为防治酸雨降低煤燃烧时向大气排放的二氧化硫,工业上将生石灰和含硫煤混合后使用。请写出燃烧时有关“固硫”(不使硫化合物进入大气)反应的化学方程式•_______________________________,•_______________________________。SO2+CaO===CaSO3高温O2+2CaSO3===2CaSO4高温已知:木炭与浓硫酸在加热条件下可发生如下反应:C+2H2SO4(浓)=CO2+2SO2+2H2O,为验证该反应的所有产物,某同学设计了下列实验,试回答下列问题:1.试回答各装置中的现象以及各装置中试剂的作用。2.能不能将E装置放在A和B之间,为什么?3.能否去掉D装置?ABCDE•练习:•1.现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:测试时间/h01234雨水的pH4.734.624.564.554.55•分析数据,回答下列问题。•(1)雨水样品的pH变化的原因是(用化学方程式表示)__________________________________•(2)如果将刚取样的上述雨水和用氯气消毒后的自来水混合,pH将变_____,原因是(用化学方程•式表示)_________________________________H2SO3+Cl2+H2O=2HCl+H2SO42H2SO3+O2=2H2SO4小即学即用•1、下列说法正确的是()A、硫是一种淡黄色易溶于水的固体B、硫在过量的氧气中燃烧生成三氧化硫C、硫粉与铁粉加热生成硫化亚铁D、硫是一种硬度很大,熔沸点很高的固体C3.我国古代四大发明之一的黑火药的一种简单配方为“一硫,二硝,三木炭”。黑火药爆炸的化学方程式: S+2KNO3+3C=K2S+3CO2↑+N2↑硫在该反应中体现了_____性,请设计实验分离黑火药中的三组分。氧化2、.下列物质中,能在自然界中长期存在的是()A.SB.NaC.FeS2D.Cl2AC第一步将混合物溶于CS2过滤得到S,第二步将滤渣溶于水过滤得到C,再将滤液蒸发结晶得到KNO3SSSS-20+4+6确定研究物质确定研究物质①③⑤②④⑥如:FeSSNa2SO3浓H2SO4方法导引2.讨论实验方案可行性3.实施实验方案4.归纳整理得出结论1.设计实验方案所提供药品和用品所提供药品和用品FeS固体、Na2SO3固体、硫粉、浓硫酸、氯水、品红试纸、稀硫酸、氯化钡溶液活动.探究1.设计实验方案第二步:讨论实验方案的可行性-20①SS:+40④SS:+4+6⑤SS:+6+4⑥SS:氯水、Na2SO3固体稀硫酸、氯化钡溶液FeS固体Na2SO3固体稀硫酸产物硫单质产物硫酸钡硫粉浓硫酸湿润的品红试纸产物二氧化硫第三步:实施实验方案SSSS-20+4+6①③⑤②④⑥编号编号SS实现的转化实现的转化实验方案实验方案主要实验现象主要实验现象1将FeS固体与稀硫酸产生H2S和Na2SO3固体与稀硫酸产生SO2同时通入集气瓶2将Na2SO3固体与稀硫酸产生SO2通入氯化钡溶液。然后滴入氯水。3加热硫粉与浓硫酸的混合物,将湿润的品红试纸放在试管口。+4→0④+4→+6⑤-2→0①+6→+4⑥产生淡黄色的烟产生白色沉淀湿润的品红试纸褪色第四步:归纳整理得出结论硫的转化实验结论:不同价态的硫可通过氧化还原反应相互转化!3、浓硫酸的特性(1)吸水性。浓硫酸能吸收空气和结晶水合物中的水分子。(2)脱水性。浓硫酸能将有机物中的H和O元素按水的组成比脱去,使之发生炭化。(3)强氧化性Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2Oa.金属与浓硫酸的反应实验现象:有气体产生,产生气体使品红褪色:反应后试管中液体溶于水溶液呈蓝色随着反应的进行,浓硫酸浓度变稀,不再反应C+2H2SO4(浓)==CO2↑+2SO2↑+2H2O常温下,浓硫酸可使铁、铝表面形成一层致密氧化物的保护膜而钝化b.非金属与浓硫酸的反应实验钝化:常温、浓硫酸或浓硝酸、铁或铝



















