


《高中有机化学乙醇PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为2.13 MB,总共有36页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 36页
- 2.13 MB
- VIP模板
- ppt
- 数字产品不支持退货
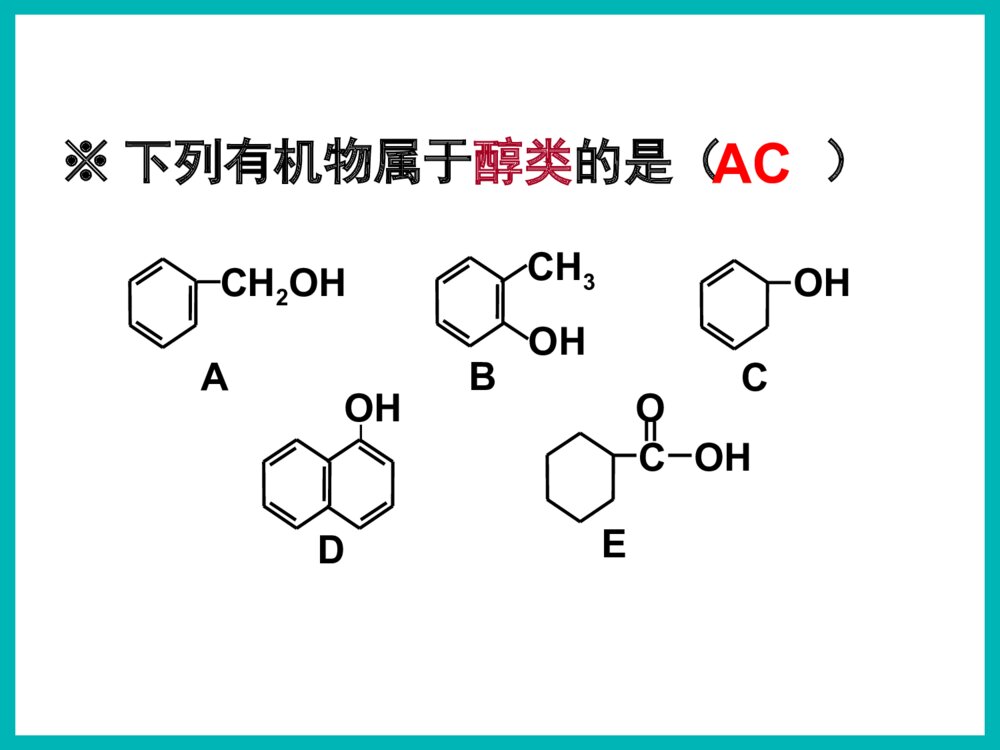
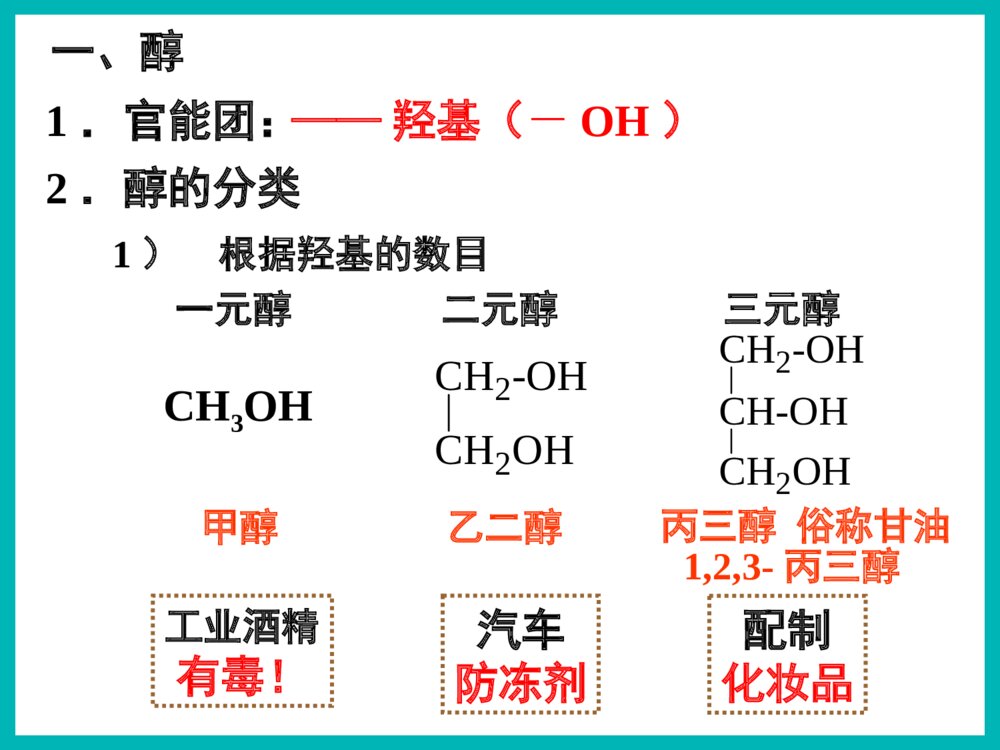
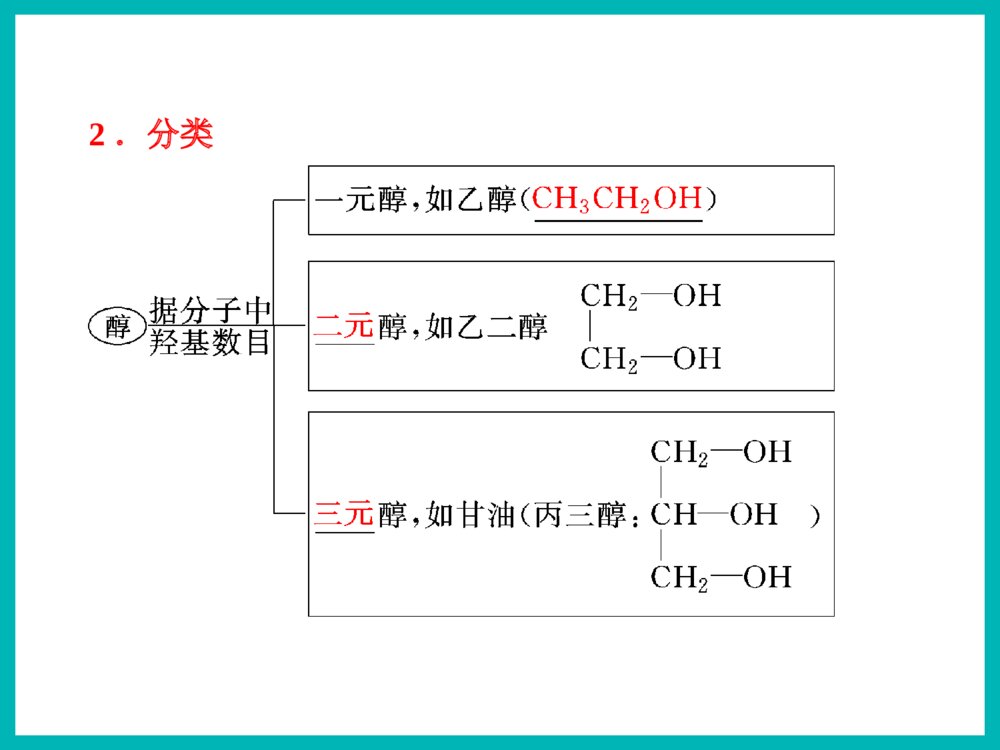
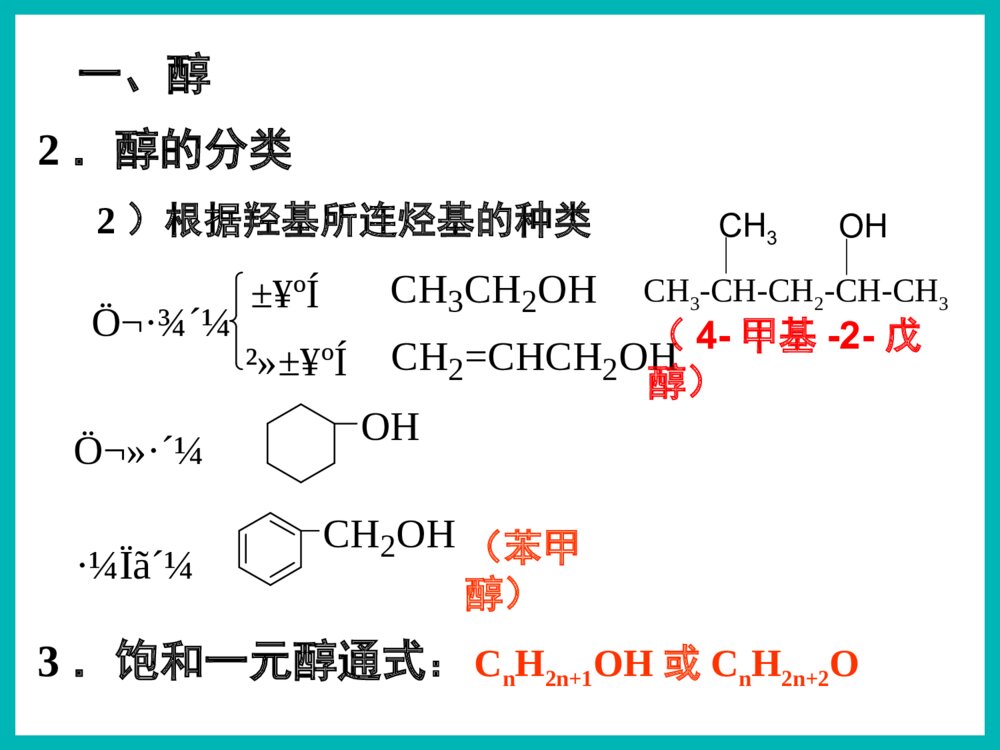
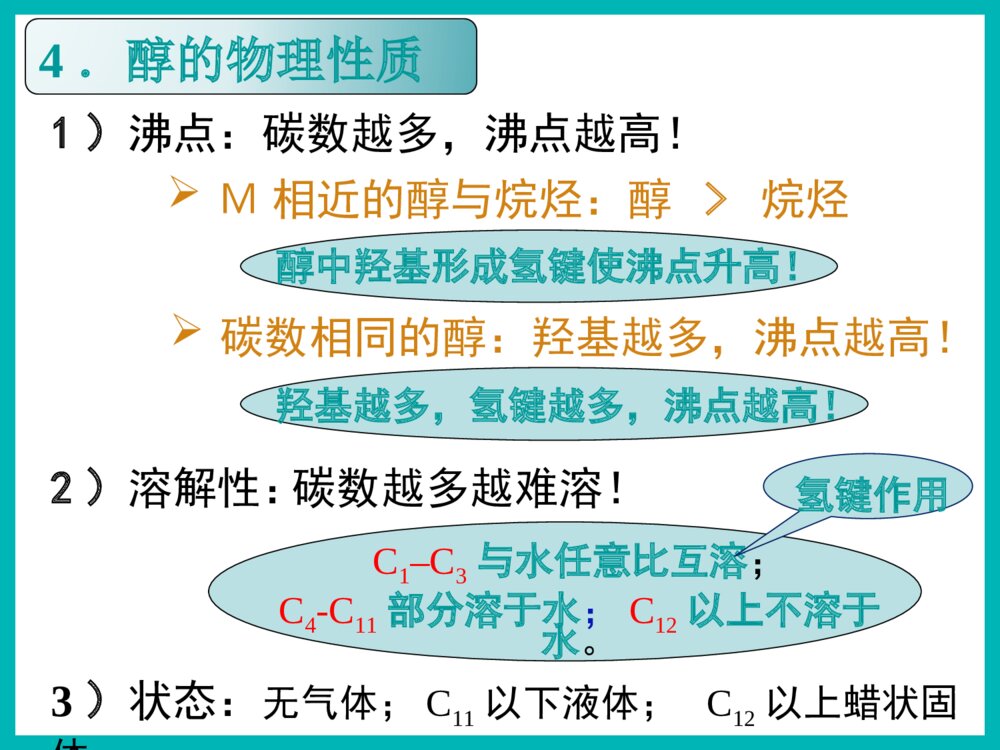
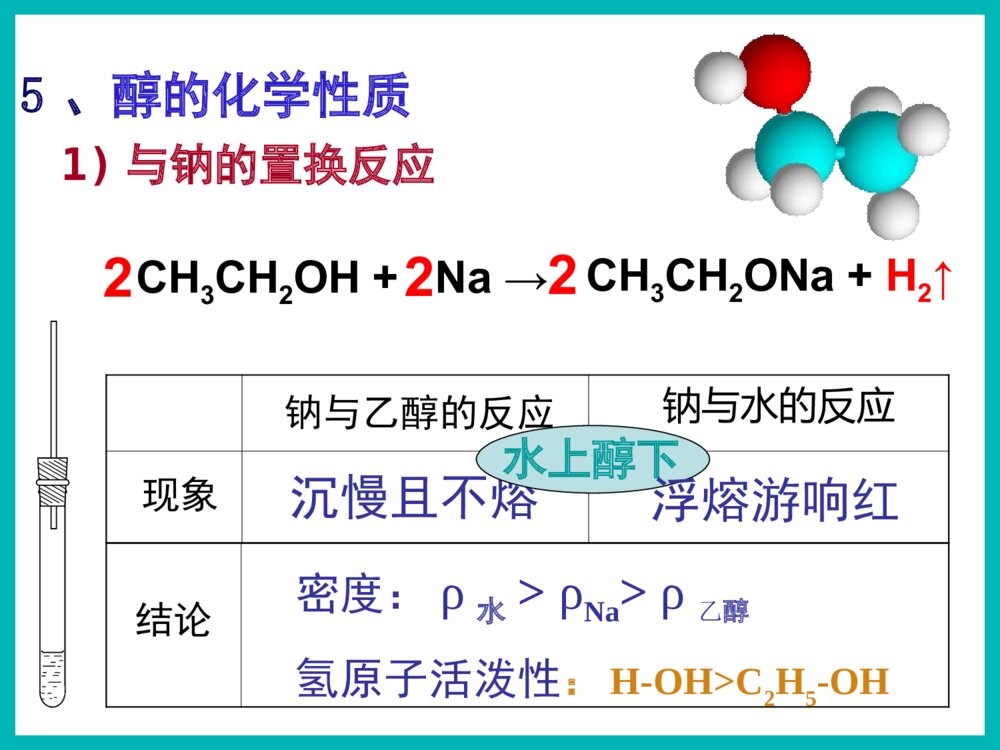
乙醇俗名:酒精醇※下列有机物属于醇类的是()ACCH3OHACH2OHBOHC|OHDCOHOE1)根据羟基的数目CH2-OHCH2OHCH2-OHCH-OHCH2OH配制化妆品工业酒精有毒!2.醇的分类汽车防冻剂丙三醇俗称甘油乙二醇甲醇一元醇二元醇三元醇CH3OH一、醇1,2,3-丙三醇1.官能团:——羟基(-OH)2.分类Ö¬·¾´¼Ö¬»·´¼·¼Ïã´¼±¥ºÍ²»±¥ºÍCH3CH2OHCH2=CHCH2OHOHCH2OHCH3-CH-CH2-CH-CH3CH3OH一、醇2.醇的分类2)根据羟基所连烃基的种类(苯甲醇)(4-甲基-2-戊醇)3.饱和一元醇通式:CnH2n+1OH或CnH2n+2O思考与交流2、相对分子质量相近的醇和烷烃相比,谁的沸点更高,为什么?3、为什么甲醇、乙醇、丙醇均可与水以任意比例混溶?1、醇类的物理性质有何规律?2)溶解性:3)状态:无气体;C11以下液体;C12以上蜡状固体。醇中羟基形成氢键使沸点升高!Μ相近的醇与烷烃:醇>烷烃碳数相同的醇:羟基越多,沸点越高!1)沸点:碳数越多,沸点越高!羟基越多,氢键越多,沸点越高!C1–C3与水任意比互溶;C4-C11部分溶于水;C12以上不溶于水。氢键作用碳数越多越难溶!4.醇的物理性质结论钠与水的反应钠与乙醇的反应沉慢且不熔5、醇的化学性质密度:ρ水>ρNa>ρ乙醇1)与钠的置换反应水上醇下现象浮熔游响红氢原子活泼性:H-OH>C2H5-OHCH3CH2OH+Na→CH3CH2ONa+H2↑2225、醇的化学性质1)与钠的置换反应——羟基氢N(-OH):N(H2)=2:1N(-OH):N(Na)=1:1如何证明置换的是羟基H而不是烃基H?BC测定乙醇与钠反应产生氢气体积的装置CH3CH2OH+Na→CH3CH2ONa+H2↑2225、醇的化学性质+Na→CH2OHCH2OH+H2↑CH2ONaCH2ONa+Na→CH2OHCHOHCH2OH+H2↑CH2ONaCHONaCH2ONa1)与钠的置换反应——羟基氢CH2OH+Na→CH2ONa+H2↑22222263N(-OH):N(H2)=2:1N(-OH):N(Na)=1:1【例1】0.1mol某有机物完全燃烧后生成0.3molCO2,同质量的该有机物与足量的金属钠反应生成0.1molH2,该有机物可能是()A.丙三醇B.1,2-丙二醇C.丙醇D.乙二醇B练一练3)与氢溴酸的取代反应----羟基R-OH+HXR-X+H2OCH3CH2-OH+HBrCH3CH2Br+H2O2)与酯的取代(酯化)反应----酸脱羟基醇脱氢C2H5OH+CH3-C-OHCH3-C-O-C2H5+H2OOOŨH2SO45、醇的化学性质Cu△O—HCH3—C—HH+O2去氢机理:失去羟基氢和羟基相连碳上的氢4)醇的催化氧化5、醇的化学性质CH3—C—HO+H2OCH3CCCHOCH3OHO+O2(足量)【思考】Cu?△去氢CH3OHCH3CH2CH2OHOHCH3CH2CHCH3CH3CHCH3OHCH3CHCH2OHOHCH3CH2CHOHCHOCH3CCH3OCH3CH2CCH3OCH3CCHOO1.2.4.5.3.CH3CCH3OHCH37.CH2OHCH2OH6.CHOCHO不能被氧化2CH3CH2OH+O22CH3CHO+2H2OCu4)醇的催化氧化5、醇的化学性质2Cu+O2====2CuO△△CuO+CH3CH2OH→CH3CHO+H2O+Cu变黑又变红且有刺激性气味气体在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应是反应(填放热或吸热)。【例】某实验小组用下列装置进行乙醇的催化氧化实验。(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式:2Cu+O22CuO△CH3CH2OH+CuOCH3CHO+Cu+H2O△放热乙的作用是:。甲的作用是:;(2)甲和乙两个水浴作用不相同。加热乙醇,使其挥发与空气中的氧气充分混合冷却,使生成的乙醛冷凝成为液体【探究】某实验小组用下列装置进行乙醇的催化氧化实验。(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。(3)反应进行一段时间后:试管a中能收集到不同的物质,它们是。集气瓶中收集到的气体的主要成是。乙醛、乙醇、水氮气(少量氧气等)乙酸【探究】某实验小组用下列装置进行乙醇的催化氧化实验。氧化氧化CH3CH2OH乙醇CH3CHO乙醛CH3COOH乙酸现象:酸性高锰酸钾溶液褪色CH3CH2OHCH3COOH酸性高锰酸钾或重铬酸钾5)被高锰酸钾或重铬酸钾氧化5、醇的化学性质应用:用重铬酸钾检验酒驾K2Cr2O7Cr3+(橙红色)(绿色)6)醇的脱水反应浓硫酸170℃CH3CH2—OH+H—OC2H5浓硫酸140℃5、醇的化学性质C2H5OC2H5+H2O②分子间脱水脱去羟基与邻碳的氢(消去反应)CH2=CH2↑+H2O①分子内脱水CH2—CH2OHH(取代反应)甲醚CH3—O—CH3甲乙醚CH3—O—C2H5乙醚下列醇能发生消去反应生成物有同分异构体的是()B.CH3CHCH3OHA.CH3CHCH2CH3OHCH2=CHCH2CH3CH3CH=CHCH3CH2=CHCH3C.CH3CH2CH2OHCH2=CHCH3CH3CH3CH3CCH2OHD.A练一练反应断键位置与金属钠反应Cu或Ag催化氧化浓硫酸加热到170℃浓硫酸条件下与乙酸加热②④①③①①④①③H—C—C—O—HHHHH②请推测下列醇能发生哪类反应?氧化反应消去反应取代反应置换反应ABCDABCDABDB强氧化剂氧化成酸催化氧化成酮催化氧化成醛ACACA.CH3CH2CH2OHB.(CH3)2CHOHC.(CH3)3CCH2OHD.(CH3)3COH(酯化、分子间脱水、与HX)(与活泼金属)(分子内脱水)燃烧生成CO2和H2OABCD醇除去SO2、CO2、乙醇混合液温度要迅速升到170℃需加沸石或碎瓷片防暴沸浓硫酸作催化剂、脱水剂混合液颜色如何变化?为什么?温度计应放在反应液中乙烯中会混有哪些气体?测反应液温度140℃时乙醇会生成乙醚液体逐渐变黑!浓硫酸使酒精炭化!CO2、SO2、乙醇、乙醚浓硫酸170℃CH2=CH2↑+H2OCH3—CH2OH如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置。请回答:(1)实验步骤:①;②在各装置中注入相应的试剂(如图所示)③;实验时,烧瓶中液体混合物逐渐变黑。(2)能够说明乙烯具有还原性的现象是;装置甲的作用是。若无甲装置,是否也能说明乙烯具有还原性,简述其理由:组装仪器,检验装置的气密性加热,使温度迅速升到170℃乙中KMnO4酸性溶液紫色褪去 除去乙烯中混有的SO2、CO2等酸性气体 不能,SO2具有还原性,也可以使KMnO4酸性溶液褪色2、作溶剂。3、化工原料,制乙酸、乙醚等。4、制造饮料、香精。5、医疗上用75%(体积分数)的酒精作消毒剂。1、作燃料。无水乙醇的制备:工业酒精(96%的酒精)加CaO蒸馏无水酒精(99.5%以上)如何检验乙醇中是否含水?有水可使无水硫酸铜变蓝!乙醇的用途:2.能用来检验酒精中是否含有水的试剂是()A.CuSO4·5H2OB.无水硫酸铜C.浓硫酸D.金属钠3.在下列物质中加入溴水数滴,振荡,溴水不褪色的是()A.NaOH溶液B.酒精C.SO2溶液D.氢硫酸溶液BB1.关于乙醇的结构与性质,下列说法错误的是( )DCH2CH2CH3CH2OH原料分子目标分子HOCOCOOCH2CH2OnHCOOHCOOHCH2CH2OHOHBrCH2BrCH21、物理性质一、乙醇颜色:气味:状态:密度:溶解性:挥发性:无色透明特殊气味液体比水小(0.7893g/cm3)跟水以任意比例互溶能够溶解多种无机物和有机物沸点低,易挥发结构式:分子式:结构简式:二、乙醇的分子结构C2H6OCH3CH2OH或C2H5OHCHHHHCHHO官能团:羟基写作-OH1)CH3CH2CH2OH3)CH3—C—OHCH3CH3醇催化氧化的产物与醇结构的关系:伯醇------醛------羧酸仲醇------酮叔醇不能催化氧化OH2)CH3CHCH3想一想:在必修2中,我们都学过乙醇的哪些化学性质?三、乙醇化学性质:⑤④②①③HHHHHCCOH想一想:在必修2中,我们都学过乙醇的哪些化学性质?三、乙醇化学性质:⑤④②①③HHHHHCCOH



















