





《新课标人教版化学选修4 《化学反应与能量的变化》PPT课件》是由用户上传到老师板报网,本为文库资料,大小为5.4 MB,总共有22页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 22页
- 5.4 MB
- VIP模板
- ppt
- 数字产品不支持退货
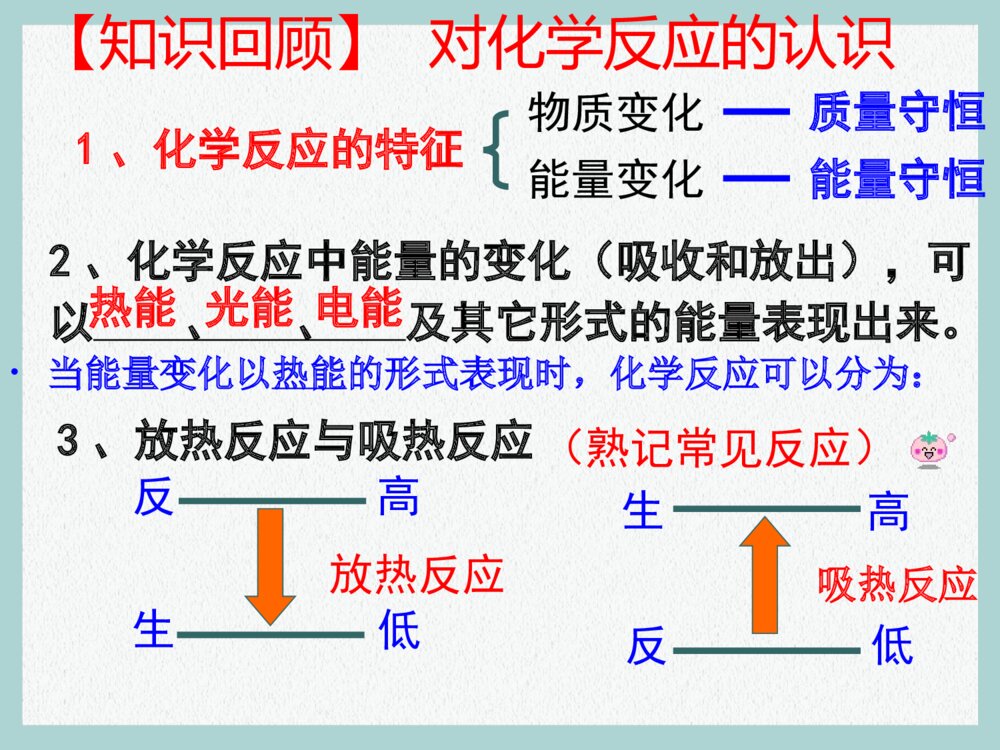
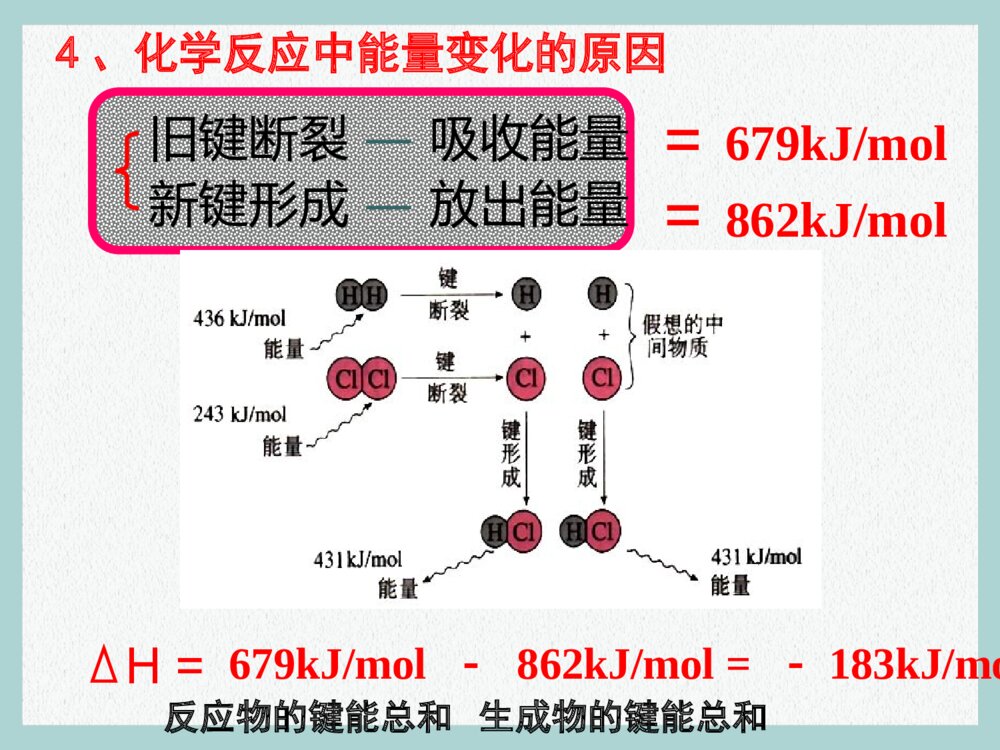
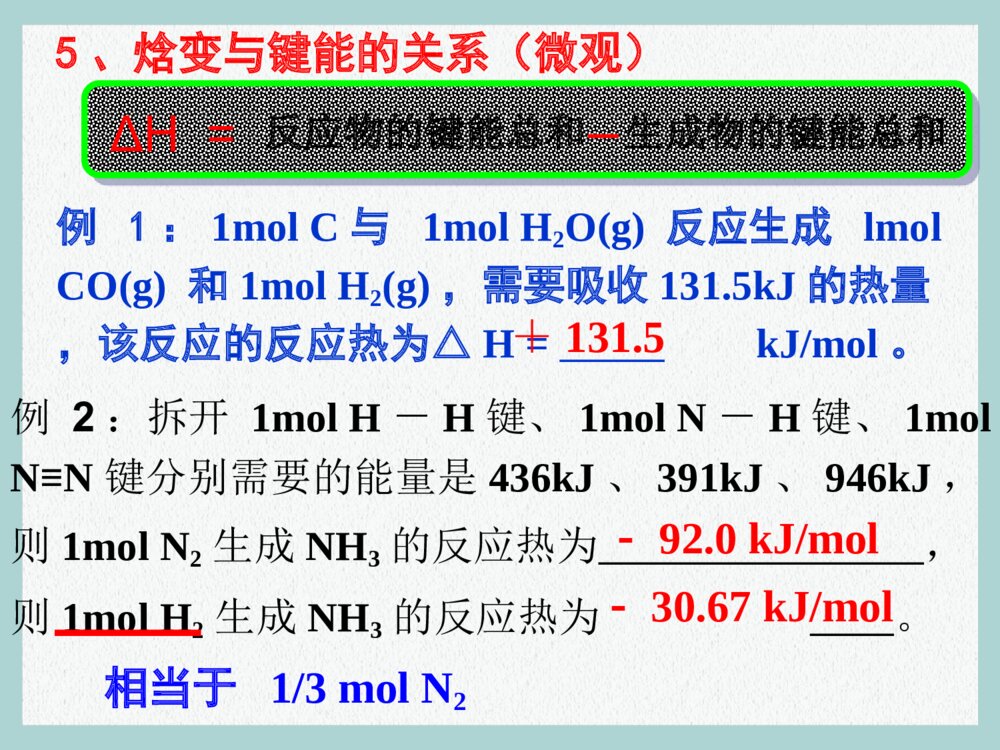
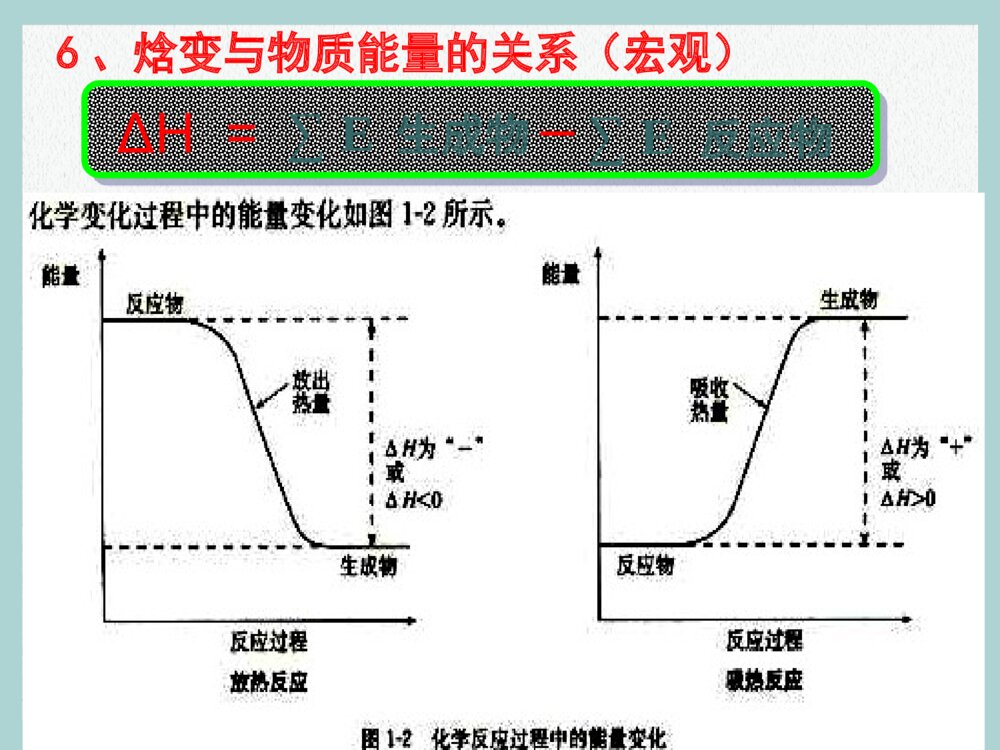
第一章化学反应与能量第一节化学反应与能量的变化新课标人教版化学选修4“迪尔摇”系列摇冷摇热饮料是由北京世纪通投资集团下属的全资子公司北京迪乐创新科技有限公司开发生产的独家专利产品。产品只需轻轻一摇就会在瞬间变冰或变热,操作简单快捷。这种摇冷、摇热饮料是在饮料罐的夹层中分别装有某种物质,摇动混合后产生热效应引起的。【提示】 摇冰饮料:硝酸铵和水摇热饮料:生石灰和水。【知识回顾】对化学反应的认识1、化学反应的特征能量变化能量守恒2、化学反应中能量的变化(吸收和放出),可以、、及其它形式的能量表现出来。光能热能电能•当能量变化以热能的形式表现时,化学反应可以分为:3、放热反应与吸热反应反高生低生高反低放热反应吸热反应(熟记常见反应)物质变化质量守恒类型 比较放热反应吸热反应常见反应(1)大多数化合反应(2)所有的燃烧反应(3)酸碱中和反应(4)活泼金属与稀酸反应(1)大多数分解反应(2)某些盐的电离(3)Ba(OH)2·8H2O与NH4Cl的反应(4)C和CO2、C和H2O(g)的反应(5)水解反应常见反应能量变化类型一、反应热:化学反应中所吸收或放出的热量。恒温恒压下,反应热称“焓变”。二、焓变:1、符号:2、单位:ΔHkJ/mol 或kJ • mol–13、规定:放热反应(体系能量降低):∆H<0,∆H为“-”吸热反应(体系能量升高):∆H>0,∆H为“+”如:a A(g) + b B(g) p C(g)ΔH = – m kJ/mol注:单位中的每mol是与整个反应对应的,即反应热表示每mol反应放出或吸收的热量。4、化学反应中能量变化的原因旧键断裂—吸收能量新键形成—放出能量==679kJ/mol862kJ/molH=679kJ/mol -862kJ/mol = -183kJ/mol反应物的键能总和生成物的键能总和5、焓变与键能的关系(微观)ΔH=反应物的键能总和生成物的键能总和–例1:1mol C与1mol H2O(g) 反应生成lmol CO(g) 和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H = kJ/mol。+131.5 例2 :拆开1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则1mol N2生成NH3的反应热为 ,则1mol H2生成NH3的反应热为 。-92.0 kJ/mol-30.67 kJ/mol相当于1/3 mol N26、焓变与物质能量的关系(宏观)ΔH=∑E 生成物∑E反应物–任何一个化学反应都包括物质的变化和能量的变化。那么,有什么表达式能把这两种变化都表示出来?C+O2====CO2只表示物质变化C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1【例1】在200℃、101kPa时,1 mol C与氧气作用生成CO2的反应,科学文献上表示为:则这个方程式表示1mol固态与1mol气态氧完全反应,生成1mol气态CO2时,放出393.5kJ的热量。H2 + I2 ⇋ 2HI也只表示物质变化【例2】在200℃、101kPa时,1 mol H2与碘蒸气作用生成HI的反应,科学文献上表示为:H2(g) + I2 (g) ⇋ 2HI(g)200℃101kPaΔH = -14.9 kJ/mol三、热化学方程式:能表示参加反应物质的量和反应热的关系的化学方程式。1、定义:2、含义:表示1mol气态H2与1mol气态碘完全反应,生成2mol气态HI时,放出14.9kJ的热量。三、热化学方程式:3、书写要点: ①H2 (g) + O2(g) = H2O(g) ;△H= – 241.8 kJ/mol21 ②H2 (g) + O2(g) = H2O(l) ;△H= – 285.8 kJ/mol21 ③2H2 (g) + O2(g) = 2H2O(l) ;△H= – 571.6 kJ/mol ④2H2O(l) = 2H2 (g) + O2(g) ;△H= + 571.6 kJ/mol△H与实验的条件、物质的状态有关!H2O(l) H2O(g)△H= + 44 kJ/mol三、热化学方程式:3、书写要点:⑴一般应注明反应的温度、压强;(250C,101kPa时不注明)⑵一定标明各物质的状态(s、l、g、aq );⑶ΔH只放右边(数值及单位);放热:ΔH<0;吸热:ΔH>0;⑷系数仅仅表示物质的量,不表示分子或原子个数;故系数可以是整数、分数、小数;⑸ΔH的值与系数相匹配。 系数加倍,ΔH值也加倍。正逆反应的ΔH绝对值相等,符号相反。10⑹反应物完全变成生成物,所释放或吸收的热量。三、热化学方程式:3、书写要点:⑺热化学方程式一般不要写反应条件。例1:当1mol气态H2与1mol气态Cl2反应生成2mol气态HCl,放出184.6kJ的热量,请写出该反应的热化学方程式。H2(g) + Cl2(g) = 2HCl(g) ∆H =-184.6 kJ/mol2H2(g) + 2Cl2(g) = 4HCl(g) ∆H =-369.2 kJ/mol H2(g) + Cl2(g) = HCl(g) ∆H =-92.3 kJ/mol1212例2、沼气的主要成分是甲烷。0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。则下列热化学 方程式中正确的是()A、2CH4( g ) +4O2( g ) =2CO2( g ) +4H2O ( l ) ΔH = + 890 kJ/mol B、CH4 +2O2 =CO2 +H2O ΔH = – 890 kJ/mol C、CH4 ( g ) +2 O2 ( g ) =CO2 ( g ) +2 H2O ( l ) ΔH = – 890 kJ/mol D 、1/2CH4 ( g ) +O2 ( g ) =1/2CO2 ( g ) +H2O ( l ) ΔH = – 890 kJ/mol C状态ΔH = – 445 kJ/mol 例3、已知:H2(g) + Cl2(g) = 2HCl(g) △H= –184.6kJ/mol 则反应HCl(g) = 1/2H2(g) + 1/2Cl2(g) 的△H 为()DA 、+184.6 kJ/mol B 、-92.3 kJ/molC 、-369.2 kJ/mol D 、+92.3 kJ/mol例4、白磷与氧可发生如下反应:P4+5O2=P4O10 。 已知断裂下列化学键需要吸收的能量分别为 :P—P akJ·mol—1、P—O b kJ·mol—1、 P=Oc kJ·mol—1、O=O dkJ·mol—1。根据图 示的分子结构和有关数据估算该反应的△H ,其中正确的是 A.(6a+5d-4c-12b)kJ·mol—1 B.(4c+12b-6a-5d)kJ·mol—1 C.(4c+12b-4a-5d)kJ·mol—1 D.(4a+5d-4c-12b)kJ·mol—1(A)SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1mol S (s)转化为气态硫 原子吸收能量280kJ,断裂1mol F-F 、S-F键需吸收的能量分别为160kJ、330kJ。 则S(s)+3F2 (g)=SF6(g)的反应热△H 为()A.-1780kJ/mol B.-1220 kJ/molC.-450 kJ/mol D.+430 kJ/mol例5:B已知常温常压下,N2(g)+3H2(g) ⇋ 2NH3(g);△H=-92.4kJ/mol。在同温同温下向密闭容器中通入1mol N2和3mol H2,达到平衡时放出热量为Q1kJ,向另一体积相同的容器中通入0.5mol N2、1.5mol H2和1mol NH3,相同条件下达到平衡时放出热量为Q2kJ ,则下列关系式正确的是()A.Q2



















