






《电化学原理PPT课件下载(共42页)》是由用户上传到老师板报网,本为文库资料,大小为3.2 MB,总共有42页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 42页
- 3.2 MB
- VIP模板
- ppt
- 数字产品不支持退货
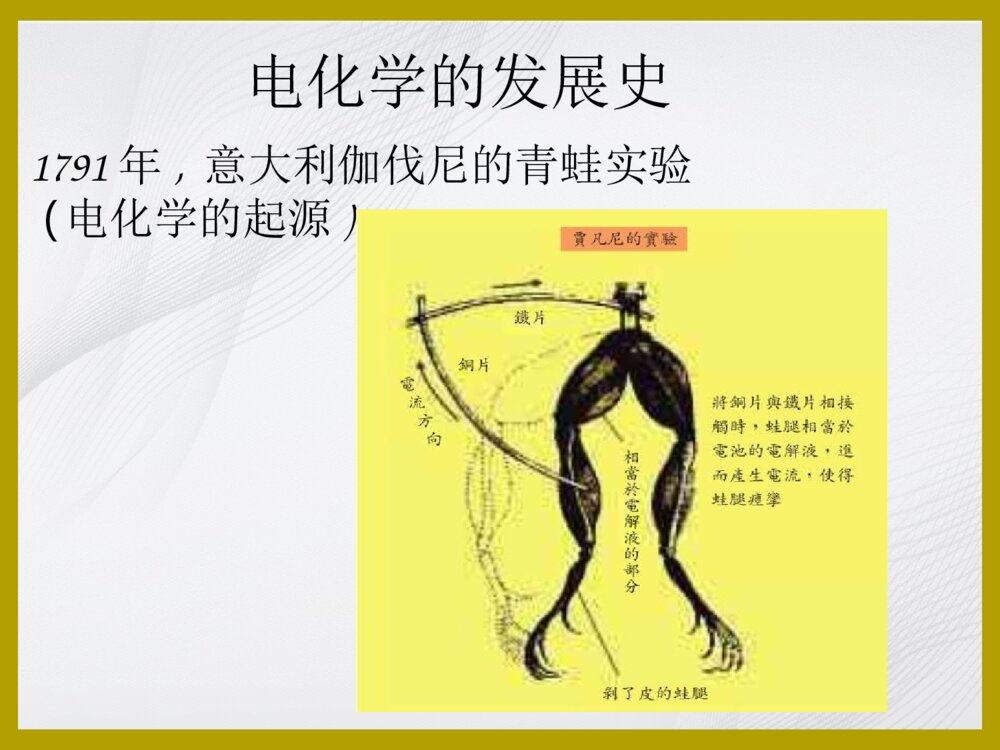
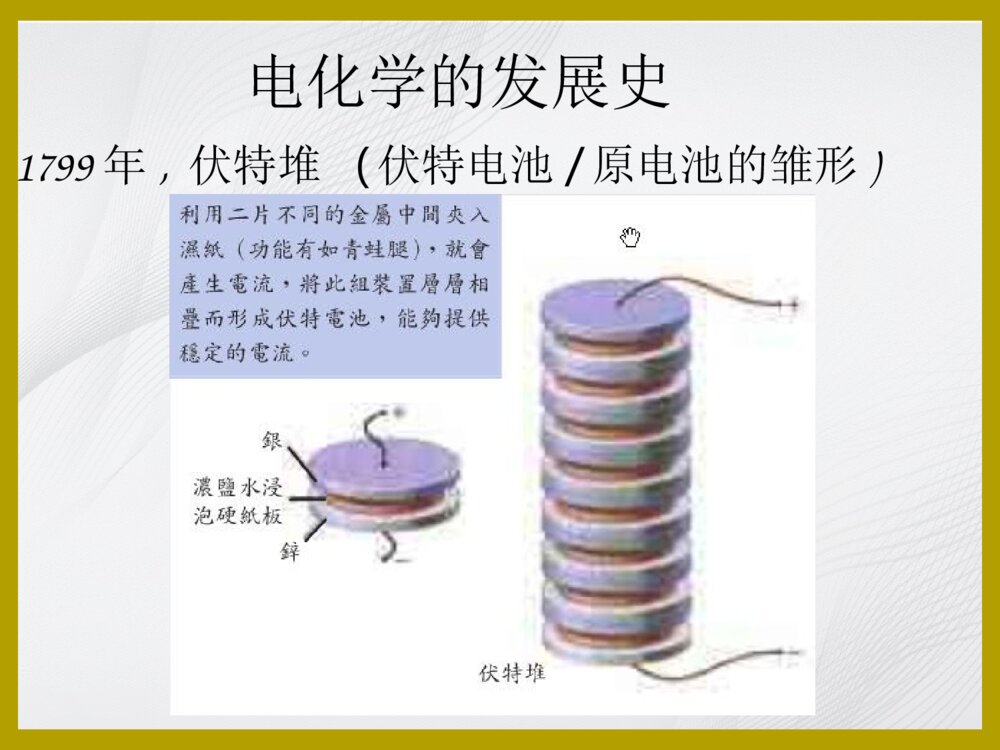
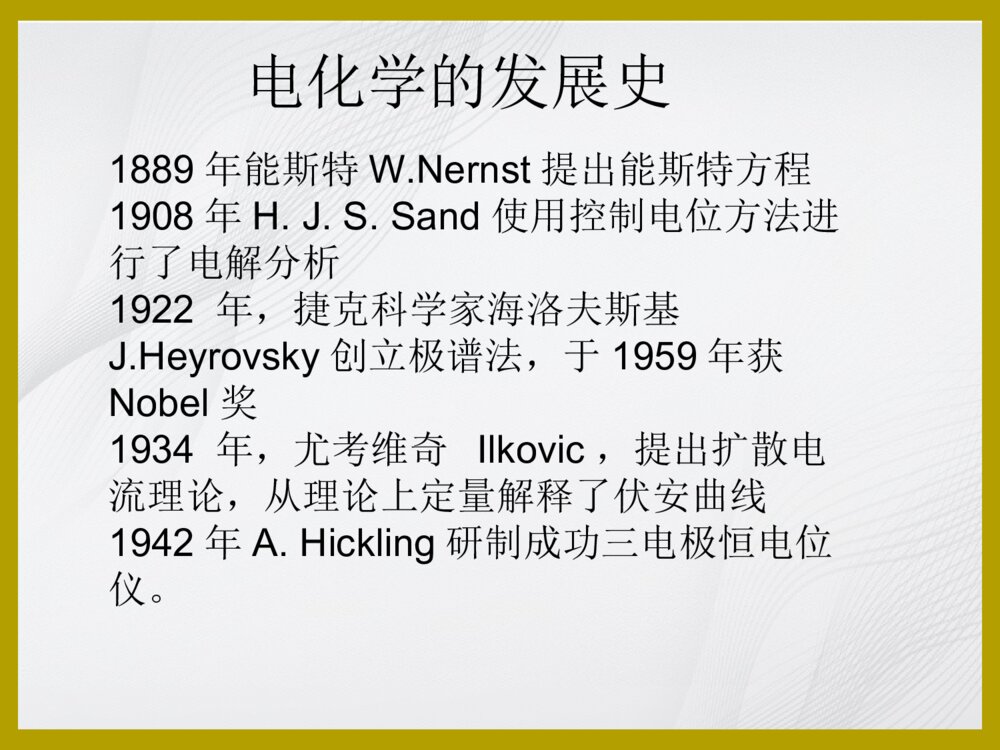
电化学电化学课程安排一、电化学的发展史二、电化学原理简介(以三电极体系,循环伏安法为例)三、电化学的应用1.小分子(抗氧化剂)的研究2.蛋白质的电子传递研究3.核酸检测电化学的发展史公元前600年,希腊泰尔斯发现摩擦的琥珀能吸引轻小物体电化学的发展史1752年,美国富兰克林进行风筝实验,并以此为基础设计了避雷针。1753年,俄国著名电学家利赫曼为了验证富兰克林的实验,不幸被雷电击死,这是做电实验的第一个牺牲者。1791年,意大利伽伐尼的青蛙实验(电化学的起源)电化学的发展史1799年,伏特堆(伏特电池/原电池的雏形)电化学的发展史电化学的发展史1807年,戴维电解木灰(potash)和苏打(soda),分别得到钾(potassium)和钠(sodium)元素戴维(HumphryDavy1778-1829)电化学创始人1833年,法拉第电解定律电化学的发展史法拉第(MichaelFaraday1791-1867)法拉第电解定律:Q=nFMQ:电解消耗的电量n:化合价F:法拉第常数1F=96487库仑/摩尔M:该物质的摩尔数电化学的发展史1889年能斯特W.Nernst提出能斯特方程1908年H.J.S.Sand使用控制电位方法进行了电解分析1922年,捷克科学家海洛夫斯基J.Heyrovsky创立极谱法,于1959年获Nobel奖1934年,尤考维奇Ilkovic,提出扩散电流理论,从理论上定量解释了伏安曲线1942年A.Hickling研制成功三电极恒电位仪。电分析成为独立的方法学•三大定量关系的建立1833年法拉第定律Q=nFM1889年能斯特W.Nernst提出能斯特方程1934年尤考维奇D.Ilkovic提出扩散电流方程Id=kC近代电分析方法(1)电极的发展:化学修饰电极、超微电极(2)多学科参与:生物电化学传感器(3)与其他方法联用:光谱-电化学、HPLC-EC、AFM-EC、SPR-EC(4)集成化:电化学芯片电化学分析的定位•光谱分析(紫外/荧光/拉曼…)•电化学分析(电位、电流、电导、电量分析…循环伏安/计时安培/交流阻抗…)•色谱分析(液相/气相)二、电化学的基本原理原电池与电解池原电池:能自发地将化学能转化为电能电解池:需要消耗外部电源提供的电能,使电池内部发生化学反应无/有液体接界电池发生氧化反应的电极称为阳极,发生还原反应的电极叫做阴极。一般把作为阳极的电极和有关的溶液体系写在左边,把作为阴极的电极和有关的溶液体系写在右边。每一个不同相的界面用一竖线表示,盐桥用两条竖线表示。化学电池的阴极和阳极例:Zn+CuSO4ZnSO4+Cu阳极Zn–2e→Zn2+阴极Cu2++2e→Cu原电池表示:Zn∣ZnSO4CuSO4∣Cu‖电极和电极电位电极:在电化学电池中赖以进行电极反应和传导电流从而构成回路的部分。电极的电极电位:在电极与溶液的两相界面上,存在的电位差即为电极的电极电位。电化学三电极系统•工作电极(Workingelectrode)•参比电极(Referenceelectrode)•对电极(Auxiliaryelectrode)工作电极滴汞电极(极谱法)铂电极金电极碳电极热解石墨(PG)玻碳(GC)碳糊碳纤维参比电极绝对电极电位无法得到,因此只能以一共同参比电极构成原电池,测定该电池电动势。常用的参比电极有标准氢电极(见图)和饱和甘汞电极(见图)。标准氢电极电极反应为:•规定在任何温度下,氢标准电极电位为零。2eH22H++甘汞电极:电极反应:Hg2Cl2(s)+2e=2Hg+2Cl−能斯特公式为:由此可见:甘汞电极的电位取决于所用KCl的浓度。利用KCl饱和溶液便制成饱和甘汞电极(saturatedcalomelelectrode,SCE)以标准氢电极的电极电势为标准,可以测得SCE的电势为0.2415V。1.导线;2.KCl饱和溶液;3.Hg2Cl2;4.多孔物质;5.胶帽;6.导线;7.Hg;8.纤维)L/]/(1molCllog[059.0L/1mol][Cl1log2059.00/HgClHg20/HgClHg2222)(参比电极对电极一般使用惰性贵金属材料如铂丝等,以免在此表面发生化学反应,用于与工作电极形成回路。对电极(辅助电极)电化学工作站循环伏安法(CyclicVoltammetry)•基本原理以一定的速率对工作电极施加三角波电压,使电极上交替发生还原和氧化反应,并记录电流-电势曲线。三角波电压循环伏安曲线循环伏安图铁氰化钾/亚铁氰化钾的循环伏安图Fe(CN)63-+e=Fe(CN)64-Fe(CN)64--e=Fe(CN)63-几个重要的参数•两个峰电位阳极/氧化峰电位(Epa)阴极/还原峰电位(Epc)•两个峰电流阳极/氧化峰电流(ipa)阴极/氧化峰电流(ipc)氧化过程还原过程电位可定性!电流可定量!•氧化还原电对的表观标准电极电位E0’=(Epa+Epc)/2•两峰的电位差ΔEp=Epa-Epc=0.059/n(n为得失电子数,仅适用于可逆反应)Q:已知铁氰化钾的ΔEp=0.08V,那么铁氰化钾的电极反应参与的电子数是多少?几个重要的参数电极过程可逆性的判断•可逆过程(如图A)两峰的电位差ipa/ipc≈1•准可逆过程(如图B)ΔEp>0.059/n,ipa/ipc<1或>1•不可逆过程(如图C)只有一个峰表观电位与电解液pH的关系•对于质子参与的电化学过程:ΔE0’=(-0.058/n)*ΔpH(n为质子数)•即对于有一个质子参与的电化学反应,溶液pH每增加1,其表观电极电位移动的理论数值为-0.058VpH梯度实验Q:已知其电位随pH的变化为-0.032V/pH,那么几个质子参与其中?A:某物质的循环伏安响应随pH的变化图扩散控制下的理论电流电化学物质平面扩散到面积为A的电极,假定扩散系数为D,浓度为C,传递电子数为n,v是扫描速率,根据RandlesSevcik方程可以得到一个理论电流值ip:•电流与电极面积成正比——用于计算电极有效表面积•与物质浓度成正比——定量分析的基础•与扫描速度的平方根成正比——判断反应类型的依据浓度梯度实验扫描速度变化实验一峰电流值与扫描速度的平方根成正比—扩散控制扫描速度变化实验二峰电流值与扫描速度成正比—吸附控制循环伏安法的适用范围•研究一个新物质的电化学性质时的首选•用于电极反应的性质、机理和电极过程动力学参数的研究•可用于定量分析•其他其他电化学方法•示差脉冲伏安法(DPV)•方波伏安法(SWV)•交流阻抗法(EIS)•计时安培法•……更灵敏的检测方法循环伏安法检测限10-5mol/L改变加载电位的波形示差脉冲伏安法(DPV)检测限10-8mol/L方波伏安法(SWV)扫描速率快示差脉冲伏安法DPVDifferential-PulseVoltammetry示差脉冲伏安法的激发信号(施加的电压)示差脉冲伏安图Differential-pulsevoltammogramsfora1.3×10−5Mchloramphenicolsolution.方波伏安法SWVSquare-waveVoltammograms方波伏安法的激发信号(施加的电压)方波伏安图Square-wavevoltammogramsforTNTsolutionsofincreasingconcentrationfrom1to10ppm(curvesb–k),alongwiththebackgroundvoltammogram(curvea)andresultingcalibrationplot(inset).



















