








《应用电化学PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为11.17 MB,总共有52页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 52页
- 11.17 MB
- VIP模板
- ppt
- 数字产品不支持退货
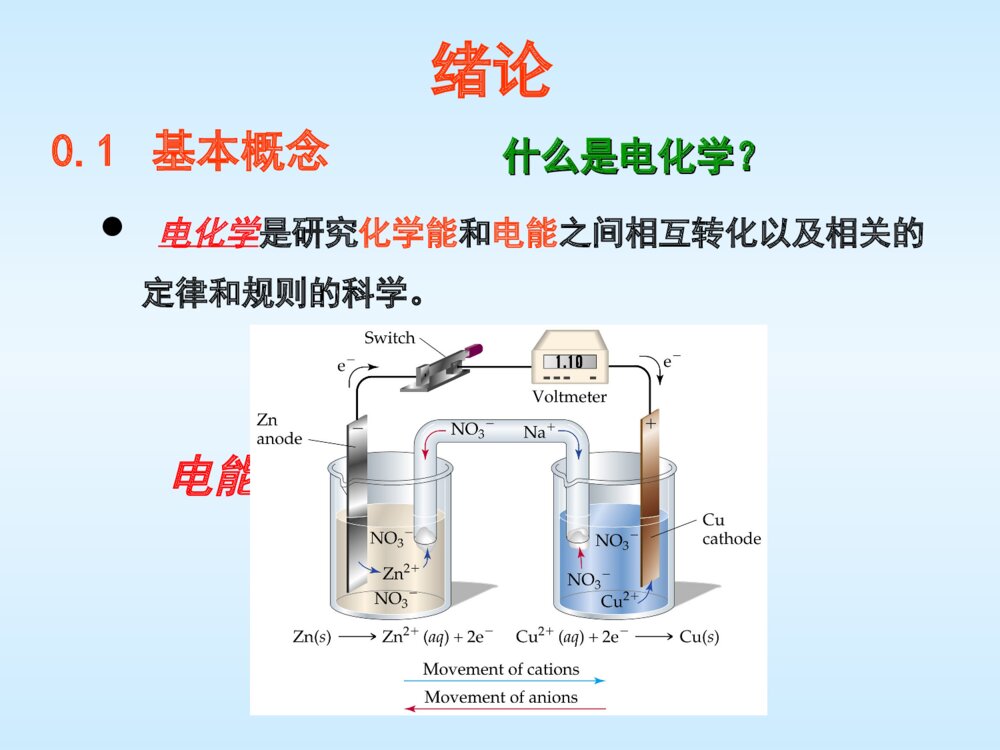
应用电化学AppliedElectrochemistry教材:《应用电化学》杨辉,卢文庆编著,科学出版社2013年春季学期参考书目1.电极过程动力学导论(第三版),查全性2.电化学方法:原理和应用(第二版),巴德等3.电化学原理(修订版)或(第三版),李荻4.电化学,吴辉煌主编,化学工业出版社5.电化学测量方法,贾铮等编著,化学工业出版社6.应用电化学,杨绮琴等编著,中山大学出版社7.应用电化学,祁鲁生等编著,华中理工大学出版社8.应用电化学,贾梦秋、杨文胜编著,高等教育出版社成绩组成•平时成绩:30分(课堂表现、作业)•期末考试:70分,闭卷绪论什么是电化学?什么是电化学?电化学是研究化学能和电能之间相互转化以及相关的定律和规则的科学。电能化学能电解池原电池0.1基本概念•电化学是研究离子导体的物理化学性质以及电子导体(electrode,金属、半导体)和离子导体(electrolyte,电解质溶液、熔盐、固体电解质)之间的界面上所发生的各种伴有电现象的反应过程的科学。电化学经典电化学—电解质溶液理论现代电化学—电子/离子导体界面效应两类导体A.自由电子作定向移动而导电B.导电过程中导体本身不发生变化C.温度升高,电阻也升高D.导电总量全部由电子承担又称电子导体,如金属、石墨等。1.第一类导体两类导体A.正、负离子作反向移动而导电B.导电过程中有化学反应发生C.温度升高,电阻下降D.导电总量分别由正、负离子分担⒉⒉第二类导体第二类导体又称离子导体,如电解质溶液、熔融电解质等。*固体电解质,如等,也属于离子导体,但它导电的机理比较复杂,导电能力不高,一般以讨论电解质水溶液为主。2AgBrPbI、正极、负极电势低的极称为负极,电子从负极流向正极。负极:负极:电势高的极称为正极,电流从正极流向负极。正极:正极:阴极、阳极发生还原作用的极称为阴极,在原电池中,阴极是正极;在电解池中,阴极是负极。阴极:阴极:(Cathode)(Cathode)发生氧化作用的极称为阳极,在原电池中,阳极是负极;在电解池中,阳极是正极。阳极:阳极:(Anode)(Anode)离子迁移方向:AnionAnode阴离子迁向阳极CationCathode阳离子迁向阴极原电池(galvaniccell)Cu2++2e-→Cu(S)发生还原作用,是阴极。电流由Cu极流向Zn极,Cu极电势高,是正极。CuCu电极电极::Zn(S)→Zn2++2e-发生氧化作用,是阳极。电子由Zn极流向Cu极,Zn极电势低,是负极。ZnZn电极电极::电解池(electrolyticcell)与外电源正极相接,是正极。发生氧化反应,是阳极。Cu(S)→Cu2++2e-电极②:电极②:与外电源负极相接,是负极。发生还原反应,是阴极。Cu2++2e-→Cu(S)电极①:电极①:①①②②法拉第定律的文字表述Faraday’sLaw⒈在电极界面上发生化学变化物质的质量与通入的电量成正比。⒉通电于若干个电解池串联的线路中,当所取的基本粒子的荷电数相同时,在各个电极上发生反应的物质,其物质的量相同,析出物质的质量与其摩尔质量成正比。法拉第定律法拉第定律的数学表达式取电子的得失数为z,通入的电量为Q,则电极上发生反应的物质的量n为:电极上发生反应的物质的质量m为:z-MeMAeAzzzQmnMMzFQnzFQnzF或法拉第常数F=NA·e法拉第常数在数值上等于1mol元电荷的电量。已知元电荷电量为191.602210C=6.022×1023mol-1×1.6022×10-19C=96484.6C·mol-1≈96500C·mol-1荷电粒子基本单元的选取根据法拉第定律,通电于若干串联电解池中,每个电极上析出物质的物质的量相同,这时,所选取的基本粒子的荷电绝对值必须相同。例如:荷一价电荷一价电阴极阳极2111H,Cu,Au2232211O,Cl42荷三价电荷三价电阴极阳极23H,Au22233O,Cl42荷二价电荷二价电阴极阳极22H,Cu,Au3221O,Cl2荷电粒子基本单元的选取例题:通电于溶液,电流强度,析出。已知。求:⑴通入电量;⑵通电时间;⑶阳极上放出氧气的物质的量。33Au(NO)0.025AI-1M(Au)=197.0gmolAu(s)=1.20gQt荷电粒子基本单元的选取解法一解法一取基本粒子荷单位电荷:即211Au,O341-11.20g(1)196500Cmol197.0gmol/3=1763CQnzF41763C(2)7.0510s0.025AQtI23111(3)(O)(Au)431.20g1=4.5710mol4197.0gmol/3nn荷电粒子基本单元的选取解法二解法二⑵t同上取基本粒子荷3个基本电荷:即Au,23O41-11.20g(1)396500Cmol197.0gmol=1763CQnzF2313(3)(O)(Au)41.20g3=4.5710mol4197.0gmolnn法拉第定律的意义⒈是电化学上最早的定量的基本定律,揭示了通入的电量与析出物质之间的定量关系。⒉该定律在任何温度、任何压力下均可以使用。⒊该定律的使用没有什么限制条件。电流效率表示式表示式((11))电流效率=×100%理论计算耗电量实际消耗电量表示式表示式((22))电流效率=×100%电极上产物的实际量理论计算应得量0.2电化学的发展简史1、1791年,Galvani(伽伐尼)从事青蛙生理功能的研究时,偶然构成了电化学回路,发现电堆起电现象。2、1799年,Volta(伏打)将锌片与铜片叠起来,中间用浸有硫酸的毛呢隔开,构成电堆——“伏打电堆”,世界上第一个将化学能转化为电能的化学电源。3、1800年,英国的尼科尔森和卡里斯尔采用伏特电池电解水。4、1807年,Davy电解了熔融的NaOH和KOH,制得金属K和Na。5、大量的生产实践和科学实验知识的积累推动了电化学理论工作的发展。1833年,Farady提出“法拉第定律”。6、1889年,Nerst建立了电极电势公式,提出了电极电势与电极反应各组分浓度间关系的Nerst公式。7、十九世纪70年代,Helmholtz首次提出了双电层的概念。8、1905年,Tafel测定了在各种金属上析氢的电化学反应速率,确定了氢过电势和电流密度的关系,从而提出了Tafel方程——是电化学动力学的第一定律。9、20世纪40年代,前苏联科学家弗卢姆金从化学动力学角度做了大量工作,后来英美科学家在这方面又做了若干奠基性工作,推动了电化学理论的发展,开始形成以研究电极反应速率及其影响因素为主要对象的电极过程动力学,并使之称为现在电化学的主体。10、20世纪后半期,电化学科学又有了迅速发展,出现了量子电化学、生物电化学等分支学科。11、我国在电化学方面做出重要贡献的科学家:中科院院士査全性、田昭武、田中群,中国工程院院士衣宝廉等。0.3电化学反应的主要特点:1.特殊的氧化还原反应(redosreaction);2.特殊的异相催化反应:电极电位不同,催化能力不同电极电位改变,可以大幅影响催化能力电极电位连续可调,催化活性连续变化3.氧化还原等当量进行,得失电子数相同;4.电极反应一般在常温常压下进行,反应所用氧化剂或还原剂为电子,环境污染少。0.4电化学的应用电化学是一门具有广泛应用领域的重要交叉学科,在解决能源、材料、生命以及环境等重大问题上发挥着重要的作用。化学电源(电池、燃料电池)金属腐蚀与防护(牺牲阳极Mg保护铁管)电化学表面处理(电镀、抛光)电解冶金(提取Al、Mg,精炼Cu)无机与有机电合成(氯碱工业)环境保护电化学(废水处理)生物电化学(治疗和诊断)电化学分析(传感器,痕量分析)手机、计算器、手提电脑、照相机、摄像机等的电池,汽车的蓄电池,燃料电池-化学电源,利用电化学原理制备的电化学品电身边的电化学手表外壳、手机外壳、自行车钢圈、芯片电路-电镀铝、锌、铜(电线、家用锅,各种电器原件、飞机壳体等)-电解制备铁生锈-电化学过程。防腐-电化学方法NaOH,漂白剂次氯酸钠,双氧水,高锰酸钾,重铬酸钾、二氧化锰,原子反应堆氢弹等用的重水-电化学合成煤气(CO)报警器,交警检测司机喝酒量的检测器,糖尿病人监测血液中葡萄糖含量的检测仪-电化学传感器钢铁厂、纺织厂、化工厂、制药厂以及矿山等排放废水中氰、砷的处理;生活污水,造纸厂、印染厂、食品及酿酒厂废水中有机耗氧物的处理,医院污水中病菌、病毒和寄生虫卵等致病微生物的处理-环境电化学问题:神州六号,嫦娥登月飞船、舰船潜艇中用到哪些电化学知识?脑电图、心电图等诊断技术;治疗尿毒症的人工肾脏,电化学治癌,电化学控制药物释放-电化学在医学上的应用Nature448,600-603(2August2007)Behaviouralimprovementswiththalamicstimulationafterseveretraumaticbraininjury38岁的男子在一次袭击中脑部受伤,6年来,他的肢体一直没有做出过任何有意义的动作,美国韦尔-康奈尔医学院的尼古拉斯·希夫博士领导的研究小组在该男子的脑中植入了数个电极,通过开、关电极来进行一种深度脑刺激治疗,经过6个月治疗,他已经可以用短促但能听得见的声音讲话。电化学在生物和医学中应用的突破装备德国212型潜艇的燃料电池(西门子公司)特点:研究的具体体系大为扩展处理方法和理论模型开始深入到分子水平实验技术迅速提高创新0.5电化学的发展趋势0.5电化学的发展趋势与纳米技术、信息、能源、环境、材料、生物、生命科学等相结合。纳米电化学量子电化学分析电化学有机电化学催化电化学熔盐电化学生物电化学...第1章电化学理论基础1.1电化学体系的基本单元1.2电化学过程热力学1.3非法拉第过程及电极/溶液界面的性能1.4法拉第过程和影响电极反应速度的因素1.5物质传递控制反应绪论1.6电化学研究方法介绍1.1电化学体系的基本单元电极(电子导体)隔膜电解质溶液(离子导体)电解池的设计与安装工作(研究)电极(workingelectrode,WE)液体电极—Hg电极固体电极—惰性电极(Pt、Au、C)和氧化还原电极(Cu、Pb、Mg等)电极材料的选择:背景电流小、电势窗口宽、导电性好、稳定性高、重现性好、表面活性及表面吸附性能等。常用的液体Hg电极有:(1)滴汞电极(droppingmercuryelectrode,DME)(2)静态滴汞电极(staticmercurydropelectrode,SMDE)(3)悬汞电极(hangingmercurydropelectrode,HMDE)1.1.1电极(electrode)金属电极—Pt、Au、Ag等。导电性好、背景电流可以忽略、表面改性方便、制备简单;但表面不均一,真实面积不宜控制、易吸附污染物被污染(杂质影响敏感)、表面可能腐蚀或钝化。固体电极—金属电极和炭电极1.浸入有机溶剂(如甲醇、丙酮等),除去有机吸附物。2.机械抛光—用金刚砂或氧化铝抛光膏,按粒度由粗到细打磨(常用粒度1m,0.3m,0.05m),清除表面的有机、无机吸附物,得到清洁、新鲜的金属表面,保证高的表面光洁度(均一)。3.电化学抛光—反复将电极阳极化(产生氧气)和阴极化(产生氢气),氧化吸附的有机物,还原表面金属氧化物(除去氧化层,得到洁净金属表面)。电极表面预处理方法:炭电极:便宜、正电势方向的电势窗口大(氧化缓慢)、可进行化学修饰来改变表面活性等。热解石墨(pyrolyticgraphite, PG)高定向热解石墨(highlyorderedPG,HOPG)玻碳(glassycarbon,GC)碳纤维(carbonfiber,CF)碳纳米管(carbonnanotube, CNT)石墨玻碳对(辅助)电极(counterelectrode,CE)作用—传导电流要求—(1)良好的电子导体(2)研究电势范围内是惰性(3)面积大于工作电极(4)形状与工作电极吻合(5)放置在与工作电极对称的位置常用—镀Pt黑的Pt或Ni等,玻炭、石墨等参比电极(referenceelectrode,RE)已知电势、接近于理想不极化的电极,基本无电流通过,用于测定研究电极的电势。对参比电极的要求:1.参比电极应具有良好的可逆性,电极电势符合Nernst方程2.参比电极应不易极化;3.参比电极应具有好的恢复性,4.参比电极应具有良好的稳定性5.参比电极应具有良好的重现性;常用参比电极标准氢电极:国际首选参比电极,但在实际测试中使用不方便(需要气体)。甘汞电极:HgHg2Cl2(s)KCl(aq)Hg2Cl2+2e-2Hg+2Cl-饱和KCl,Eo=0.242V<70oC氯化银电极:AgAgCl(s)KCl(aq)AgCl+e-Ag+Cl-饱和KCl,Eo=0.197V利用不同的参比电极测出来的电势,可以互相转换碱性溶液中使用1.1.2隔膜•作用:分隔阳极区和阴极区,保证阴极、阳极上发生氧化-还原反应的反应物和产物不互相接触和干扰。•种类:玻璃滤板隔膜、盐桥、离子交换膜(阳离子交换膜、阴离子交换膜)、多孔隔膜。•缺点:电阻显著增大,能耗增加。1.1.3电解质溶液水溶液体系有机溶剂体系熔融盐体系固体电解质电子传递的媒介电解质溶液电解质:溶于溶剂或熔融状态下能导电的物质。溶剂溶质络合剂缓冲剂惰性电活性支持电解质发生电解质选择原则:(1)互溶性(2)使电解质离解度大(3)常温下呈液态,粘度低,毒性小(4)工作电位窗口宽1.1.4电解池的设计与安装(电化学池,electrochemicalcell)1.二电极电解池Eappl>-0.64V,无电流Eappl=-0.84V,有电流额外的0.2V包括两部分:过电势和溶液的电阻导致的电势降(iR,欧姆降)欧姆降足够小(1-2mV)可以采用二电极*给定的电势只有一部分作用到电极上Eeq,Cd(about-0.64Vvs.SCE)Eapp;(vs.SCE)=ECd(vs.SCE)-iRs2.三电极电解池工作电极(WE)参比电极(RE)对或辅助电极(CE)Luggincapillary电解池设计注意事项:(1)电解池体积适当;(2)工作电极和辅助电极最好分腔放置;(3)参比室应有一个液体密封帽,以在不同溶液间造成接界,同时,应选择合适的盐桥和Luggin毛细管位置,以降低液接电势和IR降;(4)应留有气体的进出口;(5)如要温度保持恒定,必须考虑恒温装置;还要考虑搅拌。小结小结((11)基本概念)基本概念研究对象电化学用途两类导体正极、负极阴极、阳极原电池电解池电流效率((22)法拉第定律)法拉第定律定律的文字表示法拉第常数定律的数学式粒子的基本单元电极隔膜电解质溶液电解池((33)基本单元)基本单元



















