




《高中化学必修1 第四节 氨 硝酸 硫酸PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为1.82 MB,总共有29页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 29页
- 1.82 MB
- VIP模板
- ppt
- 数字产品不支持退货
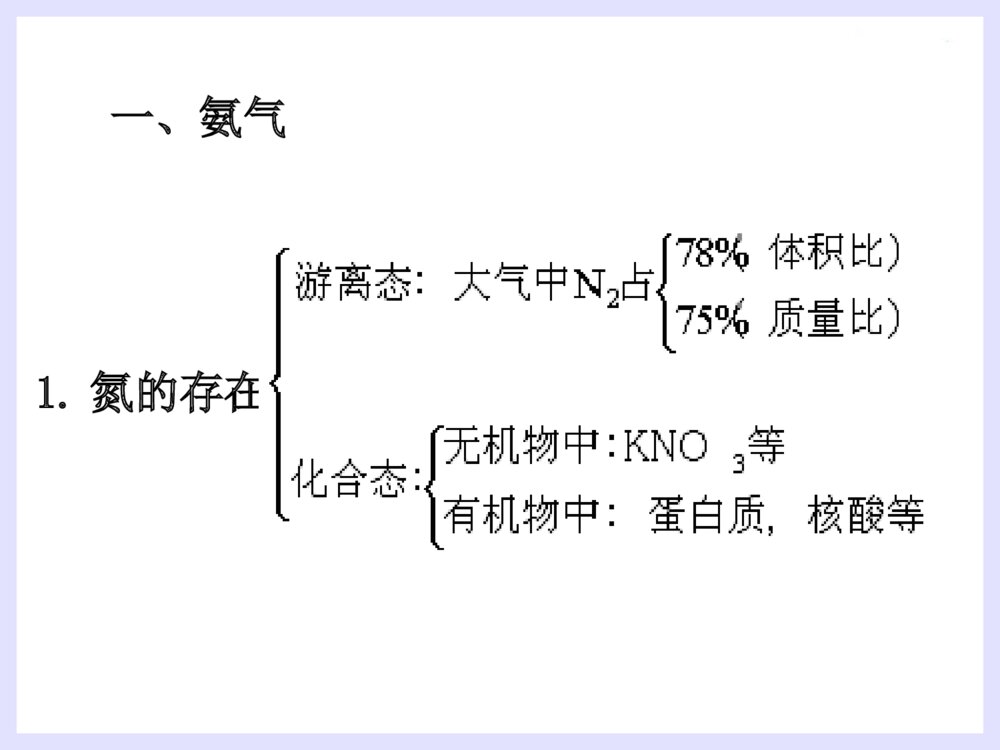
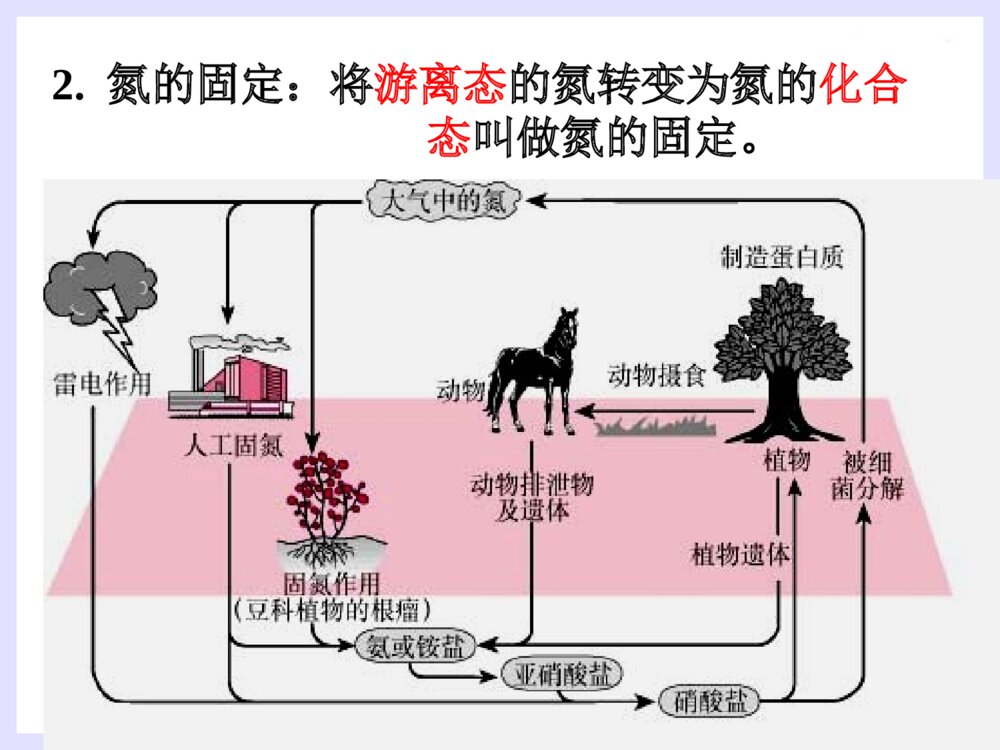
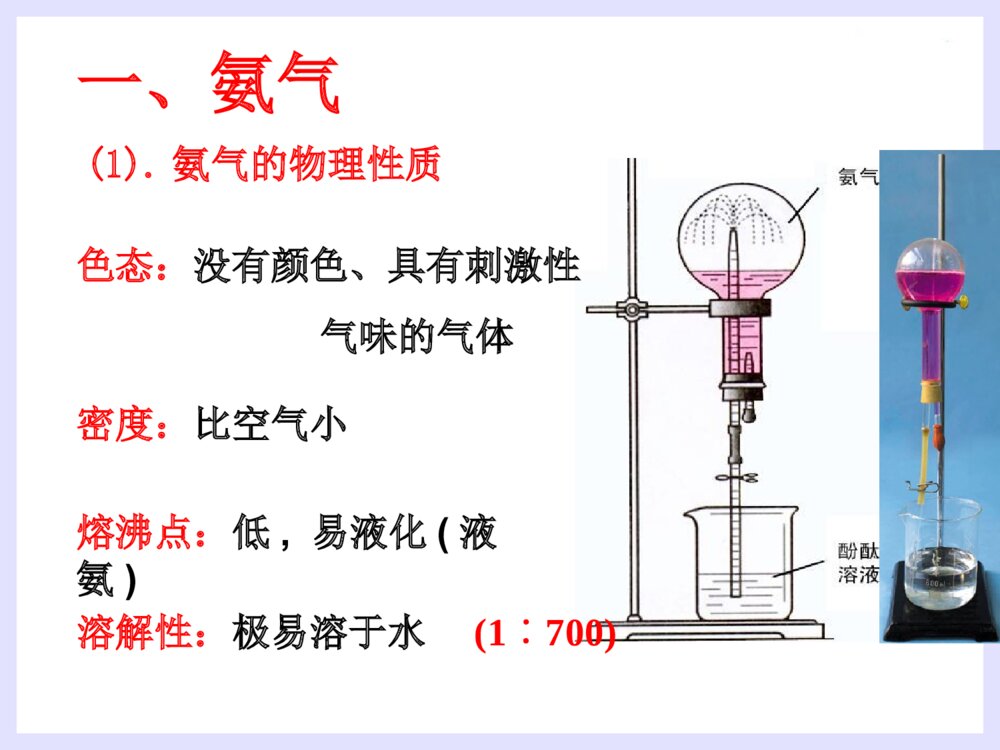
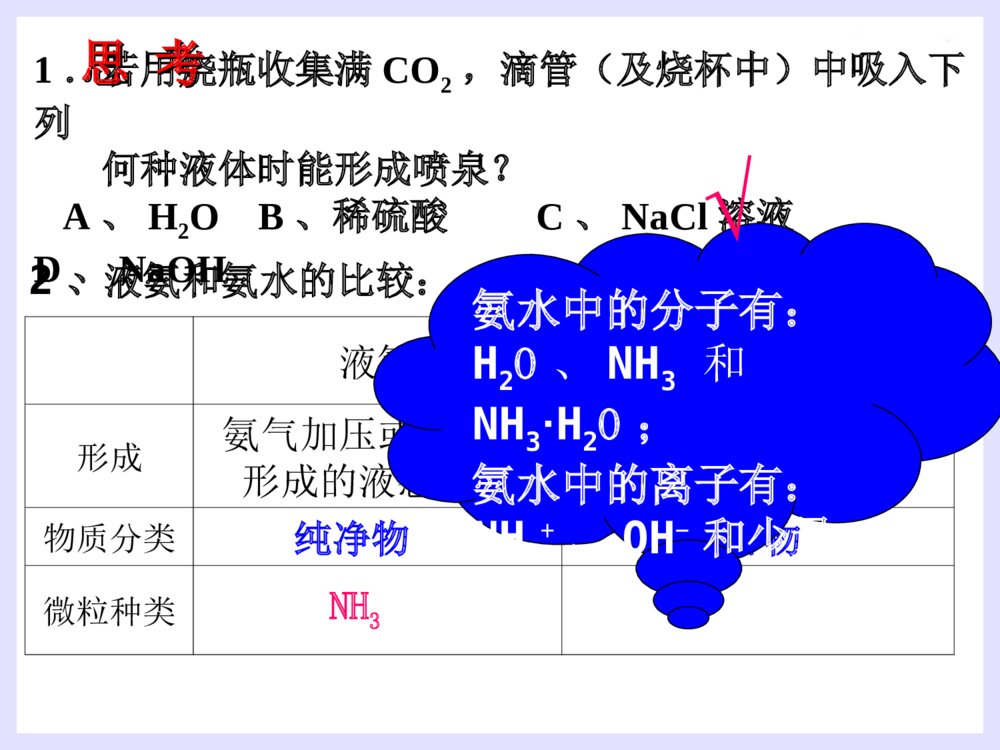
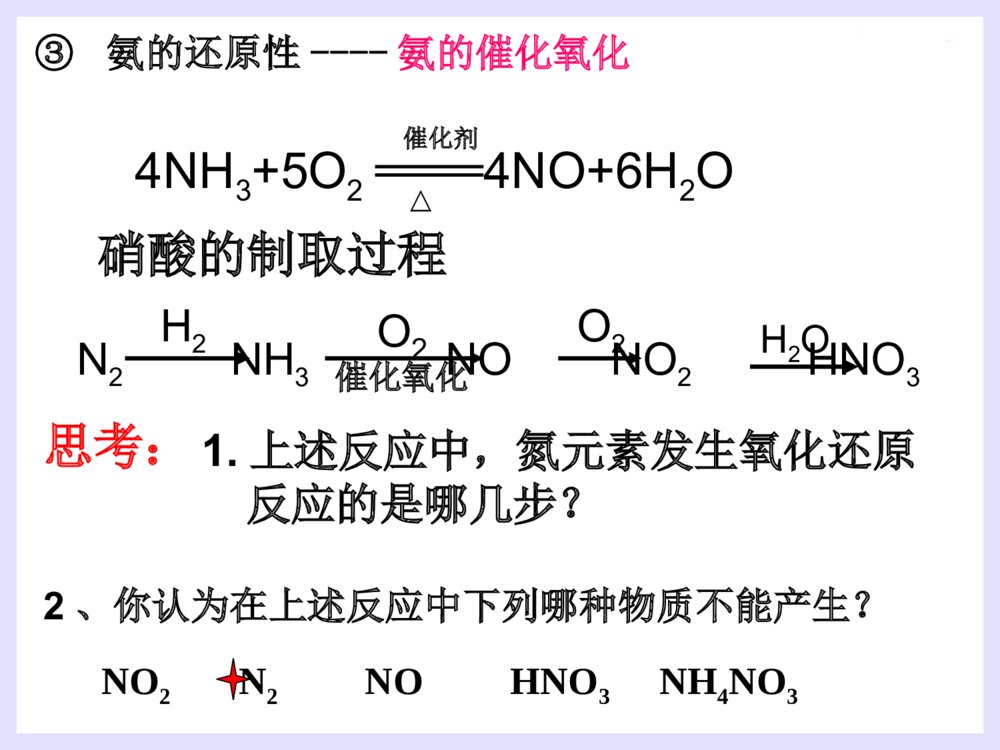
第四节氨硝酸硫酸1.氮的存在一、氨气2.氮的固定:将游离态的氮转变为氮的化合态叫做氮的固定。(3)人工固氮:N2+3H22NH3高温、高压催化剂(2)自然固氮:N2+O22NO放电或高温(1)生物固氮:N2NH4+//NO3-根瘤菌哈伯(1868~1934)德国物理化学家,是合成氨法的发明者。因发明用氮气和氢气直接合成氨的方法,获1918年诺贝尔化学奖一、氨气(1).氨气的物理性质密度:比空气小熔沸点:低,易液化(液氨)溶解性:极易溶于水(1700)∶色态:没有颜色、具有刺激性气味的气体(2).氨的化学性质①氨与水反应----喷泉实验[现象]:形成红色的喷泉极易溶于水(1700)∶[原因]:NH3与水反应后有碱性物质生成。[结论]:(氨水显弱碱性,一水合氨是电解质,氨气不是电解质)NH3+H2ONH3·H2ONH4++OH-既能使无色的酚酞溶液变成________,又能使湿润的红色的石蕊试纸________。红色变蓝1.若用烧瓶收集满CO2,滴管(及烧杯中)中吸入下列何种液体时能形成喷泉?A、H2OB、稀硫酸C、NaCl溶液D、NaOH2、液氨和氨水的比较:液氨氨水形成氨气加压或降温后形成的液态物质氨气溶于水物质分类微粒种类混合物纯净物氨水中的分子有:H2O、NH3和NH3·H2O;氨水中的离子有:NH4+、OH-和少量H+NH3思考思考√2NH3+H2SO4==NH3+HNO3==[探索实验]将蘸有浓氨水的玻璃棒和蘸有浓盐酸的玻璃棒靠近,现象是NH3+HCl==NH4Cl②NH3与酸反应生成铵盐思考:是否所有的酸与NH3反应都有白烟?结论:________________________________(NH4)2SO4NH4NO3烟:固体小颗粒挥发性的酸遇到NH3会有白烟产生大量白烟③氨的还原性----氨的催化氧化4NH3+5O24NO+6H2O△催化剂硝酸的制取过程N2NH3NONO2HNO3H2催化氧化O2O2H2O思考:1.上述反应中,氮元素发生氧化还原反应的是哪几步?2、你认为在上述反应中下列哪种物质不能产生?NO2N2NOHNO3NH4NO3制硝酸制纯碱制尿素做致冷剂(3).氨的用途①氮肥工业、制造硝酸、铵盐、纯碱;②有机合成工业(合成纤维、塑料、染料、尿素)③作制冷剂(3).氨的用途小结(1).氨气的物理性质(2).氨的化学性质(3).氨的用途氨与水反应NH3与酸反应氨的还原性铵盐(1)铵根离子(NH4+)与酸根离子构成的化合物(2)物理性质:铵盐都易溶于水(3)铵盐的化学性质:①①铵盐受热易分解:铵盐受热易分解:NHNH44Cl==NHCl==NH33↑+HCl↑↑+HCl↑△△NHNH44HCOHCO33==NH==NH33↑+CO↑+CO22↑+H↑+H22OO△△△△(NH(NH44))22COCO33==2NH==2NH33↑+CO↑+CO22↑+H↑+H22OO②铵盐与碱反应(NH4)2SO4+2NaOH=2NH3↑+2H2O+Na2SO4△NH4NO3+NaOH==NH3↑+H2O+NaNO3NH4++OH-==NH3↑+H2O反应实质铵盐铵盐(NH(NH44++))的检的检验:验:取试样加NaOH溶液,加热并将湿润的红色石蕊试纸靠近试管口。现象:现象:产生无色刺激性气味气体,产生无色刺激性气味气体,气体使湿润气体使湿润红色石蕊试纸红色石蕊试纸变蓝。变蓝。氨气的实验室制法:氨气的实验室制法:(2)(2)原理:原理:(4)收集装置:向下排空气法棉花的作用:减少与空气对流(3)制取装置:固+固加热(1)(1)原料:原料:用用NHNH44ClCl与与Ca(OH)Ca(OH)22混和加热混和加热2NH2NH44Cl+Ca(OH)Cl+Ca(OH)22====CaClCaCl22+2NH+2NH33↑+2H↑+2H22OO(5)检验或检验收满①湿润的红色石蕊试纸变蓝(唯一的一种碱性气体)②蘸有浓HCl的玻璃棒接近试管口产生白烟。(7)尾气吸收:(6)干燥:水——装置:倒置漏斗用碱石灰(NaOH和CaO)干燥防止倒吸(3)实验室里用金属与酸反应制取氢气,往往用稀硫酸或盐酸,而不用浓硫酸或硝酸,这是为什么?(2)这种特点与酸的通性有什么关系?用电离方程式表示。(1)硫酸、硝酸、盐酸都是酸,它们在组成上有什么特点?1、使指示剂变色:2、与碱发生中和反应:3、与碱性氧化物反应:4、与盐反应:稀硫酸与硝酸使紫色石蕊试液变红H++OH-=H2O2H++CuO=Cu2++H2O2H++CO32-=H2O+CO2硫酸与硝酸都具有酸的通性H2SO4=2H++SO42-HNO3=H++NO3-A.纯硫酸是无色、油状的液体1.物理性质B.纯硫酸难挥发,沸点338.℃(高沸点酸)C.密度:质量分数为98.3%的硫酸密度为1.84g/cm3(高密度酸).浓硫酸D.易溶于水,能以任意比与水混溶(浓硫酸溶解时放出大量的热)浓硫酸的特性2.浓硫酸的吸水性3、脱水性将有机物中的氢、氧元素按2:1的比例脱去吸收空气中的水、混合物物中的水作用:作干燥剂现象:蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的炭,并有刺激性气味的气体产生。4.浓硫酸的氧化性(1)与铜反应2H2SO4+Cu==CuSO4+2H2O+SO2(2)与木炭的反应 在加热时浓硫酸不仅能和活泼性不强的铜发生反应,还能与红热的炭反应。2H2SO4+C==CO2+2H2O+2SO2铁与铝在常温下遇到浓硫酸、浓硝酸发生钝化现象。思考:为检验炭和浓硫酸的反应产物,提供下列仪器装置,请按正确的顺序连接下列仪器,并说明理由.ABCDEF品红溶液品红溶液KMnO4溶液澄清石灰水浓H2SO4木炭无水CuSO42H2SO4(浓)+C==CO2↑+2H2O+2SO2↑△【问题探究】:稀硫酸是否具有氧化性?浓、稀硫酸的氧化性有什么不同?稀硫酸也有氧化性。稀硫酸的氧化性是由于它电离出的H+;浓硫酸的氧化性是由于分子里的+6价硫引起的;H+的氧化性比+6价硫氧化性弱。酸类均有氧化性酸的氧化性:H+氧化性酸浓硫酸硝酸硫酸是用量最大、用途最广的化工原料之一,所以硫酸的产量是衡量一个国家无机化工水平的标志。(1)不稳定性:4HNO3O2↑+2H2O+4NO2↑△或光照密封于棕色瓶中,并放在阴暗处!保存:久置硝酸分解产生的NO2溶于溶液中,使溶液变黄色久置浓硝酸变黄色的原因?硝酸1.硝酸的化学性质浓硝酸泄漏Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O①与金属(除Au、Pt外)反应酸性、氧化性3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O稀硝酸和浓硝酸都有强氧化性(2)强氧化性②与非金属反应C+4HNO32H2O+4NO2↑+CO2↑阅读资料卡片:王水1.下列现象体现了硫酸的哪些性质?(1)把浓硫酸滴入放在蒸发皿里的蔗糖上,蔗糖就会炭化变黑(2)把浓硫酸露置在空气里,质量会增加.(3)把锌粒放入稀硫酸里,会产生氢气。(4)把铜片放入浓硫酸里并加热,会产生SO2.(5)利用浓硫酸和食盐固体反应,制HCl气体。脱水性强氧化性难挥发性练习酸性吸水性 2.工业上拟用铜和硝酸来制备Cu(NO3)2,下面有三位同学提出了不同的生产方案: 甲方案:Cu+浓HNO3→蒸发结晶 乙方案:Cu+稀HNO3→蒸发结晶 丙方案:Cu CuO蒸发结晶 你认为______方案最好,理由 _______________________________空气加热HNO3丙消耗硝酸少,不污染环境由此,你认为用铜和浓硫酸采用何种途径制硫酸铜最好?3、用什么方法鉴别浓硫酸和稀硫酸?1.利用浓硫酸的脱水性2.利用浓硫酸的氧化性3.利用浓硫酸的钝化作用4.利用浓硫酸溶于水放热5.……



















