







《高中化学金属及其化合物PPT课件下载(共28页)》是由用户上传到老师板报网,本为文库资料,大小为1.25 MB,总共有28页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 28页
- 1.25 MB
- VIP模板
- ppt
- 数字产品不支持退货
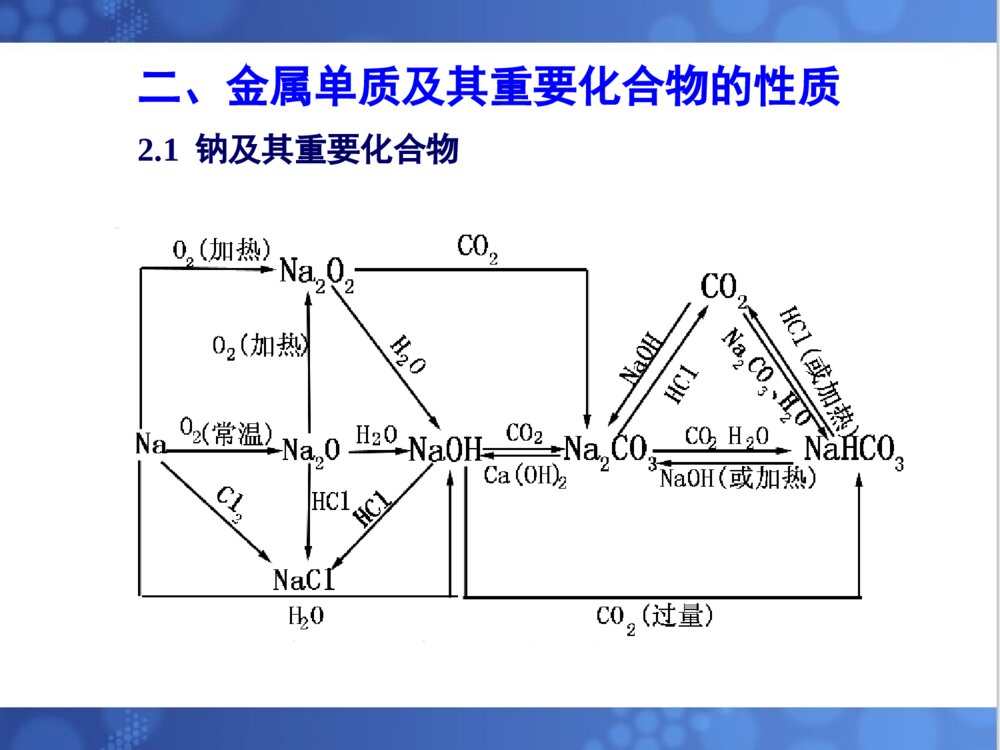
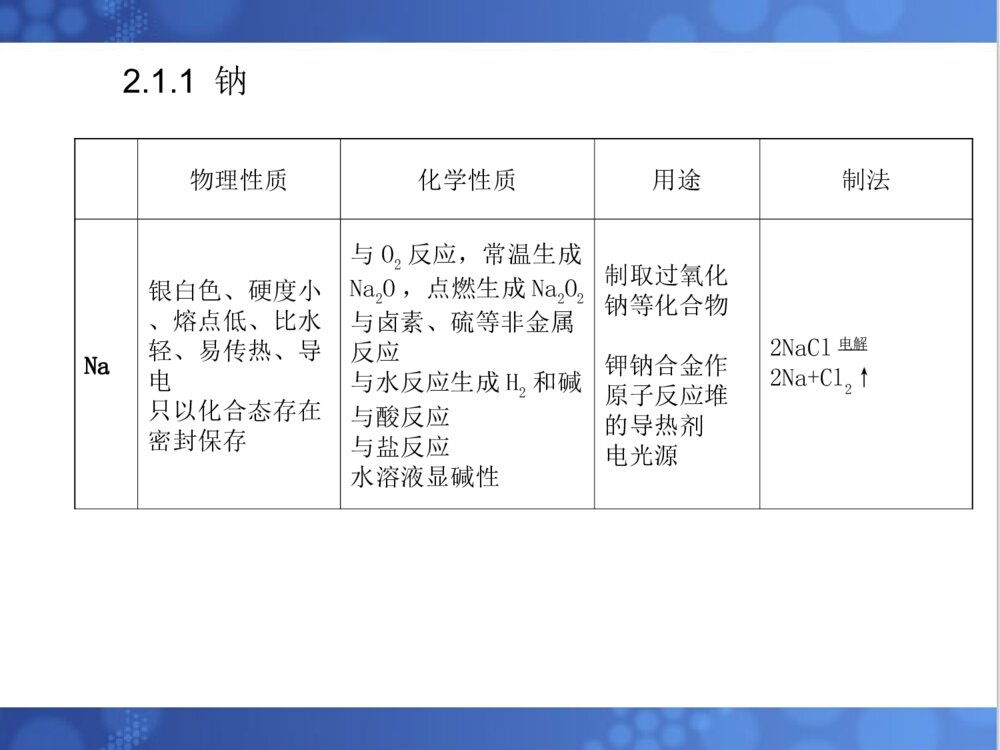
金属及其化合物一、金属的性质1.1金属的物理性质:(共性)(1)有金属光泽、易传热、易导电,有延展性、可塑性,常温下除汞(液态)以外都是固体。(2)金属原子的最外层电子排布特点:金属原子最外层电子数较少,易失去最外层电子,有还原性。(3)常见金属活动顺序KCaNaMgAlZnFeSnPbCuHgAgPtAu金属性、还原性逐渐减弱1.2金属的化学性质金属与非金属、水、酸、盐等反应二、金属单质及其重要化合物的性质2.1钠及其重要化合物2.1.1钠物理性质化学性质用途制法Na银白色、硬度小、熔点低、比水轻、易传热、导电只以化合态存在密封保存与O2反应,常温生成Na2O,点燃生成Na2O2与卤素、硫等非金属反应与水反应生成H2和碱与酸反应与盐反应水溶液显碱性制取过氧化钠等化合物钾钠合金作原子反应堆的导热剂电光源2NaCl电解2Na+Cl2↑2.1.2钠的氧化物2.1.3氢氧化钠物理性质化学性质用途制法NaOH烧碱火碱苛性钠白色固体、易溶于水且放热、强腐蚀性、易潮解(可作干燥剂)密封保存、橡皮塞强碱通性:与酸中和酸碱指示剂显色与酸性氧化物、铵盐、酸式盐反应与两性金属氧化物、氢氧化物反应电解食盐水石灰纯碱法肥皂石油造纸纺织印染2.1.4钠盐钠盐物理性质化学性质用途制法Na2CO3白色粉末易溶于水与酸反应放出CO2与Ca(OH)2反应生成CaCO3、NaOH与CaCl2反应生成CaCO3水合物易风化水溶液显碱性食用碱制玻璃造纸制皂洗涤剂氨碱法侯氏制碱法NaHCO3白色细小晶体易溶于水溶解度小于Na2CO3与酸反应放出CO2与NaOH反应生成Na2CO3与Ca(OH)2反应生成CaCO3受热分解为Na2CO3、H2O、CO2水溶液显弱碱性发酵粉灭火剂治疗胃酸过多NaOH溶液通入过量CO2,减压低温蒸干溶液饱和Na2CO3溶液中通入CO2,过滤晶体【例1】 将等物质的量的Na2O和Na2O2分别投入到足够量且等质量的水中,得到溶质质量分数分别为a%和b%的两种溶液,则a和b的关系是( )A.a=b B.a>bC.a<bD.无法确定【解析】 Na2O+H2O===2NaOH,2Na2O2+2H2O===4NaOH+O2↑。等物质的量的Na2O和Na2O2与水反应时,生成等质量的NaOH,耗去了等质量的水,剩余水的质量相等,则溶液的质量分数相等。【答案】 A【例2】为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将W1g样品加热,其质量变为W2g,则该样品的纯度(质量分数)是()【解析】 设样品中含NaHCO3的质量为x。【解析】 A2.2镁及其化合物2.3铝及其重要化合物【例3】 某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实验下图所示的物质之间的变化:据此判断:(1)固体B所含物质的化学式为________。(2)固体E所含物质的化学式为________。(3)反应①的离子方程式为______________________。【答案】 (1)Al2O3 (2)(NH4)2SO4、K2SO4Al2O3、Fe2O3Al2O32.4铁及其重要化合物【例4】 向15g铁和氧化铁的固态混合物中,放入一定物质的量浓度的稀硫酸150mL,固体全部溶解,同时放出气体(标准状况下)1.68L;再向所得溶液中滴入KSCN溶液,未见颜色变化。为了中和过量的硫酸,且使Fe2+完全转化为Fe(OH)2,共消耗3mol/L的NaOH溶液200mL,则原硫酸溶流的物质的量浓度为()A.1.5mol/LB.2mol/LC.2.5mol/LD.3mol/L【解析】本题涉及到的反应较多,采用常规解法比较繁锁,不妨整体考虑,最后所得溶液中含有Na+和SO2-4,根据电荷守恒有:n(Na+)=2n(SO2-4),故有2n(H2SO4)=n(NaOH)即2×c(H2SO4)×0.15L=3×0.2mol,得c(H2SO4)=2mol/L【例5】 往CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,片刻后,取出铁钉,发现铁钉并无任何变化。根据上述现象,确定下面结论正确的是()A.不溶物一定是铜B.不溶物一定含铜,但不一定含铁C.不溶物一定是铁D.溶液中一定含有Fe2+,但不一定含有Cu2+【解析】由于滤液中加铁无任何变化,说明滤液中无Cu2+和H+,因而不溶物一定有铜,可能有铁。溶液中一定含Fe2+,一定无Cu2+。3.1特殊颜色①焰色反应:Na+(黄色)、K+(紫色)②有色溶液含有的离子Fe2+Fe3+Cu2+MnO4-颜色浅绿色黄色蓝色紫红色三、金属及其化合物推断题方法归纳③有色固体红色:Cu、Fe2O3(红棕色)红褐色:Fe(OH)3绿色:Cu2(OH)2CO3、FeSO4·7H2O蓝色:Cu(OH)2、CuSO4·5H2O黑色:CuO、FeO、MnO2、炭黑浅黄色:Na2O2、AgBr白色:Fe(OH)2、CaCO3、BaSO4、AgCl、Al(OH)3、Mg(OH)23.2特殊性质①在一定条件下能漂白有色物质的淡黄色固体只有Na2O2。②遇SCN-显红色的只有Fe3+。③常见的可溶于NaOH溶液的白色沉淀有Al(OH)3,可溶于NaOH溶液的金属氧化物有Al2O3。④不溶于水又不溶于稀盐酸或稀硝酸的化合物有:BaSO4(白色)、AgCl(白色)。3.3特征反应①能与强碱反应产生气体的物质:活泼的金属,如Na、Al、Zn等;不稳定的弱酸盐,如碳酸盐、碳酸氢盐等。②能与强碱反应产生气体的物质:单质,如Al等;盐类,如铵盐等。③既能与强酸又能与强碱溶液反应的物质:金属单质,如Al等;两性氧化物,如Al2O3等;两性氢氧化物,如Al(OH)3等;弱酸的铵盐,如NH4HCO3、(NH4)2CO3等;弱酸的酸式盐,如NaHCO3等。④能与水反应产生气体的物质:活泼的金属单质,Na、K、Mg(加热)、Fe(高温生成Fe3O4)等;金属过氧化物,如Na2O2等。3.4特殊的转换关系②三角转换3.5常见离子检验的方法(1)焰色反应LiNaKCaSrBaCu紫红黄紫砖红洋红黄绿绿(2)化学方法:Ba2+加入SO42-产生白色沉淀,再加入稀HNO3或盐酸沉淀不溶解。Mg2+加入过量强碱产生白色沉淀。Al3+加入过量强碱先产生白色沉淀,后消失。Cu2+加入OH-产生蓝色沉淀。Ag+加入Cl-产生白色沉淀,此沉淀不溶于稀HNO3Fe3+加SCN-产生血红色溶液;或加氢氧化钠产生红褐色沉淀。Fe2+加NaOH产生红白色沉淀迅速转化灰绿色最后转化红褐色沉淀;或加SCN-无现象,再加氯水产生血红色溶液.【例6】 A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。(1)写出A~E化学式(2)写出下列反应的离子方程式:A→B,A→D【答案】(1)KAlO2Al(OH)3Al2O3AlCl3NaAlO2(2)AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3AlO-2+4H+===Al3++2H2O【例7】 有A、B、C、D四种物质的溶液,在进行焰色反应实验时,火焰都呈黄色,它们之间可发生如图所示的转化,则这四种物质分别为:___________________写出①~⑤有关反应的离子方程式【答案】NaOHNa2CO3NaHCO3Na2SO4①2OH-+CO2===CO2-3+H2O②CO2-3+CO2+H2O===2HCO-3③HCO-3+H+===H2O+CO2↑④Ba2++SO2-4===BaSO4↓⑤CO2-3+2H+===H2O+CO2↑



















