





《初中化学·第八单元金属和金属材料PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为1.73 MB,总共有68页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 68页
- 1.73 MB
- VIP模板
- ppt
- 数字产品不支持退货
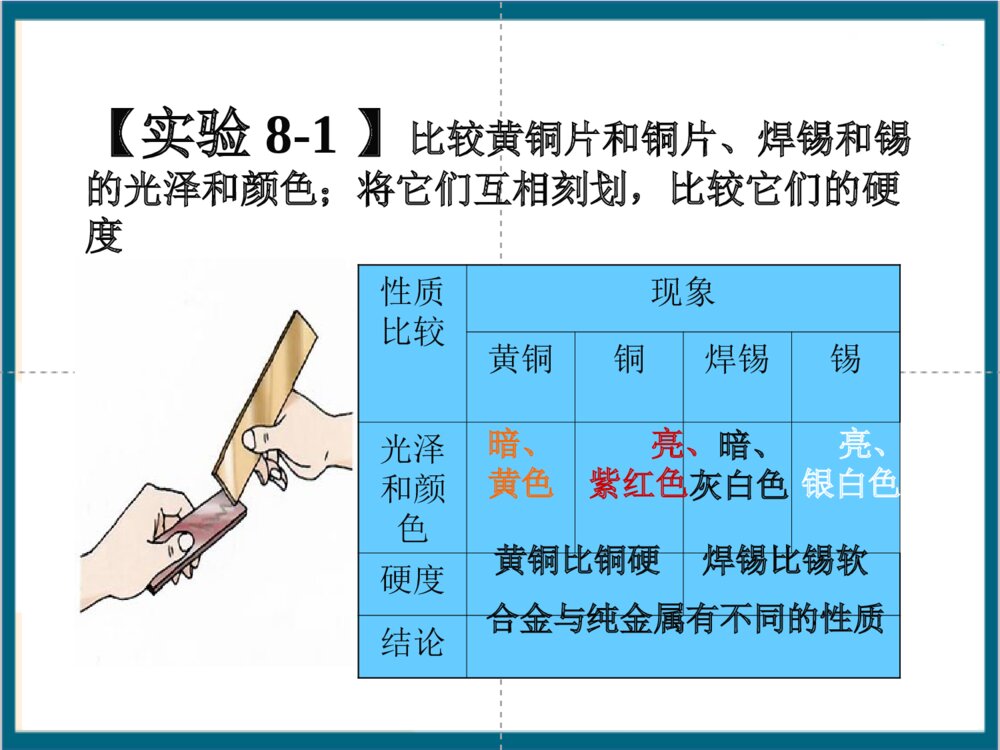
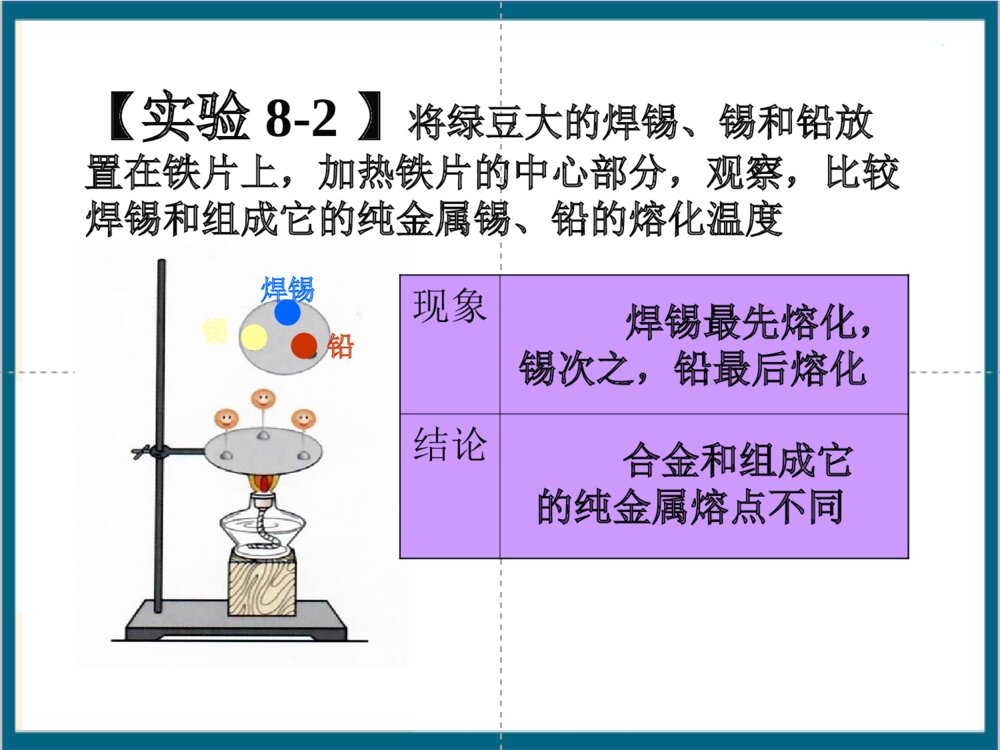
课题1金属材料第七章金属和金属材料金属材料建筑桥梁器械车辆、飞机、舰艇生活用具其它纯金属合金(铁合金,钛合金等)大多数金属为银白色大多数金属为固体大多数金属有光泽大多数金属熔沸点高大多数金属能导电导热大多数金属有延展性铜(紫红色)金(黄色)汞(液态)金属与非金属物理性质的比较物理性质金属非金属状态在常温下,除汞是液体外,其余都是固体在常温下,有固、液、气三态密度一般较大一般较小导电性导热性能导电、导热一般不导电、不导热延展性有没有【实验8-1】比较黄铜片和铜片、焊锡和锡的光泽和颜色;将它们互相刻划,比较它们的硬度性质比较现象黄铜铜焊锡锡光泽和颜色硬度结论暗、黄色亮、紫红色暗、灰白色亮、银白色黄铜比铜硬焊锡比锡软合金与纯金属有不同的性质【实验8-2】将绿豆大的焊锡、锡和铅放置在铁片上,加热铁片的中心部分,观察,比较焊锡和组成它的纯金属锡、铅的熔化温度焊锡锡铅【实验8-2】将绿豆大的焊锡、锡和铅放置在铁片上,加热铁片的中心部分,观察,比较焊锡和组成它的纯金属锡、铅的熔化温度锡焊锡铅【实验8-2】将绿豆大的焊锡、锡和铅放置在铁片上,加热铁片的中心部分,观察,比较焊锡和组成它的纯金属锡、铅的熔化温度锡焊锡铅现象结论焊锡最先熔化,锡次之,铅最后熔化合金和组成它的纯金属熔点不同常见合金的主要成分、性能和用途合金主要成分性能用途不锈钢黄铜18K黄金焊锡硬铝铁、铬、镍抗腐蚀性好医疗器械、炊具、容器、反应釜铜、锌强度高、可塑性好、易加工、耐腐蚀机器零件、仪表、日用品锡、铅熔点低焊接金属铝、铜镁、硅强度和硬度好火箭、飞机、轮船等制造业金、银、铜光泽好、耐磨、易加工金饰品、钱币、电子元件二、合金1、合金是一种金属与其他一种或几种金属(或非金属)熔合形成的有金属特性的混合物。2、合金与组成它们的金属的性质的差异。⑴合金比其组分金属的颜色鲜艳;⑵合金的硬度大于组成它们的金属;⑶合金的熔点低于组成它们的金属;⑷合金的抗腐蚀能力一般强于各组分金属。3、合金比纯金属具有更广泛的用途。4、钛和钛合金,新型金属材料纯铁铁的合金(含碳量不同)生铁(2%~4.3%)钢(0.03%~2%)硬度比生铁大良好的延展性钛和钛合金被认为是21世纪的重要材料,它具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工、机械性能好等。尤其是抗腐蚀性能非常好,即使把它们放在海水中数年,取出后仍光亮如新,其抗腐蚀性能远优于不锈钢,因此被广泛用于火箭、导弹、航天飞机船舶、化工和通讯设备等形状记忆合金是具有形状记忆效应的合金被广泛用于做人造卫星和宇宙飞船的天线,水暖系统、防火门和电路断电的自动控制开关,以及牙齿矫正等医疗材料习题1、下列关于“合金”的叙述:a、合金中至少含有两种金属;b、合金中元素以化合物的形式存在;c、合金中一定含有金属;d、合金一定为混合物;e、合金依然具有金属的特性。其中正确的是()A、dB、abcC、cdD、cdeD2、焊锡是锡铅合金,主要用途是焊接金属,那么把铅加入锡中制成合金的主要目的()A、增加强度B、降低熔点C、增加延展性D、增加抗腐蚀性3、某铁合金的样品1.1g在氧气中完全燃烧得到0.013g二氧化碳,则此铁合金是生铁还是钢?B4、在铁、铝、铜、锌、钛五种金属中:常用于电镀和作干电池电极的金属是_生铁和钢是哪种金属的合金___包装糖果、香烟的银白色金属材料__常用于制造电线和电缆的金属___常用于航空工业作制造飞机等材料的金属__锌铁铝铜铝钛铝课题2金属的化学性质3Fe+2O2Fe3O4点燃2Mg+O22MgO点燃1、所有的金属都可以和氧气反应吗?2、你知道它们和氧气反应的条件吗?1、大多数金属都能与氧气发生反应,但反应的难易和剧烈程度不同一一..金属与氧气的反应金属与氧气的反应镁、铝在常温下可与氧气反应铁、铜在加热时可与氧气反应金在加热时也不与氧气反应金属活动性:镁、铝>铁、铜>金2、镁和铝在常温下可与氧气反应,为什么铝会具有很好的抗腐蚀性呢?铝在空气中与氧气反应,其表面生成一层致密的氧化铝(Al2O3)薄膜,从而阻止铝进一步被氧化。抗腐蚀原因:4Al+3O2===2Al2O3注意:金属和氧气反应一般生成金属的氧化物Mg+2HCl==MgClMg+2HCl==MgCl22+H+H22↑↑Zn+HZn+H22SOSO44==ZnSO==ZnSO44+H+H22↑↑二二..金属与酸的反应金属与酸的反应1、所有的金属都可以和酸反应吗?2、它们和酸反应的剧烈程度一样吗?如何判断MgZnFeCu的活动性A组:在试管中分别放入镁条、锌粒、铁钉、铜丝。然后,分别向其中加入一些稀盐酸。B组:在试管中分别放入镁条、锌粒、铁钉、铜丝。然后,分别向其中加入一些稀硫酸。金属金属稀盐酸(稀硫酸)现象反应化学方程式镁镁锌锌铁铁铜铜放出气泡速度最快,反应最剧烈Mg+2HCl==MgClMg+2HCl==MgCl22++HH22↑↑Mg+H2SO4==MgSO4+HMg+H2SO4==MgSO4+H22↑↑放出气泡速度较快,反应较为剧烈Zn+2HCl==ZnClZn+2HCl==ZnCl22++HH22↑↑Zn+HZn+H22SOSO44==ZnSO==ZnSO44+H+H22↑↑放出气泡速度缓慢,反应较为缓和Fe+2HCl==FeClFe+2HCl==FeCl22++HH22↑↑Fe+HFe+H22SOSO44==FeSO==FeSO44+H+H22↑↑无明显现象MgMg、、ZnZn、、FeFe、、HH、、CCuu金属活动性由强到弱结论11、大多数金属能与稀盐酸或稀硫酸反应。、大多数金属能与稀盐酸或稀硫酸反应。22、可根据金属是否与稀盐酸或稀硫酸反应、可根据金属是否与稀盐酸或稀硫酸反应或反应的剧烈程度判断金属的活动性强弱。或反应的剧烈程度判断金属的活动性强弱。将铁钉投入到硫酸铜溶液中有何现象?思考现象:铁钉表面会有红色物质析出,若时间足够长,则溶液会从蓝色变为浅绿色。该反应的化学方程式:Fe+CuSO4=Cu+FeSO4活动性:FeCu﹥三.金属与化合物溶液的反应•所有金属都可以和化合物的溶液反应吗?根据金属和氧气反应的剧烈程度不同我们已经知道,金属铝的活动性大于铜,我们是否还有其他方法来判断Al和Cu谁更活泼呢?12设计的实验观察到的现象得到的结论将铝丝浸入CuSO4溶液中铝丝表面覆盖一层红色物质铝比铜活泼将铜丝浸入Al2(SO4)3溶液中无明显现象铝比铜活泼利用Al丝、Cu丝及CuSO4溶液、Al2(SO4)3溶液。判断Al、Cu的活动性•Al,Cu,Ag的活泼性如何判断铝与硫酸铜溶液的反应铝与硫酸铜溶液的反应铜与硝酸银溶液的反应铜与硝酸银溶液的反应实验现象反应的化学方程式铝丝浸入硫酸铜溶液中铜丝浸入硝酸银溶液中铜丝浸入硫酸铝溶液中浸入溶液中的铝丝表面覆盖一层紫红色物质,溶液由蓝色逐渐变为无色。2Al+3CuSO4=Al2(SO4)3+3Cu活动性:Al﹥Cu浸入溶液中的铜丝表面覆盖一层银白色物质,溶液由无色逐渐变为蓝色。Cu+2AgNO3=Cu(NO3)2+2Ag活动性:Cu﹥Ag无明显现象活动性:CuX>YB.Z>Y>XC.X>Y>Z D.X>Z>YCA3、下列反应中不属于置换反应的是()A、Cl2+2NaBr=2NaCl+Br2B、2Mg+CO2=2MgO+CC、2Na+2H2O=2NaOH+H2D、2Na2O2+2H2O=4NaOH+O2D专题题型一:金属与酸反应的图像分析题1、相同质量的Mg、Zn、Fe和足量的稀硫酸反应,产生氢气的总质量(m)随时间(t)变化的关系如图,则下图中a、b、c表示的金属分别为:a、b、c。a0t2t1t3bcMgZnFem(H2)t规律1、将相同质量的Fe、Zn、Mg、Al投入足量的稀盐酸中则产生氢气质量由多到少的顺序是产生氢气速率由快到慢的顺序是ZnFeMgAlAl>Mg>Fe>ZnMg>Al>Zn>Fetm(H2)A、从曲线的斜率来判断金属活动性,斜率越大,与酸反应速率越快,则金属的活动性越强B、从图像上判断生成氢气质量的多少只需看“线高、线低”规律一:等量不等价态的金属与足量酸反应,价态越高生成的氢气质量越多规律二:等量相等价态的金属与足量酸反应,金属相对原子质量越小,产生氢气的质量越多AlMg>MgFe>2、把等质量的X、Y、Z、M四种金属分别加入到同体积、同浓度的足量稀盐酸中.再把X加入到Z(NO3)2溶液中,M加入到YNO3溶液中.反应关系如图所示.据此判断四种金属的活动性顺序为( )A.Z>X>M>YB.X>Z>M>YC.X>Z>Y>MD.Y>M>Z>XB题型二:金属混合物与酸反应的计算应用题3、一种不纯的铁粉,已知它含有铜、铝、镁中的一种或几种金属杂质。现取5.6g该铁粉和足量的稀硫酸反应产生0.19g氢气。则该铁粉中一定含有的金属杂质是()A、铜B、铝C、镁D、铝、镁的混合物解析:运用假设法(极限法),假设5.6g全部是一种金属,看生产氢气的质量是多少,再进一步分析若5.6g全部是铁,则生成0.2g氢气;若5.6g全部是铝或镁,则均生成氢气大于0.2g;所以必须含有产生氢气质量小于0.2g的金属,在这几种金属中只有Cu与酸不反应,故肯定含有CuA4、5.6g含杂质的铁片加到足量的稀硫酸中,共收集到0.19g氢气,该铁片中不可能含有的杂质是( )A.铝和铜 B.镁和锌 C.锌和铜 D.镁和铝5、为了测定某铁粉中杂质的含量,取该铁粉样品20克,放到盛有200克稀盐酸的烧杯中,反应后烧杯中物质总质量变成219.4克.求⑴铁粉中纯铁的质量分数.⑵稀盐酸的质量分数.D题型三:物质推导题6、已知A、B、C、D四种物质都含有同一种元素,其中A是单质,B是黑色固体,C是红色固体。它们之间存在着如下转化关系:(1)A在不同条件下能够转化成B或C;(2)A和稀硫酸反应有D生成;(3)在高温条件下,B、C分别和无色气体E反应,都能生成A和另一种无色气体。根据上述信息,写出下列物质的化学式:A;B;C;D。FeFe3O4Fe2O3FeSO47、根据下列物质之间的相互转化关系回答:化合物甲+单质X化合物乙+单质Y(1)若乙的溶液是浅绿色,Y是红色固体,则该反应的化学方程式是:(2)在常温下若乙是一种气体,则该反应的化学方程式是:(3)若单质X是固体,单质Y是无色气体,则X可以是,写出其中一个反应的化学方程式Fe+CuSO4=FeSO4+CuC+CuO=CO2+Cu高温Mg(或Zn、Fe)Zn+H2SO4=H2+ZnSO4题型四:天平是否失衡问题1、在托盘天平两盘上的烧杯中,各放入质量浓度都相等的稀硫酸,调节至天平平衡,分别向两烧杯中各加入5g镁和5g铁,金属全部反应消失后,天平指针将()A、偏向镁一边B、偏向铁一边C、仍平衡D、不能确定分析:此题关键求出等质量的镁和铁反应产生氢气量的多少;由于金属全部完全反应,所以酸的量是足够的;镁和铁等质量等价态,所以产生氢气的量Mg>FeB2、在托盘天平两盘烧杯中各放入质量浓度都相等的稀盐酸,调至天平平衡,在左右两盘中各放入等质量的两种金属(保持盐酸过量),反应完全后发现左盘升高,右盘下降,则左右两烧杯中分别放入的金属可能是()A、Mg和AlB、Zn和MgC、Zn和CuD、Cu和Fe3、在托盘天平的左右两盘各放一只盛有相同浓度、相同质量的稀硫酸。天平平衡,在左杯放入mg铁粉,在右杯中放入mg锌粉,充分反应后,两杯都有金属剩余,此时天平指针()A、偏右B、指在中央C、偏左D、无法确定CB1、金属元素在自然界中分布很广,极少数不活泼的金属(如金、银等)有单质形式存在;2、其余大多数以化合物的形式存在。金属化合物在自然界中以矿物的形式存在。3、常见矿石:课题3金属资源的利用和保护Fe2O3赤铁矿黄铁矿FeS2菱铁矿FeCO3磁铁矿Fe3O4赤铜矿Cu2O孔雀石Cu2(OH)2CO3一.金属元素在自然界中的存在1.实验室用CO还原Fe2O3二.铁的冶炼【实验8-3】如何验证产物中含铁粉?用磁铁吸(或加稀HCl)现象分析反应式尾气处理红色的固体变成灰黑色,同时产生的气体使澄清的石灰水变浑浊一氧化碳还原氧化铁生成铁粉(灰黑色)与二氧化碳Fe2O3+3CO===2Fe+3CO2高温①用燃着的酒精灯将尾气点燃或②用气球收集尾气①.按下图组装仪器,并检查其气密性【实验步骤】②把少量研细的氧化铁粉末装进硬质玻璃管中③把硬质玻璃管接入装置系统中,先通入CO气体排除空气④当红棕色粉末已转变成黑色后,停止加热,再通入一会儿CO,直至玻璃管冷却防止Fe被氧化防止CO与空气混合受热爆炸点燃出气口处的酒精灯(或用气球收集),待排尽后,点燃酒精喷灯防止CO污染空气2、工业炼铁(1)原理:CO在高温下具有还原性,可以把铁从铁矿石中置换出来(2)化学方程式:3CO+Fe2O3=3CO2+2Fe高温(3)原料:铁矿石、焦炭、石灰石石灰石的作用:把铁矿石中难溶的脉石变为炉渣而除去铁矿石、焦炭、石灰石Fe2O3+3CO===2Fe+3CO2高温CO2+C2CO高温C + O2 CO2点燃(4)设备:炼铁高炉(5)产品:生铁1、如图甲是实验室模拟炼铁的装置图,试回答:(1)按如图连接实验装置、检查装置的气密性、装药品、固定实验装置后,主要实验步骤有:①通入CO;②停止通入CO;③点燃酒精喷灯;④熄灭酒精喷灯;⑤验纯.正确的操作顺序是(填序号)(2)实验过程中仪器①中发生的反应的现象是.(3)实验中产生的尾气不能直接排放原因是.(4)图乙是炼铁高炉的结构图.其中焦炭在高炉炼铁时的作用之一是产生高温,另一作用为生铁出口低于炉渣出口的原因是.⑤①③④②红色固体逐渐变黑CO有毒防止空气污染和CO2反应生成CO炉渣的密度小于铁水的密度1、混合物中某物质的质量分数(纯度)=该物质的质量/混合物的总质量x100%=1-杂质的质量分数2、某物质的质量=混合物的总质量x该物质的质量分数(纯度)3、混合物的总质量=某物质的质量/该物质的质量分数(纯度)三.含杂质物质的计算m(纯)=m(不纯)×纯度m(不纯)=m(纯)÷纯度列比例时,一定要用纯量。习题1、用1000t含氧化铁(Fe2O3)80%的赤铁矿石,理论上可炼含铁96%的生铁多少吨?解:1000t赤铁矿石中含氧化铁的质量为1000t×80%=800t。设800t氧化铁理论上可以炼出铁的质量为X。Fe2O3+3CO===2Fe+3CO2高温160112800tX160800t=112XX=560t折合含铁96%的生铁的质量为560t÷96%=583t (纯化杂)答:1000t含氧化铁(Fe2O3)80%的赤铁矿石,理论上可炼出含铁96%的生铁为583t。2、某炼钢厂日产含杂质5%的生铁3000t,试计算: ⑴该3000t生铁中含纯铁多少吨? ⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石多少吨?(计算结果保留整数)解:⑴生铁中含纯铁:3000t×(1-5%)=2850t.⑵设需含Fe2O3质量分数为85%的赤铁矿石的质量为x。Fe2O3+3CO===2Fe+3CO2160112X·85%2850t高温160X·85%=1122850t答:⑴该3000t生铁中含纯铁2850t。⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石为4790t。3、某课外活动小组检测武汉钢铁厂生产的生铁样品的质量,在实验室中称取生铁屑样品10.0g放入烧杯中,加入一定量的稀硫酸,加热,使之充分反应(杂质不参加反应)。然后冷却、称量。反应后烧杯中物质的质量比反应前减少了0.34g。计算:(1)生铁屑样品中杂质的含量;(2)生产100t这种生铁,至少需要含氧化铁80%的赤铁矿的质量解题关键:根据质量守恒定律确定反应前后减少的质量即为生成氢气的质量,然后根据氢气质量计算出铁的质量,进而计算出杂质的含量。第二问可根据铁元素质量守恒来计算1、金属的腐蚀和防护(1)铁生锈:四.金属资源的保护用橡皮塞塞紧管口植物油哪种条件下,铁最易生锈?为什么?a.在干燥空气中b.浸没在水中c.半截浸没在水中abc不生锈(有O2无水)不生锈(有水无O2)在水与空气的交界面最易生锈(有水和O2)铁生锈的条件:铁与空气中的氧气、水蒸气发生化学反应4Fe+3O2+2XH2O=2Fe2O3·XH2O(缓慢氧化)铁制品锈蚀的条件:⑴要有能够发生反应的物质(Fe、H2O、O2);⑵反应物要能相互接触;⑶生成物不会对反应起阻碍作用Fe2O3·XH2O很疏松,易吸水,不能阻碍里层的铁继续与氧气、水蒸气反应,如不及时除去,会加快铁制品的生锈,使铁全部被腐蚀。而铝不同,铝与氧气反应生成致密的Al2O3薄膜,覆盖在铝的表面,从而保护里层的铝不再与氧气反应,所以铝耐腐蚀。氧化铁与铝壶表面的氧化铝膜性质比较铁锈(Fe2O3)氧化铝(Al2O3)结构特点若不除去结果疏松多孔致密结实完全锈蚀使铝“自我保护”防止铁生锈的方法(破坏铁生锈的条件即可):1.保持铁制品表面的洁净和干燥。 2.在铁制品表面涂油、刷漆、搪瓷(即表面生成致密的氧化膜保护层),使铁制品与空气隔绝。 3.制成耐腐蚀的合金,如不锈钢,就是在钢中加入一点镍和铬而制成的合金。4.牺牲性保护:把铁与一较活泼的金属相连接,因而防止铁生成Fe2+(aq)离子,从而防锈(镀锌)打强心针穿外衣2、如何利用和保护好金属(1)防止金属腐蚀(2)金属的回收利用(3)有计划,合理地开采矿物(4)寻找金属的代用品



















