



《《羧酸的化学反应》高中化学PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为1.13 MB,总共有55页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 55页
- 1.13 MB
- VIP模板
- ppt
- 数字产品不支持退货
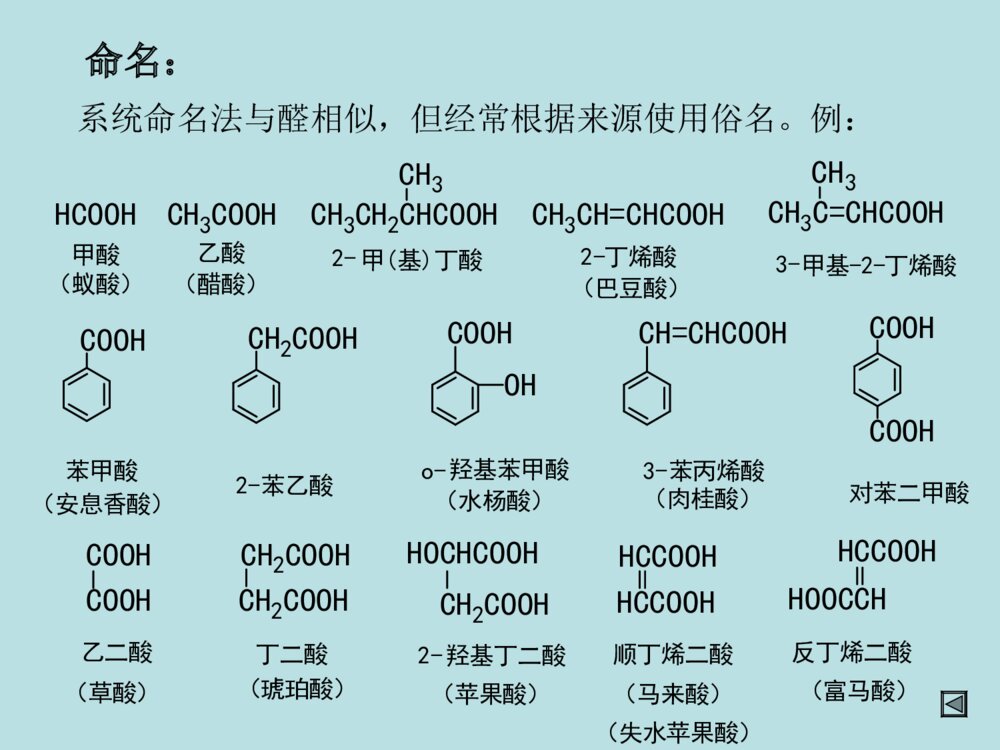
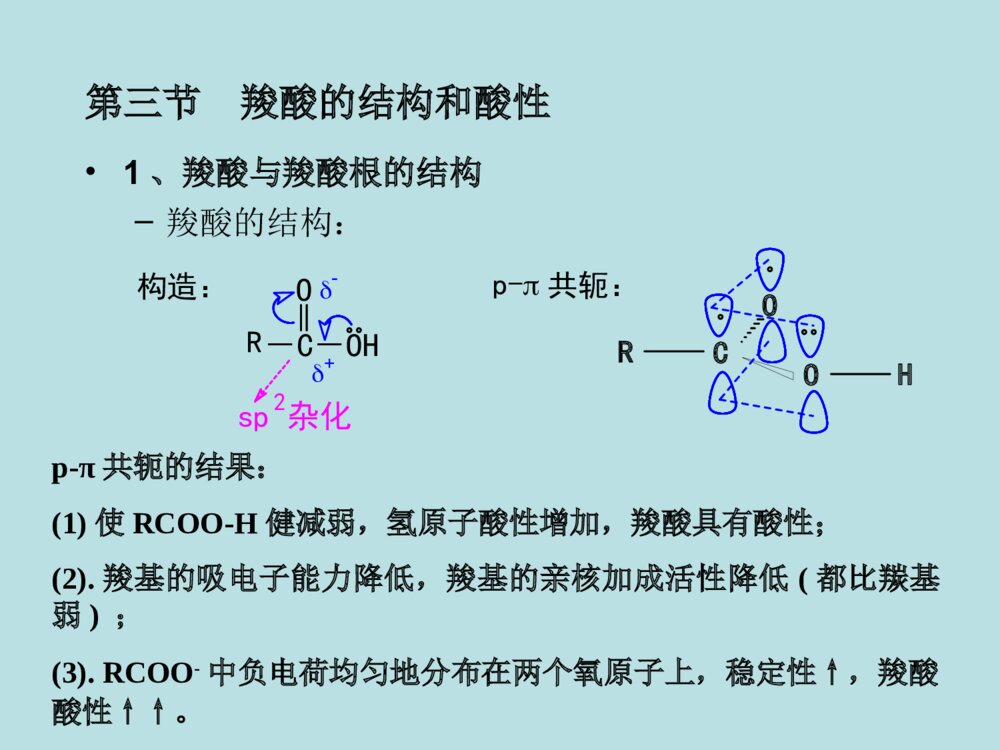
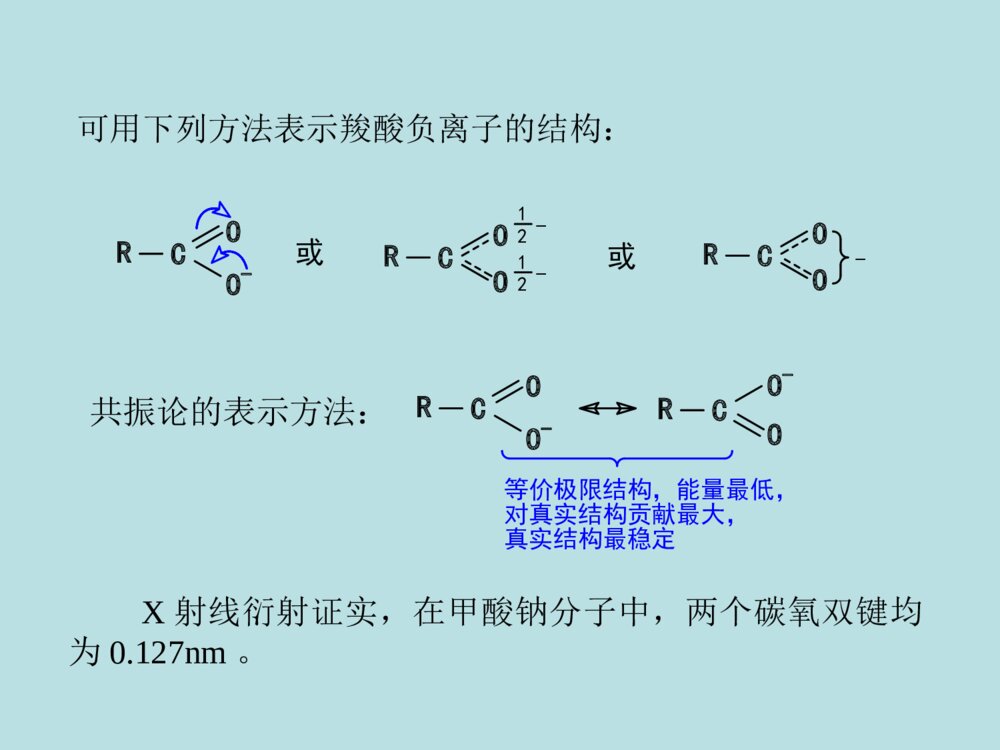
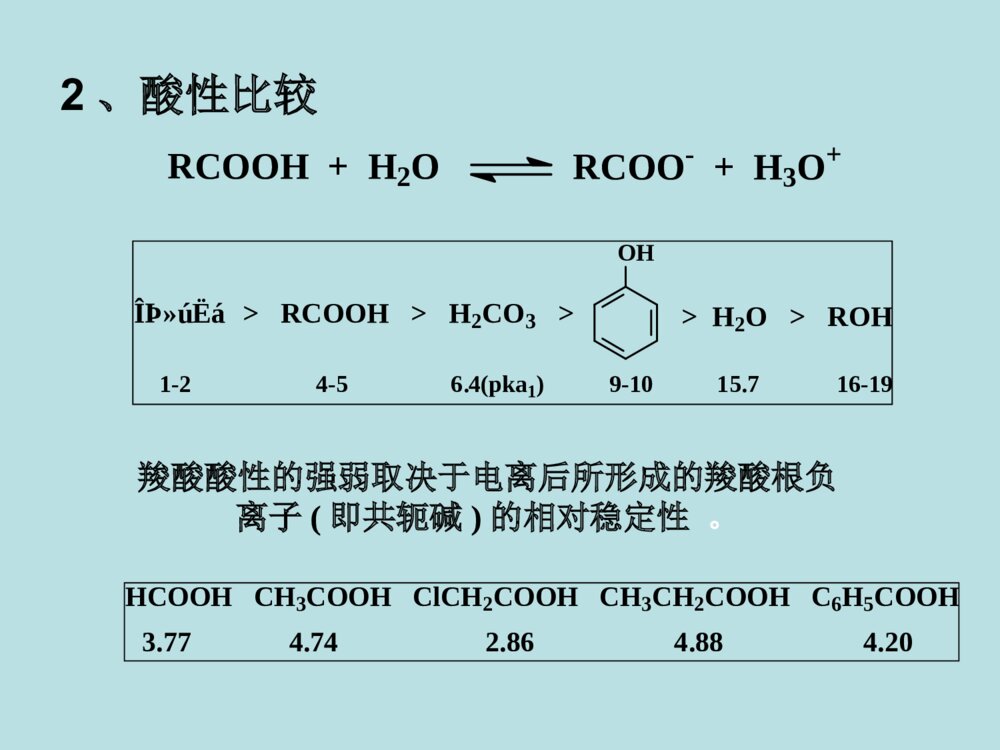
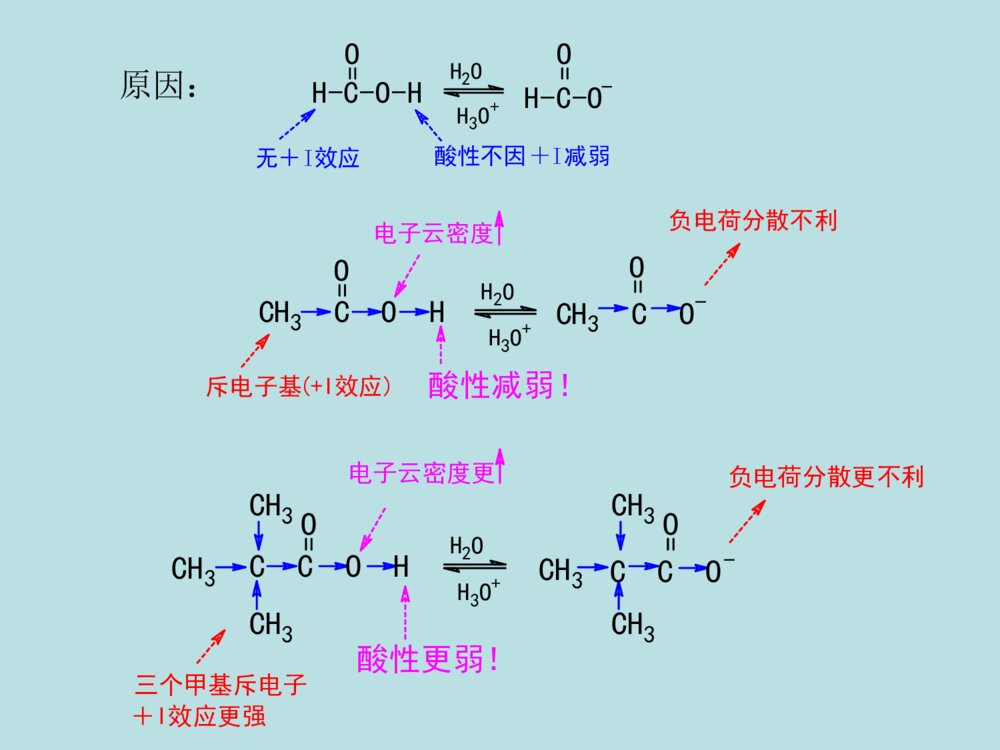
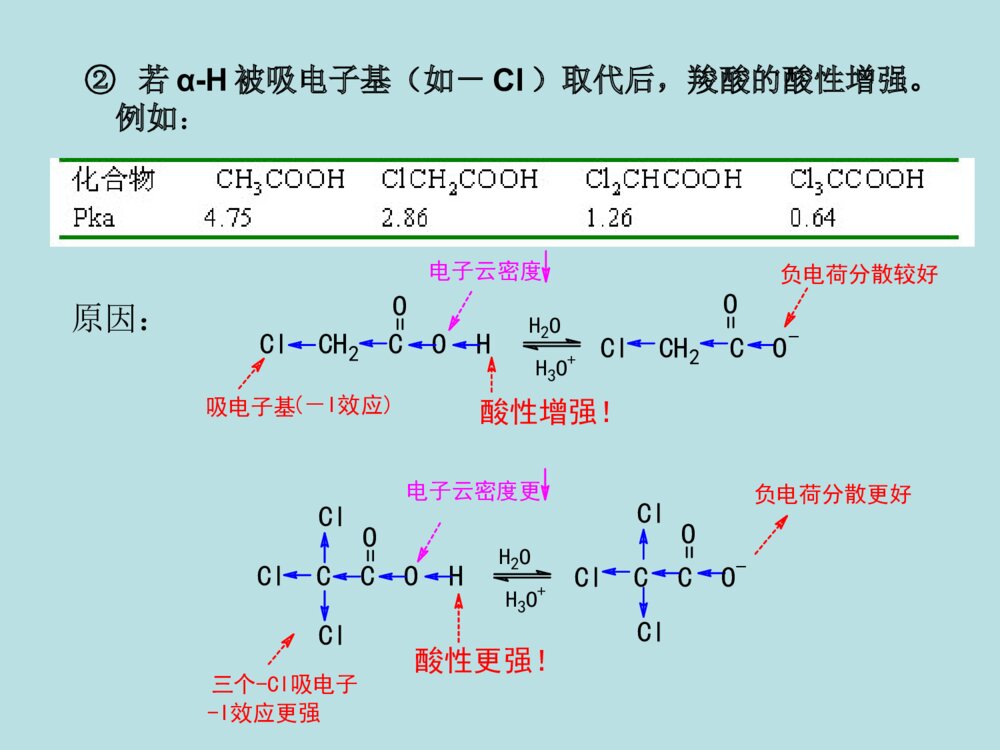
第十二章羧酸及取代羧酸第一节羧酸的分类和命名第二节羧酸的物理性质第三节羧酸的结构和酸性第四节羧酸的化学反应第五节羧酸的制备第六节取代羧酸第一节羧酸(一)羧酸的分类和命名分类:①按烃基不同:②按-COOH数目:一元酸二元酸多元酸、、CH2COOHHO-C-COOHCH2COOHCH3COOHCOOHCOOH脂肪酸芳香酸不饱和酸饱和酸R-COOHAr-COOHRCH=CHCOOHRCH2CH2COOH命名:系统命名法与醛相似,但经常根据来源使用俗名。例:HCOOHCH3COOH甲酸乙酸(蚁酸)(醋酸)CH3CH=CHCOOHCH3CH2CHCOOHCH3CH3C=CHCOOHCH32-丁烯酸3-2-丁烯酸甲基-2-甲(基)丁酸(巴豆酸)OHCOOHCOOHCOOHCH=CHCOOHCH2COOHCOOH苯甲酸对苯二甲酸苯乙酸2-苯丙烯酸3-羟基苯甲酸o-(水杨酸)(肉桂酸)(安息香酸)HOCHCOOHCH2COOHCH2COOHCH2COOHCOOHCOOHHOOCCHHCCOOHHCCOOHHCCOOH乙二酸丁二酸顺丁烯二酸反丁烯二酸羟基丁二酸2-(草酸)(琥珀酸)(苹果酸)(马来酸)(富马酸)(失水苹果酸)第二节羧酸的物理性质低级脂肪酸(C1-C3)是液体,可溶于水,具有刺鼻的气味。中级脂肪酸(C4-C9)也是液体,部分地溶于水,具有难闻的气味。高级脂肪酸(C10以上)是蜡状固体。无味,在水中溶解度不大。液态脂肪酸以二聚体形式存在。所以羧酸的沸点比相对分子质量相当的烷烃高。所有的二元酸都是结晶化合物。第三节羧酸的结构和酸性•1、羧酸与羧酸根的结构–羧酸的结构:共轭:p--C-OHOsp杂化2R构造:RHCOOp-π共轭的结果:(1)使RCOO-H健减弱,氢原子酸性增加,羧酸具有酸性;(2).羧基的吸电子能力降低,羧基的亲核加成活性降低(都比羰基弱);(3).RCOO-中负电荷均匀地分布在两个氧原子上,稳定性↑,羧酸酸性↑↑。可用下列方法表示羧酸负离子的结构:CORO1212--CORO-CORO-或或CORO-CO-RO等价极限结构,能量最低,对真实结构贡献最大,真实结构最稳定共振论的表示方法:X射线衍射证实,在甲酸钠分子中,两个碳氧双键均为0.127nm。2、酸性比较羧酸酸性的强弱取决于电离后所形成的羧酸根负离子(即共轭碱)的相对稳定性。RCOOH+H2ORCOO-+H3O+ÎÞ»úËá>RCOOH>H2CO3>>H2O>ROH1-24-56.4(pka1)9-1015.716-19OHHCOOHCH3COOHClCH2COOHCH3CH2COOHC6H5COOH3.774.742.864.884.203.影响酸性的因素•任何使酸根负离子稳定的因素都将增加其酸性,羧酸根负离子愈稳定,愈容易生成,酸性就愈强。•A.脂肪酸•①α-H被-R取代得越多,羧酸的酸性越弱。例如:Why?斥电子基(+I效应)酸性减弱!负电荷分散不利CH3COHOCH3CO-O电子云密度H2OH3O+负电荷分散更不利CCOHOCH3CH3CH3电子云密度更三个甲基斥电子+I效应更强酸性更弱!H2OH3O+CH3CH3CH3OCCO-H-C-O-HOH2OH3O+H-C-O-O无+I效应酸性不因+I减弱原因:②若α-H被吸电子基(如-Cl)取代后,羧酸的酸性增强。例如:吸电子基(-I效应)酸性增强!负电荷分散较好ClCH2COHOO电子云密度H2OH3O+ClCH2CO-ClCCOH负电荷分散更好O电子云密度更三个-Cl吸电子-I效应更强酸性更强!H2OH3O+ClClClOClCCO-Cl原因:③吸电子基距-COOH越远,对RCOOH的酸性影响越小。例如:原因:诱导效应随着碳链增长迅速减弱。ClCH2CH2CH2COOHClCH3CH2CCOOH给电子效应使RCOOH酸性减弱,吸电子效应使RCOOH酸性增强。吸电子效应强弱次序:NH3+>NO2>CN>COOH>F>Cl>Br>I>COOR>C≡C>OR>OH>C6H5>CH=CH2>H给电子效应强弱次序:O->COO->(CH3)3C>CH3CH2>CH3>H(B)芳香羧酸的情况分析取代基具有吸电子共轭效应时,酸性强弱顺序为:邻>对>间取代基具有给电子共轭效应(-NH2除外)时,酸性强弱顺序为:邻>间>对具体分析:邻位(诱导、共轭、场、氢键效应、空间效应均要考虑。)对位(诱导很小、共轭为主。)间位(诱导为主、共轭很小。)实例OHOOHOHCOOHOHCOOH诱导吸电子作用大、共轭给电子作用大、氢键效应吸电子作用大。邻位间位对位诱导吸电子作用中、共轭给电子作用小。诱导吸电子作用小、共轭给电子作用大。pka2.98pka4.08pka4.57苯甲酸的pka4.20C.二元酸•①酸性:pKa1<pKa2;pKa1<一元酸的pKa;•原因:两个-COOH,且-COOH有较强的-I效应。HOOC-(CH2)-COOHnn越小,pKa1越小,酸性越强n1>②羧酸的化学反应RCCOHOH-活泼H的反应酸性羰基的亲核加成,然后再消除(表现为羟基的取代)。羰基的亲核加成,还原。(一)羧酸的酸性与成盐HR(Ar)COO+R(Ar)COOH+-以卤素为例,说明酸性强弱顺序如下:FCH2COOH>ClCH2COOH>BrCH2COOH>ICH2COOHpKa2.672.872.903.16CH3COOHCH3CH2COOH>(CH3)2CHCOOH>(CH3)3CCOOHpKa3.774.764.864.875.05*1.羧酸盐是固体*2.羧酸盐的溶解度钠、钾、銨盐可溶于水,重金属盐不溶于水。*3.羧酸根具有碱性和亲核性羧酸盐能与活泼卤代烷反应。(二)形成羧酸衍生物酰氧键断裂,羟基被取代。1)形成酰卤亚硫酰氯(二氯亚砜)SOCl2,PCl3,PCl5COOH+SOCl2COCl+SO2+HCl3CH3CH2CH2COH+PCl3O3CH3CH2CH2CCl+H3PO3OCH3(CH2)6CClO+POCl3+HClCH3(CH2)6COHO+PCl52)形成酸酐羧酸在脱水剂下加热,生成酸酐。常用脱水剂:P2O5、Al2O3、浓H2SO4+H2OR-COR-COOHOH脱水剂R-COOR-COCOOHCOOHOOO230C。约100%某些二元酸只需加热便可生成五元或六元环的酸酐:交换反应+(CH3CO)2OR-COOR-CO+CH3COOHOHOR-C高级酸乙酸酐高级酸酐乙酸高级酸酐可通过乙酸酐与高级酸的交换反应得到:酸酐可利用羧酸盐与酰卤反应得到:ClOR\'-C+R-COOR\'-CO+NaClONaOR-C3)酯化反应CH3COOH+C2H5OHCH3COOC2H5+H2O投料1:1产率67%1:1097%酯化反应是一个可逆的反应,为了使正反应有利,通常采用的手段是:①使原料之一过量。②不断移走产物(例如除水,乙酸乙酯、乙酸、水可形成三元恒沸物bp70.4℃)H+(常用的催化剂有盐酸、硫酸、苯磺酸等)定义:羧酸与醇在酸的催化作用下失去一分子水而生成酯的反应称为酯化反应。酯化反应的机制1加成--消除机制OCH3C-OHH++OHCH3C-OHHOC2H5CH3-C-OHOHHOC2H5+双分子反应一步活化能较高质子转移加成消除四面体正离子CH3-C-OH2OHOC2H5+-H2O-H++OHCH3C-OC2H5OCH3C-OC2H5按加成--消除机制进行反应,是酰氧键断裂1OROH,2OROH酯化时按加成--消除机制进行,且反应速率为:CH3OH>RCH2OH>R2CHOHHCOOH>CH3COOH>RCH2COOH>R2CHCOOH>R3CCOOH①3oROH按此反应机制进行酯化。②由于R3C+易与碱性较强的水结合,不易与羧酸结合,故逆向反应比正向反应易进行。所以3oROH的酯化反应产率很低。2碳正离子机制属于SN1机制该反应机制也从同位素方法中得到了证明。(CH3)3C-OHH+(CH3)3COH2+-H2OOR-C-OC(CH3)3+OHR-C-OC(CH3)3(CH3)3C+O=C-ROH-H+按SN1机制进行反应,是烷氧键断裂OCH3C-O18H+(CH3)3COHO18CH3C-OC(CH3)3+H2O仅有少量空阻大的羧酸按此反应机理进行。3酰基正离子机制CH3CH3CH3C-OHOCH3CH3CH3C-OH2O+CH3CH3CH3C-OCH3OCH3CH3CH3C-OCH3O+HCH3CH3CH3CO+CH3CH3CH3CO+H2SO4(浓)-H+属于SN1机制。78%(三)羧基被还原一般还原剂不能将-COOH还原,LiAlH4或B2H6可将羧酸还原为伯醇:不还原C=C!(Ar)(Ar)R-C-OH+LiAlH4OR-CH2OHH2O无水乙醚也可先将羧酸转化为酯,再用Na+C2H5OH还原(间接还原羧酸):RCH2OHR\'OH/H+R-C-OHOR-C-OR\'ONa+C2H5OH酯(四)羧酸α-H的反应较活泼a.的吸电子性使活泼H-C-O共轭使羧酸的活性不及醛、酮b.p-HR-CH-C-OHHO赫尔-乌尔哈-泽林斯基反应1定义在少量三氯化磷或三溴化磷等催化剂的作用下,卤素取代羧酸α-H的反应称为赫尔-乌尔哈-泽林斯基反应。RCH2COOH+Br2PBr3-HBrRCHCOOHBr催化剂的作用是将羧酸转化为酰卤,酰卤的α-H具有较高的活性而易于转变为烯醇式,从而使卤化反应发生。所以用10%~30%的乙酰氯或乙酸酐同样可以起催化作用。控制卤素用量可得一元或多元卤代酸。碘代酸由α-氯(或溴)代酸与KI反应来制备。2反应机理RCH2COOHPBr3RCH2CBrO互变异构RCH=CBrOHBr-BrRCH-CBrBr+OH+Br--HBrRCH-CBrBrORCHCOOH+RCH2CBrBrORCH2COOH这步反应不会逆转(五)脱羧反应•羧酸分子中脱去羧基,放出CO2的反应。•饱和一元羧酸加热下难以脱羧。但若-COOH的α-C上有吸电子基时,脱羧反应容易发生。•一般的脱羧反应不用特殊的催化剂,而是在加热、碱性条件下进行。A-CH2-COOHACH3+CO2当A为吸电子基团,如:A=COOH,CN,C=O,NO2,CX3,C6H5等时。失羧反应极易进行。加热碱(六)二元羧酸受热后的反应:HOOC-CH2-COOHCH3COOH+CO2丙二酸(脱羧)HCOOH+CO2HOOC-COOH乙二酸(脱羧)CH2-COOHCH2-COOHCH2-CCH2-COOO+H2O丁二酸(脱水)CH2-COOHCH2-COOH+H2OH2CCH2-CCH2-COOOH2C(脱水)戊二酸+CO2+H2OCH2-CH2-COOHCH2-CH2-COOHCOCH2-CH2CH2-CH2己二酸(脱羧、脱水)CH2-CH2-COOHCH2-CH2-COOHH2CCH2-CH2CH2-CH2H2CCO+CO2+H2O庚二酸(脱羧、脱水)二元酸加热时:乙二酸、丙二酸脱羧丁二酸、戊二酸脱水己二酸、庚二酸脱羧、脱水原则上形成稳定的五元环、六元环小结成酸成酸酐成酮布朗克规则:在有机反应中,有可能成环时,一般形成五元或六元环。(一)氧化法第五节羧酸的制备醇、醛、芳烃、炔、烯、酮(卤仿反应)的氧化CH2=CHCH3+O2CH2=CHCOOH丙烯酸磷酸铋P,丙烯RCH2CH2R\'RCOOH+R\'COOH[O]长链烷烃皂用酸工业生产C(CH3)3COOHKMnO4CH2CH3C(CH3)3实验室制备芳酸(甲)烃氧化(乙)醇或醛氧化R-CHOR-COOH[O][O]R-CH2OH[O](Ar)(Ar)(Ar)[O]=KMnO4K2Cr2O7/H2SO4、R-CH=CH-CHOR-CH=CH-COOHAgNO3,NH3(Ar)(Ar)(丙)甲基酮氧化利用卤仿反应可以得到少一个碳的羧酸:(CH3)3CCH2CCH3O(CH3)3CCH2COOH+CHBr3(1)Br2,NaOH(2)H+,H2O,89%R-C-XOR-C-O-C-R\'OOR-C-OR\'OR-C-NH2ORCNCOOHCOOHOOOO2/V2O5500oCH2O(二)羧酸衍生物的水解反应特点:产物比反应物卤代烷多一个碳,与RCN同.腈的水解反应式RX+NaCNRCNRCOOHH2OH+orHO-醇反应注意事项1应用于伯卤代烃制腈,产率很好,叔仲卤代烃在NaCN下易消去。2芳香卤代烷不易制成芳腈。3如用卤代酸与NaCN反应制二元酸时,卤代酸应先制成羧酸盐。ClCH2COOHClCH2COONaNCCH2COONaHOOCCH2COOHNaOHNaCNNaOHH2OH+因为H+与NaCN反应放出HCN(1)1oRX、2oRX较好,3oRX需在加压条件下反应(否则易消除)(2)ArI、ArBr易制成格氏试剂、ArCl较难。(3)反应要控制低温。产物比RX多一个碳原子。(三)格氏试剂法格氏试剂和CO2的反应RXRMgXRCOOMgXRCOOHCO2H2OMg无水醚讨论(四)通过羰基化合物的缩合反应制备(四)通过羰基化合物的缩合反应制备11柏琴反应柏琴反应芳香醛与酸酐在相应羧酸盐作用下进行亲核加成,失去一分子羧酸,生成-芳基-α,-不饱和酸PhCHO+H3COCH3OOCH3COONaPhCOOH肉桂酸一个最简单的Perkin反应Perkin反应的一般形式Perkin反应机理2、克脑文格尔反应特点:•含双活化基团的羰基化合物作为亲核部分(提供烯醇负离子)•弱碱催化(一般为胺类化合物或吡啶),以避免醛的自身缩合,芳香醛,脂肪醛、酮都可以进行反应。醛(酮)在弱碱催化下与具有活泼亚甲基的化合物的缩合反应。CO2C2H5H2CX+OCRR\'BCO2C2H5CXCRR\'(X=-NO2,-CN,-COR,-CO2R)例:第六节取代羧酸的合成和反应1α-卤代酸的合成(赫尔-乌尔哈-泽林斯基反应)一、卤代酸的合成2-卤代酸的合成RCH=CH-COOH+HBrRCHCH2COOHBrCH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-COOHεα(一)卤代酸二卤代酸的反应1-卤代酸的反应R-CH-COOHBrR-CH-COOHR-CH-COOHR-CH-COOHR-CH(COOH)2NaOHH2OH+NH3①NaHCO3②NaCNOHNH2CNH3O+浓在Ag2O存在下,用稀碱作用,构型保持。浓碱作用下,构型翻转。O-OHCH3BrAg+OOHCH3OOHCH3O-OHCH3OHOHOHOHCH3OH-OHH+s-CH2BrCOOH-OHAg2O-AgBrCOO-COO-COO-CH3CH3CH3HHHBrBrHOHO-HO-Br---(S)-2-溴丙酸(R)-乳酸(S)-乳酸(S)-2-溴丙酸SN2反应邻基参与效应(R)--丙内酯2、β-卤代酸的反应有-H,在碱作用下,生成,β-不饱和酸无-H,在碱性CCl4溶液中,生成β-丙内酯,在碱水中,β-丙内酯开环。CH3CH2CHBrCH2COOHCH3CH2CH=CHCOOHCH3CH2CH=CHCOONaNaOH-H2OH+CH3-C-COOHCH3CH2BrCH3-C-COONaCH3CH2OHCH3COC=OCH3H2ONaOHNaOHCCl43γ卤代酸,在稀碱液中加热成五元环内酯CH2CH2CH2COOHXNa2CO3/H2OOOH2CCH2CH2COOX¦Ã-¶¡ÄÚõ¥(二)羟基酸一羟基酸的合成1、-羟基酸的合成(1)由羰基化合物加HCN,然后水解合成。(2)由-卤代酸合成。2、β-羟基酸的合成(1)β-氯醇与NaCN反应,再水解。(2)用瑞佛尔马斯基反应,然后将酯基水解。雷福尔马斯基反应OHR-CH-CH2-C-OC2H5OH2O/H+羟基酸乙酯OHR-CH-CH2-C-OHOH2O/OH-羟基酸H+OZnBrRCH-CH2-C-OC2H5O溴代乙酸酯+BrCH2COOC2H5ZnBrZnCH2-C-OC2H5O无水乙醚干醚R-C-HOCH2COOC2H5+ZnBrOCH2COOC2H5OZnBrCH2COOC2H5OH+H2O,H+2-(1-羟基环戊基)乙酸乙酯苯例:在Zn粉存在下,-卤代酸酯与醛或酮反应生成β-羟基酸酯,经过水解可得β-羟基酸。讨论:•①Reformasky反应与格氏反应类似,但用Zn不用Mg。因为BrZnCH2COOC2H5比BrMgCH2COOC2H5活性低,只与醛、酮反应,不与酯反应。•②用α-卤代酸酯,产物为β-羟基酸(酯)。(1)α-羟基酸受热时,两分子间相互酯化,生成交酯二.羟基酸的反应OHOOHH3CHOCHOHOHOOH3CCH3OO+2H2O乳酸丙交酯(2)β-羟基酸受热发生分子内脱水,主要生成α-β不饱和羧酸。RCHCH2COOHOHRCHCHCOOHH+H2O(3)γ-和δ-羟基酸受热,生成五元和六元环内酯。H3CCHOHCH2CH2COOHOH3CO+H2OÎìÄÚõ¥¦ÃCH2CHCH2COOHCH3CH2OHCH3CHCH2COOCH2CH2+H2O3¼×»ùÎìÄÚõ¥¦ÄRCH(R\')OCOOHHRCOH(R\')+HCOOH(4)羟基酸的脱羧在浓H2SO4or酸性KMnO4溶液中加热,脱羧成醛或酮。(三)酮酸结构:分子中含有羰基,又含有羧基的化合。如丙酮酸、3-丁酮酸等。1.羰基酸具有羰基和羧酸的典型反应。2.酮酸的特性反应α-与稀硫酸共热时,脱羧生成醛。β-酮酸受热易脱羧生成酮。CH3CCH2COOHOCH3CCH3O+CO2COOHOO+CO2CH3CCHCOOHOCH3CCH2O+CO2本章重点:1.羧酸的酸性,羧酸的酸性与结构的关系。2.羧酸的反应(取代反应、还原反应、α-氢的反应、脱羧反应、二元酸的热解反应)3.羟基酸的制法:羟基腈水解,柏琴反应、克脑文格尔反应。4.取代羧酸的性质。



















