





《人教版高二化学选修4《水的电离与溶液酸碱性》PPT课件》是由用户上传到老师板报网,本为文库资料,大小为491.63 KB,总共有24页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 24页
- 491.63 KB
- VIP模板
- pptx
- 数字产品不支持退货
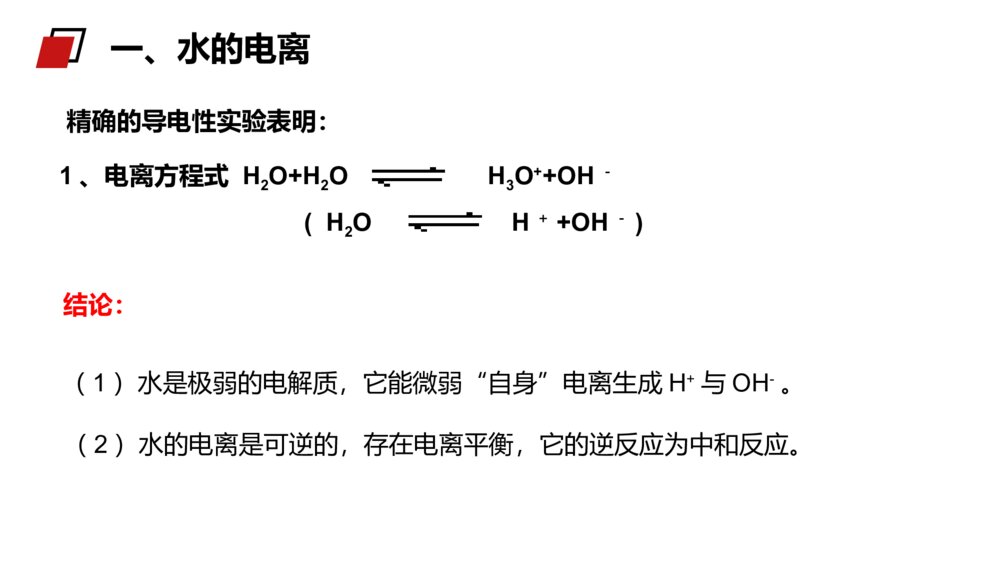
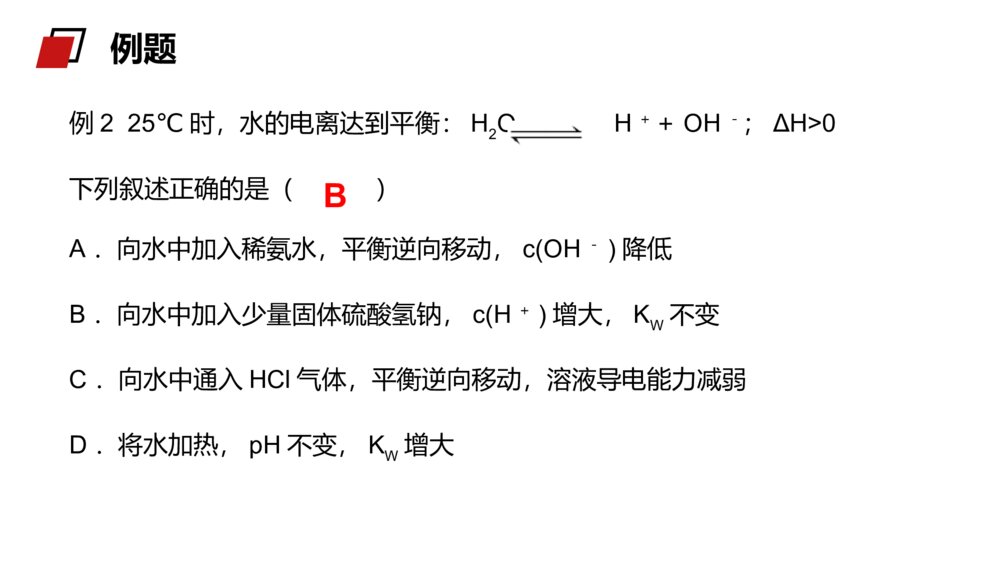
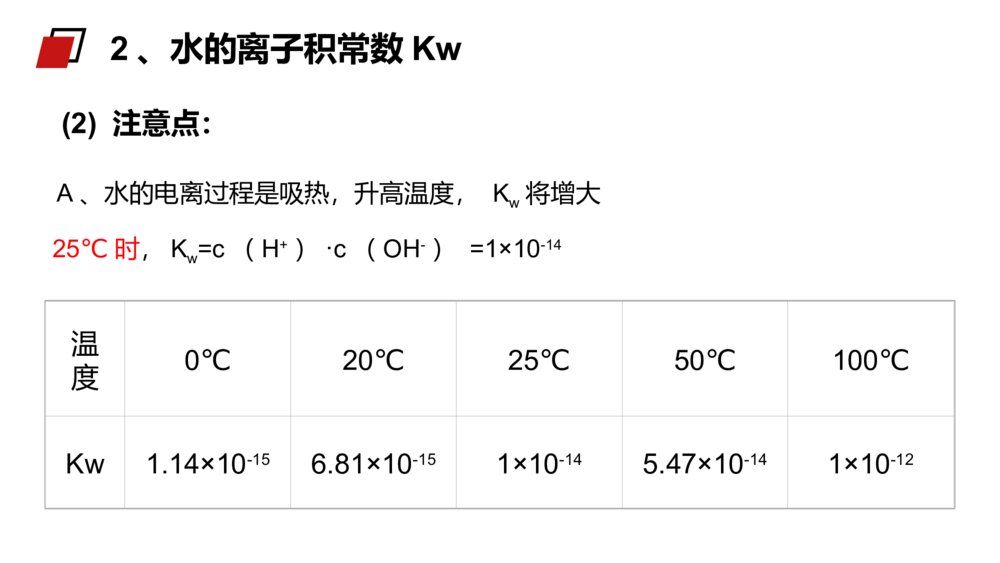
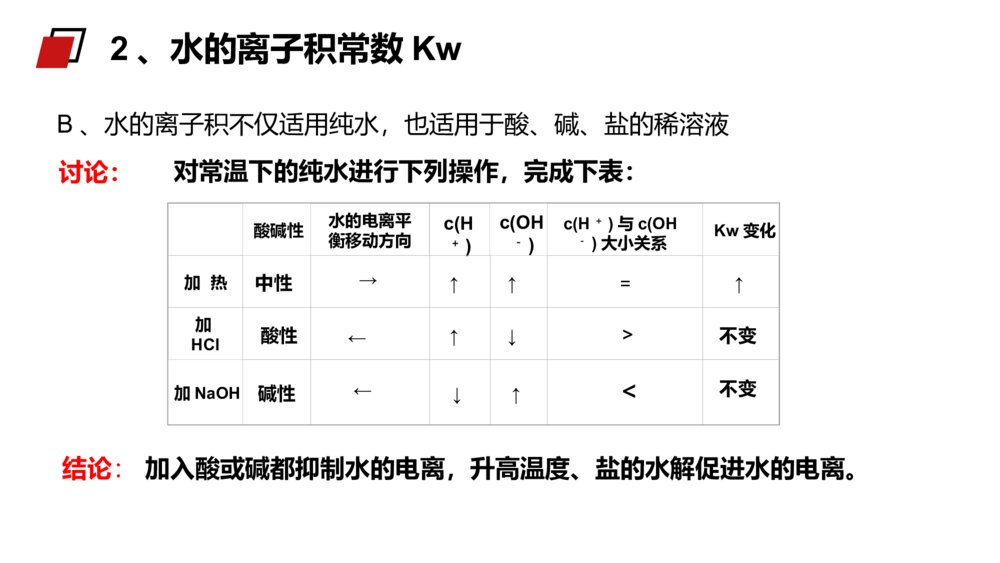
老师:xxxMENTALHEALTHCOUNSELINGPPT第二节水的电离与溶液酸碱性第三章水溶液中的离子平衡人教版高中化学选修4(高二)学习目标一、了解水的电离和水的离子积三、了解pH的应用二、了解溶液的酸碱性和pH精确的导电性实验表明:结论:1、电离方程式H2O+H2OH3O++OH-(H2OH++OH-)(2)水的电离是可逆的,存在电离平衡,它的逆反应为中和反应。(1)水是极弱的电解质,它能微弱“自身”电离生成H+与OH-。一、水的电离(3)影响因素:A、酸、碱:温度不变,在纯水中加入酸或碱,均使水的电离左移,Kw不变,α(H2O)变小B、温度C、易水解的盐:在纯水中加入能水解的盐,不管水解后显什么性,均促进水的电离,但只要温度不变,Kw不变。D、其他因素:如:向水中加入活泼金属酸碱抑制水的电离,盐的水解促进水的电离一、水的电离例1下列物质能促进水的电离的是()A.HClB.NaC.NaOHD.NaClB【解析】A、HCl为强酸,电离出的H+抑制水的电离,A错误。B、Na可以与水中的H+作用产生H2,促进了水的电离,B正确。C、NaOH为强碱,电离出的OH-抑制水的电离,C错误。D、NaCl为强酸强碱盐,对水的电离没有影响,D错误。例题例225℃时,水的电离达到平衡:H2OH++OH-;ΔH>0下列叙述正确的是()A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变C.向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱D.将水加热,pH不变,KW增大B例题(1)、定义:在一定温度下,水中c(H+)和c(OH-)的乘积Kw是一个常数,这个常数叫做水的离子积常数。已知25℃时,1L纯水电离出的n(H+)=n(OH-)=1×10-7mol,则c(H+)×c(OH-)=1×10-14mol2.L-2c(H+)×c(OH-)在一定温度下是个常数,叫做水的离子积常数,符号KW,该数据可由实验测得也可以通过理论计算求得。Kw=c(H+)·c(OH-)2、水的离子积常数Kw(2)注意点:A、水的电离过程是吸热,升高温度,Kw将增大25℃时,Kw=c(H+)·c(OH-)=1×10-14温度0℃20℃25℃50℃100℃Kw1.14×10-156.81×10-151×10-145.47×10-141×10-122、水的离子积常数Kw讨论:对常温下的纯水进行下列操作,完成下表:酸碱性水的电离平衡移动方向c(H+)c(OH-)c(H+)与c(OH-)大小关系Kw变化加热加HCl加NaOH中性→↑↑=↑酸性←↑↓>不变碱性←↓↑<不变B、水的离子积不仅适用纯水,也适用于酸、碱、盐的稀溶液2、水的离子积常数Kw结论:加入酸或碱都抑制水的电离,升高温度、盐的水解促进水的电离。例3常温下,某溶液中由水电离产生的c(H+)等于1.0×10-13mol/L,该溶液的溶质不可能是()A.H2SO4B.Na2SO4C.HNO3D.NaOH【解析】A.H2SO4会抑制水的电离,故A不选;B.Na2SO4对水的电离无影响,故B选;C.HNO3会抑制水的电离,故C不选;D.NaOH会抑制水的电离,故D不选。B例题例4常温下,在0.01mol·L-1氢氧化钡溶液中,由水电离出的氢氧根离子浓度是()A.5×10-13mol·L-1B.0.02mol·L-1C.1×10-7mol·L-1D.1×10-12mol·L-1Ac()WKOH14100.02【解析】0.01mol·L-1氢氧化钡溶液中,c(OH-)=0.02mol·L-1,c水(OH-)=c水(H+)===5×10-13mol·L-1,选A。例题例525℃时,若溶液中由水电离产生的c(OH-)=1×10-12mol/L,则下列说法正确的是()A.该溶液中水的电离被促进B.该溶液的pH一定为12C.该溶液中K+、Na+、Cl-、NO3-可以大量共存D.该溶液一定是NaOH溶液C【解析】25℃时,纯水中水电离产生的c(OH-)=1×10-7mol/L,该溶液中由水电离产生的c(OH-)=1×10-12mol/L<1×10-7mol/L,说明该溶液中的溶质抑制水的电离,则溶液可能是酸或碱溶液。A.通过上述分析溶液中的溶质抑制水的电离,A错误。B.溶液可能是酸或碱溶液,该溶液的pH=12或pH=2,B错误;C.无论该溶液是酸性还是碱性溶液,K+、Na+、Cl-、NO3-在该溶液中均可以共存,C正确;D.通过上述分析可知,该溶液可能是酸或碱溶液,D错误。例题1、定义:化学上常采用c(H+)的负对数来表示溶液的酸碱性。3、溶液的酸碱性与pH值的关系碱性溶液:c(H+)72、表示方法:pH=-lg{c(H+)}酸性溶液:c(H+)>c(OH—)pH<7中性溶液:c(H+)=c(OH—)pH=7二、溶液的酸碱性与pH值c(H+)=c(OH-)c(H+)>c(OH-)c(H+)<c(OH-)中性溶液c(H+)=1×10-7mol/Lc(OH-)=1×10-7mol/L碱性溶液c(H+)<1×10-7mol/Lc(OH-)>1×10-7mol/L酸性溶液c(H+)>1×10-7mol/Lc(OH-)<1×10-7mol/L注意:pH=0并非无H+,而是c(H+)=1mol/LpH=14并非无OH-,而是c(OH-)=1mol/L二、溶液的酸碱性与pH值讨论:KW(99℃)=1×10-12在100℃时,纯水中c(H+)为多少?pH是多少?显中性还是酸性或碱性?c(H+)=1×10-6mol/LpH=6显中性结论:不能用c(H+)等于多少来判断溶液酸、碱性,只能通过c(H+)和c(OH-)两者相对大小比较。二、溶液的酸碱性与pH值思考并讨论:如何判断溶液的酸碱性?某溶液中c(H+)=1×10-7mol.L-1,溶液是否呈中性?为什么?结论:c(H+)>c(OH-)溶液呈性,c(H+)=c(OH-)溶液呈性,c(H+)<c(OH-)溶液呈性。酸中碱二、溶液的酸碱性与pH值溶液c(H+)(mol·L-1)c(OH-)(mol·L-1)c(H+)与c(OH-)的关系KW酸性溶液>1×10-7<1×10-7c(H+)>c(OH-)=1×10-14中性溶液=1×10-7=1×10-7c(H+)=c(OH-)碱性溶液<1×10-7>1×10-7c(H+)<c(OH-)25℃时,溶液酸碱性与c(H+)、c(OH-)、KW的关系:二、溶液的酸碱性与pH值③常温下,任何稀的水溶液中c(H+)×c(OH-)=1×10-14。②不论是在中性溶液还是在酸碱性溶液,水电离出的c(H+)=c(OH-)。④根据Kw=c(H+)×c(OH-)在特定温度下为定值,c(H+)和c(OH-)可以互求。⑤通过H+和OH-的相对大小可以判断溶液的酸碱性。①任何水溶液中H+和OH-总是同时存在的,只是相对含量不同。思维建模:生活中,人们洗发时使用的护发素,主要功能也是调节头发的pH使之达到适宜的酸碱度。三、pH的应用在科学实验和工业生产中,溶液pH的控制常常是影响实验结果或产品质量、产量的一个关键因素。三、pH的应用1、水是一种极弱的电解质,弱电解质的电离过程因断裂化学键是吸热过程。2、KW=c(H+)×c(OH-)叫做水的离子积,该常数只受温度的影响,与其他因素无关,常温下数值为1×10-14。3、纯水中加入酸碱会抑制水的电离,升温会促进水的电离。4、溶液的酸碱性需根据c(H+)和c(OH-)的相对大小来确定,c(H+)>c(OH-)溶液呈酸性,c(H+)=c(OH-)溶液呈中性,c(H+)<c(OH-)溶液呈碱性。课堂总结:例6常温下,10-4mol/L的盐酸溶液。溶液中,c(OH-)=________mol/L。将上述盐酸稀释10倍,溶液中c(H+)=_______mol/L、c(OH-)=_____mol/L。将上述溶液稀释10000倍,溶液中c(H+)=_________mol/L、c(OH-)=__________mol/L。10-1010-510-9接近10-7接近10-7例题例7常温下,某溶液中由水电离产生的c(H+)等于1.0×10-13mol/L,该溶液的溶质不可能是()A.H2SO4B.Na2SO4C.HNO3D.NaOHB【解析】A.H2SO4会抑制水的电离,故A不选;B.Na2SO4对水的电离无影响,故B选;C.HNO3会抑制水的电离,故C不选;D.NaOH会抑制水的电离,故D不选。例题老师:xxxMENTALHEALTHCOUNSELINGPPT感谢各位的仔细聆听第三章水溶液中的离子平衡人教版高中化学选修4(高二)



















