








《电化学分析导论PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为231 KB,总共有23页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 23页
- 231 KB
- VIP模板
- ppt
- 数字产品不支持退货
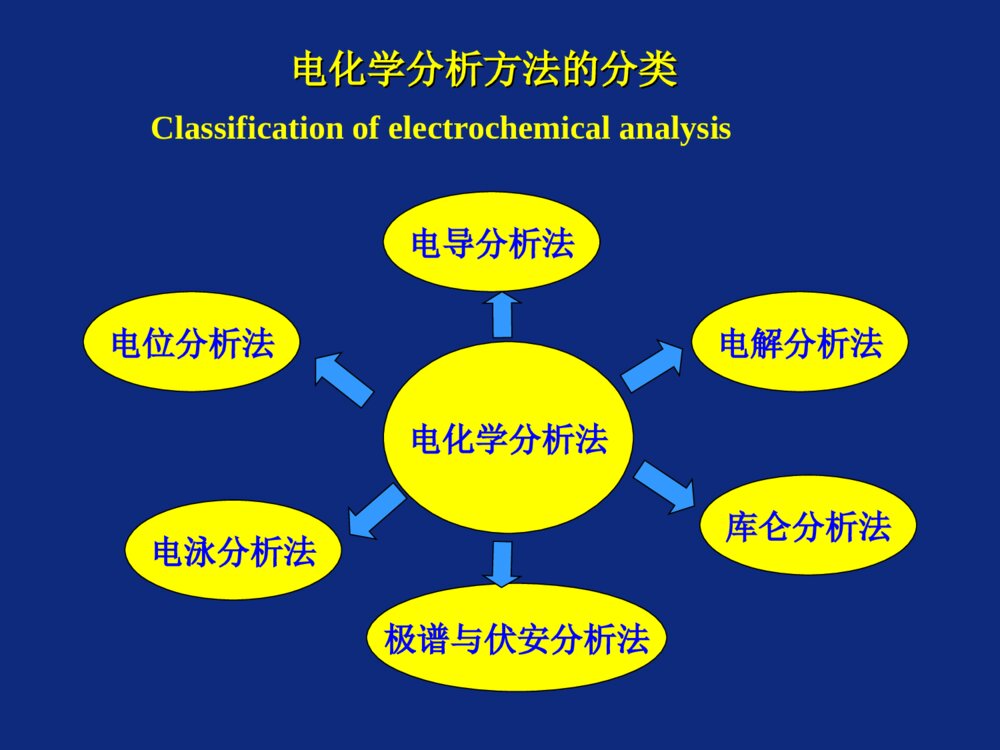
分析科学与分析技术分析科学与分析技术(仪器分析部分)(仪器分析部分)电化学分析方法的分类电化学分析方法的分类Classificationofelectrochemicalanalysis电化学分析法电位分析法电解分析法电泳分析法库仑分析法极谱与伏安分析法电导分析法电化学方法的分类和特点电化学方法的分类和特点TypesandCharacteristicsofElectroanalyticalMethodsTypesandCharacteristicsofElectroanalyticalMethods电参量分析方法电导电导法电极电位电位法/离子选择性电极法电量库仑法电流-电压极谱法/伏安法电化学分析方法习惯地按照测量的电化学参数分类:利用溶液的浓度在某种特定的条件下与化学电池的某个电物理量(电参量)之间有直接的定量关系,通过测量电参量进行分析。电化学方法的分类和特点电化学方法的分类和特点TypesandCharacteristicsofElectroanalyticalMethodsTypesandCharacteristicsofElectroanalyticalMethods通过测定化学电池中的某一电参量的突变作为容量分析的终点指示——电容量分析法:电位滴定法、电导滴定法、电流滴定法等。通过电极反应将试液中的待测组分转变为固相析出并与其它组分分离,进行重量或容量分析:电解分析法/电重量法IUPAC分类:即不涉及双电层,也不涉及电极反应:电导分析涉及双电层,但不涉及电极反应:表面张力和非法拉第阻抗的测量涉及电极反应:电位分析法、电解分析法、库仑分析、极谱和伏安分析电化学方法的特点电化学方法的特点CharacteristicsofElectroanalyticalMethodsCharacteristicsofElectroanalyticalMethods准确度高灵敏度高选择性好可测定组分含量范围宽仪器设备简单,自动化,连续分析无论哪一种电分析方法,都是以化学电池的特性为基础。电分析化学方法的进展电分析化学方法的进展化学修饰电极(ChemicallyModifiedElectrode)与自组装膜(SelfAssemblymembrane)离子选择电极超微电极和纳米电极色谱电化学和毛细管电泳电化学电分析化学方法的进展电分析化学方法的进展交叉学科联用技术光谱电化学法电化学扫描隧道显微镜法和电化学原子力显微镜法扫描电化学显微镜法电化学石英晶体微天平电分析化学方法的进展电分析化学方法的进展在生命科学中的研究与应用蛋白质和酶的直接电化学生物膜生物传感器和有机相生物传感器免疫分析:电化学免疫分析/电化学发光免疫分析/离子通道免疫传感器/电容免疫传感器单细胞水平检测仿生电化学释放电化学分析中的常见概念电化学分析中的常见概念原电池与电解池电极电位液体接界电位原电池与电解池原电池与电解池电解池:实现化学反应所需能量是由外部电源供给原电池:化学电池自发地将化学能转化为电能锌锌--铜原电池铜原电池化学电池的表达方式化学电池的表达方式电极反应阳极反应:ZnZn2++2e(氧化反应)阴极反应:Cu2++2eCu(还原反应)电化学池图解表示方式Zn|ZnSO4(1mol/L)||CuSO4(1mol/L)|CuEcell=φ右,还原–φ左,氧化若:Ecell0,电池反应自发进行,原电池Ecell0,电池反应不能自发进行,必须外加电压,电解池化学电池书写注意事项化学电池书写注意事项为了方便,原电池装置可用符号表示。书写电池的惯例如下:1.一般将负极写在左边,正极写在右边。2.写出电极的化学组成及物态,气态要注明压力(单位为kPa),溶液要注明浓度。3.单线“│”表示电极与溶液的界面。4.同一相中不同物质之间以及电极中其它相界面均用“,”分开。5.双线“‖”表示盐桥。6.气体或液体不能直接作为电极,必须附以不活泼金属(如铂)作电极起导体作用。纯气体、液体如H2(g)、Br2(l)紧靠电极板。电极电位电极电位定义:金属-溶液界面中由于带电质点的迁移,使两相界面的两边产生的电位差金属可以看成是离子与自由电子组成。金属离子以点阵结构排列,电子在其中运动。如:锌片与ZnSO4溶液接触,金属中Zn2+的化学势大于溶液中Zn2+的化学势,Zn不断溶解到溶液中,电子被留在Zn片上,使金属带负电,溶液带正电,两相间形成双电层。双电层的形成,破坏了原来金属和溶液两相间的电中性,形成了电位差。由于电位差的存在,从而排斥了Zn2+继续进入溶液,金属表面的负电荷对溶液中Zn2+又有吸引力,最终达到动态平衡,此时两相之间的电位差就是平衡电极电位。Electrodepotential:thedifferencebetweenthechargeonanelectrodeandthechargeinthesolution.形成原因:带电质点的迁移表述形式:Nernst方程:E=E0+[(RT)/(nF)]lnMn+电极电位电极电位影响电极电位的因素影响电极电位的因素金属与溶液间电位差的大小,取决于金属的性质,溶液中离子的浓度和温度;金属越活泼,电位越低;越不活泼,电位越高;在同一种金属电极中,金属离子浓度越大,电位越高,浓度越小,电位越低;温度越高,电位越高,温度越低,电位越低。电极电位的测定电极电位的测定标准氢电极(StandardHydrogenElectrode,S.H.E)电极电位的绝对值是无法测定的,但可以选定一个电极作为标准,将各种待测电极与它相比较,就可得到各种电极的电极电位相对值。国际纯粹和应用化学协会(IUPAC)选定“标准氢电极”作为比较标准。标准氢电极是氢离子浓度为1mol·L-1,氢气的压力为101.325kPa的电极。国际上规定,标准氢电极的电极电位为零。用符号H+/H2=0表示。其电极书写为:H+(1mol.L-1),H2(101.325kPa)│Pt标准氢电极的结构示意图标准氢电极的结构示意图容器中装有H+浓度为1mol·L-1的溶液,插入一铂片。为了增大吸附氢气的能力,铂片表面上镀一层疏松的铂黑。在298K时,不断从套管的支管中通入压力为101.325kPa的纯氢气,H2被铂黑吸附直到饱和。这时整个铂黑片仿佛是由氢气组成,铂黑吸咐的H2和溶液中的H+构成了氢电极标准氢电极结构示意图电极电位的测定举例电极电位的测定举例IUPAC规定任何电极的电位是:它与标准氢电极构成原电池,所测得的电动势作为该电极的电极电位;电子通过外电路,由标准氢电极流向该电极,电极电位为正值;电子通过外电路,由该电极流向标准氢电极,电极电位为负值。标准电极电位:在298.15K时,以水为溶剂,当氧化态和还原态活度等于1时的电极电位称为标准电极电位。电极电位的测定举例电极电位的测定举例例1:请写出测定锌电极的标准电极电位的化学电池表达式,并根据所学知识推断锌电极的电极电位是正值还是负值。PtH2(101325Pa),H+(1mol.dm-3)Zn2+(1mol.dm-3)Zn例2:请写出测定铜电极的标准电极电位的化学电池表达式,并根据所学知识推断铜电极的电极电位是正值还是负值。电极电位与电动势电极电位与电动势ZnZnSO4(1mol/L)CuSO4(1mol/L)CuEcell=φ右,还原–φ左,氧化若:Ecell0,电池反应自发进行,原电池Ecell0,电池反应不能自发进行,必须外加电压,电解池液体接界电位液体接界电位(I)(II)HCl稀HCl浓H+H+Cl-Cl-++++++++++----------液接电位的形成图中c(I)0(I)(II)HCl稀HCl浓H+H+Cl-Cl-液接电位的消除φ(I)-φ(III)0φ(III)-φ(II)0KCl(III)K+Cl-液体接界电位液体接界电位形成原因不同溶液直接接触时,在它们的相界面上要发生离子的迁移,出现电位差,产生了液接电位;消除办法液接电位会影响电池电动势的测量结果,实际工作中必须设法消除,或尽量降低到最小限度。消除方式:盐桥消除原理:盐桥中饱和KCl溶液的浓度较高,且K+、Cl-迁移数接近,主要是盐桥中K+、Cl-扩散到溶液中,K+、Cl-扩散速率相近,使盐桥与溶液接触处产生的液接电位很小,约为1-2mV。



















