





《化学家眼中的物质世界PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为1.06 MB,总共有46页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 46页
- 1.06 MB
- VIP模板
- ppt
- 数字产品不支持退货
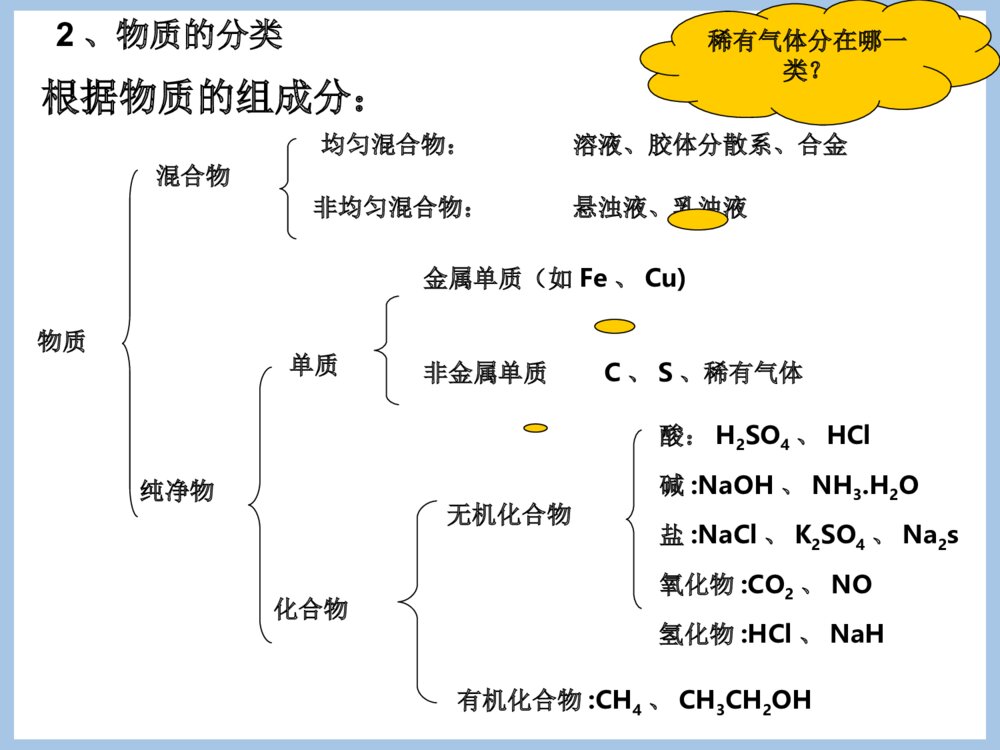
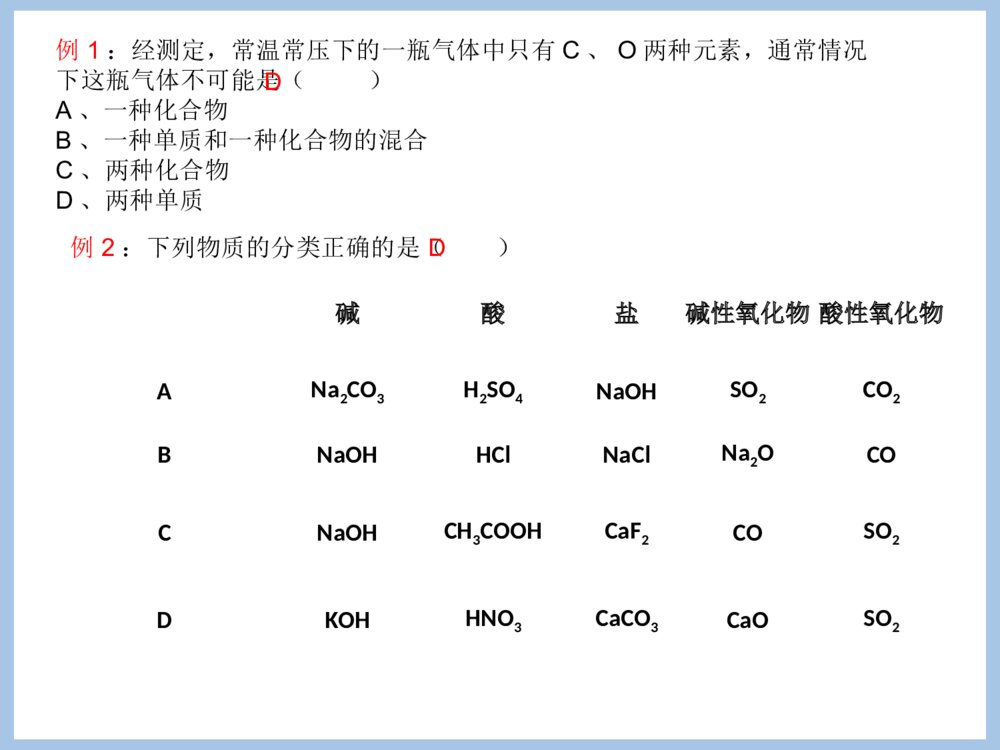
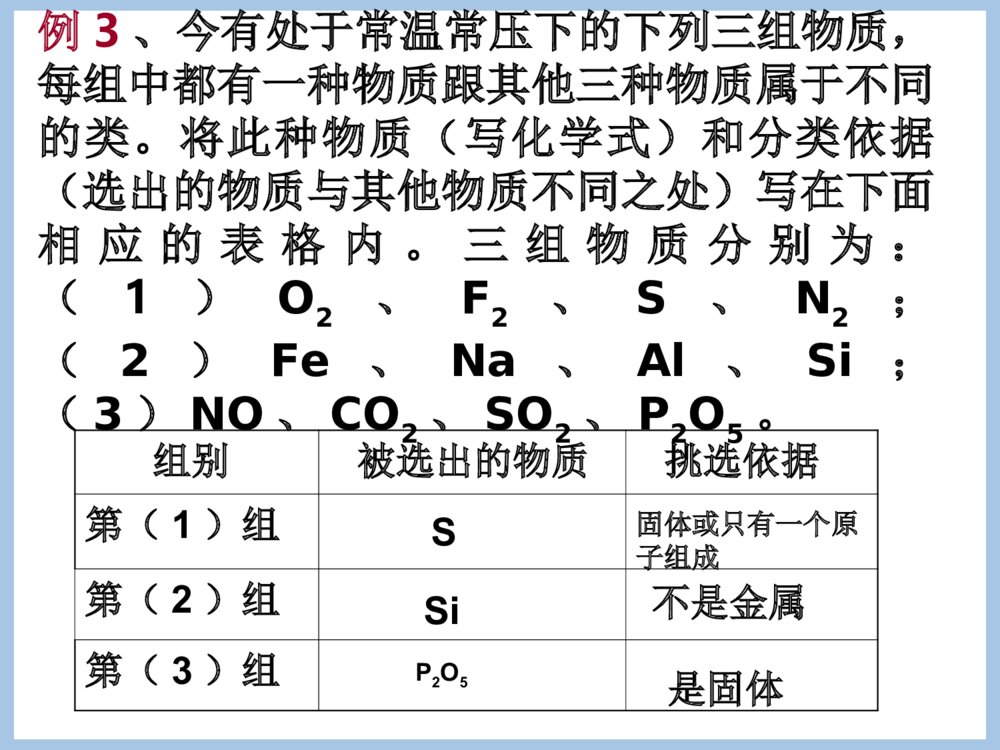
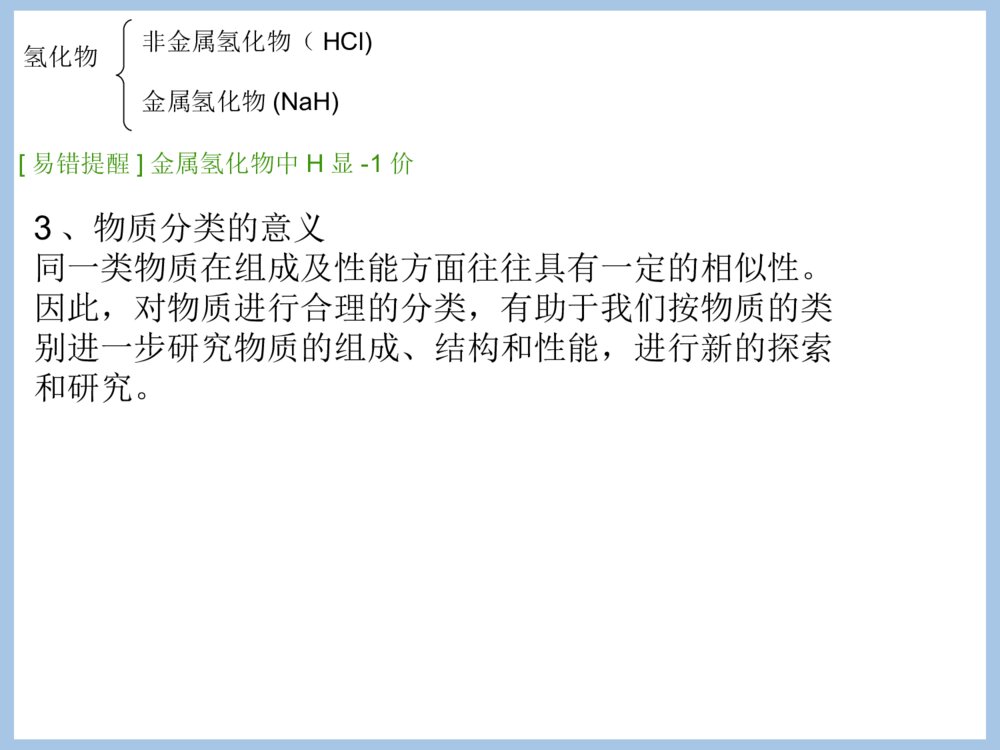
专题1化学家眼中的物质世界第一单元丰富多彩的化学物质第一课时一)物质的分类1、物质的分类方法(分类标准或依据)以物质的属性,物质一般有如下分类方法:①根据存在状态:气态、液态和固态物质②根据导电性能:导体、半导体和绝缘体③根据盐的溶解性:可溶性盐和难溶性盐[AgCl、BaSO4、CaCO3、BaCO3、CuCO3。]④根据物质的组成:混合物和纯净物[注意]物质的分类标准不同,分类结果不同。如H2SO4、HCl均为酸,HCl也为氢化物,H2SO4则不属于氢化物。物质纯净物混合物均匀混合物:非均匀混合物:单质化合物金属单质(如Fe、Cu)非金属单质有机化合物:CH4、CH3CH2OH无机化合物酸:H2SO4、HCl碱:NaOH、NH3.H2O盐:NaCl、K2SO4、Na2s氧化物:CO2、NO氢化物:HCl、NaH根据物质的组成分:悬浊液、乳浊液溶液、胶体分散系、合金稀有气体分在哪一类?C、S、稀有气体2、物质的分类例1:经测定,常温常压下的一瓶气体中只有C、O两种元素,通常情况下这瓶气体不可能是()A、一种化合物B、一种单质和一种化合物的混合C、两种化合物D、两种单质D例2:下列物质的分类正确的是()碱酸盐碱性氧化物酸性氧化物ANa2CO3H2SO4NaOHSO2CO2BNaOHHClNaClNa2OCOCNaOHCH3COOHCaF2COSO2DKOHHNO3CaCO3CaOSO2D例3、今有处于常温常压下的下列三组物质,每组中都有一种物质跟其他三种物质属于不同的类。将此种物质(写化学式)和分类依据(选出的物质与其他物质不同之处)写在下面相应的表格内。三组物质分别为:(1)O2、F2、S、N2;(2)Fe、Na、Al、Si;(3)NO、CO2、SO2、P2O5。组别被选出的物质挑选依据第(1)组第(2)组第(3)组S固体或只有一个原子组成Si不是金属P2O5是固体[注意]其中酸、碱、盐、氧化物、氢化物还可以再分类酸根据酸根中是否有氧元素无氧酸(如HCl)含氧酸(如HNO3)根据一个酸分子中最多电离的H+数一元酸(如HCl)二元酸((H2SO4)三元酸(H3PO4)根据酸在水中溶解性不同可溶性酸(HNO3、H2SO4)难溶性酸(H2SiO3硅酸)碱根据碱在水中溶解性不同可溶性碱(如NaOH)难溶性碱[Mg(OH)2、Fe(OH)3、Cu(OH)2]根据碱在水中最多能电离出的OH-数一元碱二元碱三元碱盐根据酸根含氧酸盐(K2SO4)无氧酸盐(K2S)根据在水中溶解性不同可溶性盐(NaCl)微溶性盐(CaSO4、Ag2SO4)难溶性盐(BaSO4)根据组成盐的阴阳离子不同正盐:即不含能电离的氢离子,也不含OH-1的盐。(Na2CO3)酸式盐:电离时生成的阳离子除金属离子{或NH+(有金属离子性质)}外还有H+,阴离子为酸根离子的盐(NaHCO3)碱式盐:电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子或NH+。[Cu2(OH)2CO3]氧化物根据组成元素金属氧化物(Na2O)非金属氧化物(CO)根据化学性能碱性氧化物:与水反应只生成碱,或与酸反应只生成盐和水的氧化物(Na2O)酸性氧化物:能与水作用生成生成相应相应价态的酸或与碱作用只生成盐和水(CO2、SO3、SO2、Mn2O7)两性氧化物:与酸碱反应都可以生成盐和水的氧化物Al2O3不成盐氧化物:不能与酸碱作用生成盐(CO)氢化物非金属氢化物(HCl)金属氢化物(NaH)[易错提醒]金属氢化物中H显-1价3、物质分类的意义同一类物质在组成及性能方面往往具有一定的相似性。因此,对物质进行合理的分类,有助于我们按物质的类别进一步研究物质的组成、结构和性能,进行新的探索和研究。例4:下面每组中都有一种物质与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来。(1)NaCl、KCl、NaClO、BaCl2(2)HClO3、KClO3、Cl2、NaClO3(3)H3PO4、H4SiO4、HCl、H2SO4(4)悬浊液、乳浊液、氯化钠溶液、H2O(5)空气、N2、HCl气体、FeSO4.7H2O(6)铜、金、汞、钠答案:(1)NaClO,是含氧酸盐,只有NaClO不是氯化物,化合价与其他几个也不同。(2)Cl2,单质或只有Cl2在常温常压下是气态。(3)HCl无氧酸。(4)H2O纯净物。(5)空气(或FeSO4.7H2O)空气是混合物;FeSO4.7H2O是固态。(6)钠(或汞)只有钠是活泼金属,在金属活动性顺序表中排在H之后;只有汞是为液态。第一单元丰富多彩的化学物质一、物质的分类与转化第二课时化学反应的四种基本类型:根据反应物和生成物的类别以及反应前后物质类的多少分。反应类型特征化合反应:A+B=AB分解反应:AB=A+B置换反应:AB+C=A+CB或:AB+C=AC+B复分解反应:AB+CD=AD+CB化合反应:单质与单质化合:单质与化合物化合:化合物与化合物化合:分解反应:•产物是两种的分解反应•产物是三种的分解反应置换反应金属置换金属金属置换非金属非金属置换金属非金属置换非金属复分解反应酸与碱反应酸与盐反应碱与盐反应盐与盐反应总结金属与盐发生置换反应的条件?复分解反应的条件复分解反应的条件是什么?–写出下列反应的方程式,不能反应的说明原因–氯化钠与硝酸钾反应–氯化钠与硝酸银–氢氧化钡与硫酸钠–氢氧化钡与氯化钠–硫酸与氢氧化钠–硫酸与硝酸镁–碳酸钙与盐酸2、根据反应中是否有化合价变化划分:氧化还原反应和非氧化还原反应(1)氧化反应:化合价升高的反应(2)还原反应:化合价降低的反应思考:四种基本反应类型中有哪些是氧化还原反应?思考:四种基本反应类型有哪些是氧化还原反应?(3)氧化还原反应与四种基本反应类型的关系:化合反应氧化还原反应分解反应氧化还原反应置换反应氧化还原反应复分解反应氧化还原反应不全是不全是全部是不是思考:有单质参加和生成的反应肯定是氧化还原反应吗?3、根据是否有离子参加反应划分:离子反应和非离子反应4、根据反应进行的程度划分:可逆反应和不可逆反应5、根据反应中的能量变化划分:放热反应和吸热反应例5、同学们吃的零食的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。(1)生石灰属于哪种类别的物质?(2)生石灰可做干燥剂的理由是什么?(用化学方程式表示)(3)生石灰还可以跟哪些类别的物质发生化学反应?列举两例,并写出化学方程式。(4)小纸袋中的物质能否长期持续地做干燥剂?为什么?金属氧化物CaO+H2O=Ca(OH)2略不能。因为当干燥剂中的CaO全部与H2O反应后,包装袋中就只剩下Ca(OH)2,而Ca(OH)2不和H2O反应。摩擦剂摩擦剂的物质类别(指酸、碱、盐、氧化物)X牙膏Z牙膏Y牙膏氢氧化铝碳酸钙二氧化硅例6:对牙膏的探究要用到许多化学知识。(1)下表列出了三种牙膏的摩擦剂,请在表中填写三种摩擦剂所属的物质类别:碱盐盐氧化物(2)根据你的推测,牙膏摩擦剂在水中的溶解性是()难溶(3)Y牙膏中的摩擦剂————碳酸钙可以用石灰石来制备,某学生设计了一种实验室制备碳酸钙的实验方案,其流程如图所示:石①生②加水石③Na2CO3溶液灰→石→灰→碳酸钙石灰水请写出上述方案中有关化学反应的化学方程式:①:②:③:第一单元丰富多彩的化学物质(第三课时)二、物质的量第一课时二、物质的量•1、意义:表示一定数目微粒的集合体的物理量•符号:n如:硫酸的物质的量不能简化为硫酸的量也不能写成硫酸的质量或硫酸的数量注意:a、物质的量是一个专有名词,由四个字组成,是一个整体,不能分割,也不可加字、减字。b、物质的量是国际单位制中的七个基本物理量之一(物质的量、长度、时间、质量、电流、热力学温度、发光强度)。c、物质的量是微观粒子数目与宏观物质的质量联系的桥梁。2、物质的量的单位:基本单位:摩尔简称摩,符号mol说明:a、1mol:一定数目粒子集体与0.012kg12C所含碳原子数相等,数目约为6.02×1023个。b、摩尔是物质的量的单位,如同米是长度的单位一样。【注意】1、“物质的量”这个物理量只适用于微观粒子,如原子、分子、离子、质子、中子等微粒;不能表示宏观粒子。2、物质的量所指粒子必须十分明确,且粒子种类要用化学式表示。判断:1、下面叙述是否正确(A)摩尔是国际单位制中七个基本物理量之一。(B)摩尔是物质的质量单位。(C)摩尔是物质的数量单位。(D)1摩尔大米约含有6.02×1023个米粒(E)1mol氢分子约含有6.02×1023个氢分子2、判断下列写法是否正确,并说明理由。A、1mol氢B、1mol氧元素C、0.5molCO2D、1mol乒乓球答案:1、(A)错误(B)错误(C)错误(D)错误2、错误,错误,正确,错误讨论1摩尔水分子中有多少摩尔氢原子,多少摩尔氧原子?H2O11molNA2HO212NANA1mol2mol结论:微粒之间的个数之比也就是物质的量之比微粒个数微粒集团物质的量【课堂练习】2、填空:1molH2所含氢气原子的个数个。2molH2含个氢分子,含个氢原子。0.5molClO3-含个氯酸根离子。2×6.02×10232×6.02×10234×6.02×10230.5×6.02×10233、阿伏加德罗常数(NA)①阿伏加德罗常数的含义:0.012kg12C中所含的碳原子数称为阿伏加德罗常数,在计算中通常使用6.02×1023mol-1这个近似值,它可用符号NA表示,其单位是mol-1。②阿伏加德罗常数是1mol某种微粒的集体中所含的微粒个数,即阿伏加德罗常数是摩尔的基准。③阿伏加德罗常数是一个物理量,单位为mol-1,即NA约为6.02×1023mol-1,而不是6.02×1023。④6.02×1023mol-1不是阿伏加德罗常数,阿伏加德罗常数不是一个精确值,阿伏加德罗常数的近似值为6.02×1023mol-1。4、物质所含微粒数目(N)、物质的量(n)、阿伏加德罗常数(NA)的关系(物质所含微粒数目)N=(物质的量)n.(阿伏加德罗常数)NA。物质的量(n)=物质所含微粒数目(N)阿伏加德罗常数(NA)填空(1)1mol碳原子约含有个碳原子6.02×1023(2)0.3mol硫酸分子约含有个硫酸分子0.3×6.02×1023(3)10mol钠离子约含有个钠离子10×6.02×1023物质的量是微粒的集体,可以用分数或小数表示。(4)6mol电子约含有个电子6×6.02×1023(5)0.5mol中子约含有个中子0.5×6.02×1023物质的量(n)=物质所含微粒数目(N)阿伏加德罗常数(NA)思考:物质的量(n)、微粒数(N)、阿伏加德罗常数(NA)关系选择0.1molKClO3和0.1molKClO中所含微粒数相等的是()(A)钾离子(B)氯离子(C)氯原子(D)氧原子ACKClO3=K++ClO3-KClO=K++ClO-小结(1)物质的量是表示物质所含微粒多少的物理量,摩尔是它的单位,每摩尔物质含有阿伏加德罗常数个微粒,约为6.02×1023(2)应具体说明是哪一种微观粒子(3)以阿伏加德罗常数为桥梁进行物质的量和微粒数之间的换算:物质的量微粒数×NA..NA第一单元丰富多彩的化学物质(第四课时)第二课时二、摩尔质量思考:•1mol任何粒子所含的粒子个数是相同的,那么,1mol不同微粒的质量是否相同呢?1mol任何物质都含有阿伏加德罗常数个微粒,请计算1mol下列物质的质量。由以上计算结果可得出什么规律?微粒符号物质式量每个微粒质量1摩尔物质质量C121.993×10-23gH2ONa+182323g2.990×10-23g3.821×10-23g12g18g结论:1mol任何物质的质量,以克为单位,数值上等于该物质的式量(相对分子质量,相对原子质量或原子团、离子的式量)。1摩尔物质的质量填空(1)1mol铜原子的质量是克63.5(2)1mol硫酸分子的质量是克98(3)1mol氧分子的质量是克32(4)1molOH-离子的质量是克17(5)1molNa+离子的质量是克232、摩尔质量1)定义:2)单位:单位物质的量的物质所具有的质量。用M表示克/摩或克·摩-1符号:g/mol或g.mol-13)数值:等于该物质的式量。(注意单位)物质的量(mol)物质的质量(g)摩尔质量(g/mol)n=m/M=思考:为什么摩尔质量以g.mol-1为单位时,数值上等于其相对式量?回顾•初中学习的相对原子质量、相对分子子质量的标准是什么?•你能结合通过初中相对原子质量的定义式推导某元素X的摩尔质量么?相对原子质量(Ar)是指以一个碳-12原子质量的1/12作为标准,任何一种原子的平均原子质量跟一个碳-12原子质量的1/12的比值,成为该原子的相对原子质量。相对分子质量(Mr)指各个原子的相对原子质量的总和。相对原子质量=原子真实质量÷碳原子质量的1/12摩尔质量=1mol物质微粒的质量=原子真实质量×阿伏加德罗常数=碳原子质量的1/12×相对原子质量×阿伏加德罗常数(12g12C的原子个数)=12g×1/12×相对原子质量=相对原子质量,证毕,数值一样,单位不同。1个碳-12原子的质量经实验测定为1.993×10-26kg。则1mol碳-12原子的质量=1.993×1026kg×NA=1.99310-26kg×6.02×1023mol-1=11.99786×10-3kg=11.99786≈12g填空(1)氯分子的摩尔质量是克/摩71(2)氢氧化钠的摩尔质量是克/摩40(3)镁原子的摩尔质量是克/摩24(4)Cl-离子的摩尔质量是克/摩35.5(5)K+离子的摩尔质量是克/摩39[例1]90克水相当于多少摩水?解:水的式量是18,水的摩尔质量是18g/mol。n(H2O)=90g18g/mol=5mol答:90克水相当于5mol水。[例2]2.5mol铜原子的质量是多少克?解:铜的相对原子质量是63.5,铜的摩尔质量是63.5g/mol。m(Cu)=2.5mol63.5g/mol×=158.8g答:2.5mol铜原子的质量等于158.8g。[例3]4.9克硫酸里含有多少个硫酸分子?解:硫酸的式量是98,硫酸的摩尔质量是98g/mol。n(H2SO4)=4.9g98g/mol=0.05mol答:4.9克硫酸里含有3.01×1022个硫酸分子。N(H2SO4)=0.05mol×6.02×1023mol-1=3.01×1022[练习]20.2克硝酸钾中,氧元素的质量是多少克?解:硝酸钾的式量是101,硝酸钾的摩尔质量是101g/mol。n(KNO3)=20.2g101g/mol=0.2mol答:20.2克硝酸钾中,氧元素的质量是9.6g。n(O)=0.2mol×3=0.6molm(O)=0.6mol×16g/mol=9.6g例1:下列关于物质的量的叙述中,正确的是()A、1mol任何物质都含有6.02×1023个分子B、28g氮的物质的量是1mol,1molH2O中含有2mol氢和1mol氧C、物质的量就是物质的数量,6.02×1023叫做阿伏加德罗常数D、1molNe中约含有6.02×1024个电子,1molH2SO4中含有4molO例2:若NA代表阿伏加德罗常数的值,则下列说法中正确的是()[多选]A、2.3g钠由原子变成离子时,失去的电子数为0.1NAB、0.2NA个硫酸分子与19.6g磷酸含有相同的氧原子数C、28g氮气中所含的原子数为NAD、NA个氧分子与NA个氢气分子的质量之比为8:1例3:NaOH在水中完全电离为Na+和OH-,将4gNaOH溶于水中,若要使每100个H2O分子中含有1个Na+,则需要水的物质的量是()A、0.1molB、1molC、10molD、100molDA、BC例4:已知12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为(),R的相对原子质量为(),含R1.6g的Na2R的物质的量为()62g.mol-1160.1mol小结通过物质的量把可称量的宏观物质与难以称量的微观粒子有机地联系起来。物质的量微粒数NA÷NA..×MM质量NA-阿伏加德罗常数约6.02×1023mol-1M-摩尔质量(克/摩)22.4L(标准状况)6.02×1023分子标准状况下的气体摩尔体积示意图第二节气体摩尔体积第五课时



















