







《《化学平衡常数化学反应进行的方向》高三化学一轮复习PPT课件》是由用户上传到老师板报网,本为文库资料,大小为865.9 KB,总共有54页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 54页
- 865.9 KB
- VIP模板
- pptx
- 数字产品不支持退货
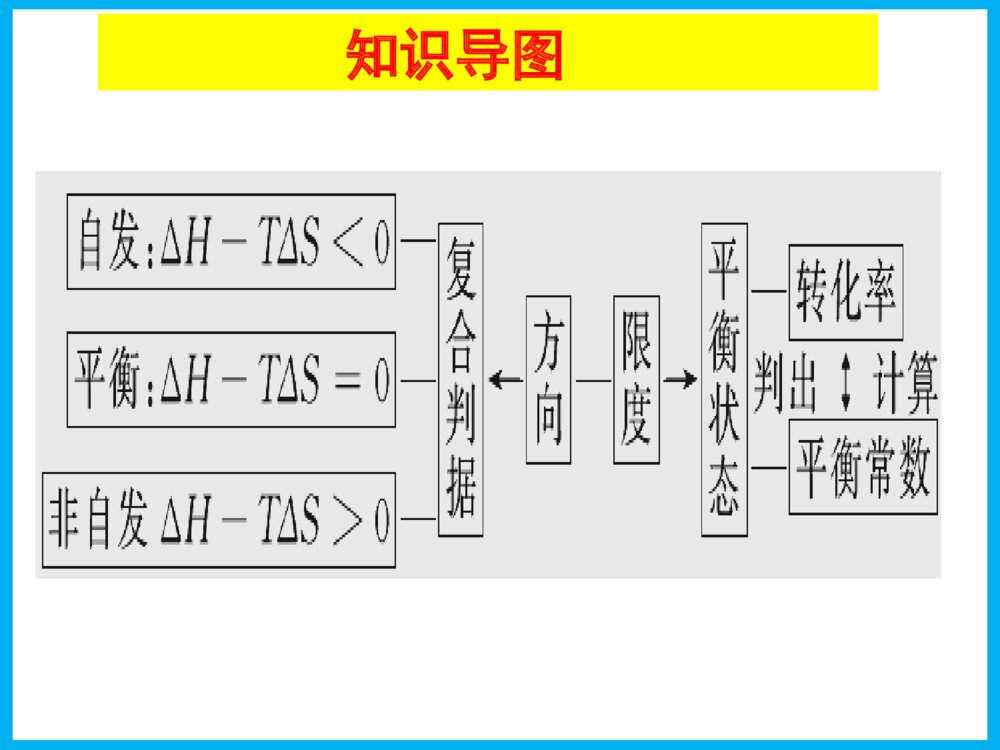
高三化学备课组高三化学一轮复习化学平衡常数化学反应进行的方向考纲要求1.了解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。2.了解化学反应的方向与焓变和熵变的关系;能够利用焓变和熵变判断化学反应的方向。近三年高考分析年份课标卷选择题填空题考向预测20151卷化学平衡的计算、外界条件对化学平衡的影响通过对高考试题的分析,本部分试题每年必考,难度一般中等偏上,多侧重于个知识的的综合考察,在填空中的情景多侧重于与生产实际的联系2卷化学平衡图像的分析、计算20161卷化学平衡的计算、外界条件对化学平衡的影响2卷化学平衡的应用、外界条件对化学平衡的影响、化学平衡图像的分析3卷化学平衡图像的分析20171卷化学平衡的计算2卷外界条件对化学平衡的影响、化学平衡图像的分析3卷化学平衡状态的判断、化学平衡的计算知识导图平衡常数化学反应进行的方向考点二化学平衡的计算 考点一化学平衡常数知识梳理·题型构建考点三化学反应进行的方向 重难点突破1.对某一可逆反应,升高温度则化学平衡常数一定变大()2.增大反应物的浓度,平衡正向移动,化学平衡常数增大()3.可根据K随温度的变化情况判断反应的热效应()4.化学平衡常数和转化率都能体现反应进行的程度()××√√预习检测(限时练)考点一 化学平衡常数 1.化学平衡常数(1)表达式对于反应mA(g)+nB(g)≒pC(g)+qD(g),K=(固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中)。浓度幂之积cpC·cqDcmA·cnBcpC·cqDcmA·cnBK1=c2NH3cN2·c3H2K2=cNH3c12N2·c32NH3K3=c3H2·cN2c2NH3K1=K22=1K31.对于N2(g)+3H2(g)≒2NH3(g) K1N2(g)+H2(g)≒NH3(g) K22NH3(g)≒N2(g)+3H2(g) K3试分别写出平衡常数表达式,并判断其关系_________________________________________________________。2321K1=c2NH3cN2·c3H2K2=cNH3c12N2·c32NH3K3=c3H2·cN2c2NH3K1=K22=1K32321答案:(1)K=cHCl·cHClOcCl2(2)K=cCO·cH2cH2O(3)K=cOH-·cHCO-3cCO2-3(4)K=c(CO2)2.书写下列化学平衡的平衡常数表达式。(1)Cl2+H2O≒HCl+HClO(2)C(s)+H2O(g)≒CO(g)+H2(g)(3)CO32-+H2O≒HCO3-+OH-(4)CaCO3(s)≒CaO(s)+CO2(g)答案:(1)K=cHCl·cHClOcCl2(2)K=cCO·cH2cH2O(3)K=cOH-·cHCO-3cCO2-3(4)K=c(CO2)(2)意义:①K值越大,正反应进行的程度________,反应物的转化率________。②一般认为,K>________时反应进行得就基本完全了。(3)影响因素K只受________影响,与反应物或生成物的浓度变化无关。越大越大105温度(4).三种应用①判断化学反应可能进行的程度,K值________,反应进行的程度________。同等条件下反应物的转化率________。②判断化学平衡移动的方向,对于可逆反应aA(g)+bB(g)≒cC(g)+dD(g),在一定温度下的任意时刻,反应物与生成物浓度有如下关系:ccC·cdDcaA·cbB=Qc,称为浓度商。Qc<K反应向________方向进行,v正________v逆=K反应处于化学平衡状态,v正________v逆>K反应向________方向进行,v正________v逆。③判断反应的热效应,若升高温度,K值增大,则正反应为________反应;若升高温度,K值减小,则正反应为________反应。越大越大越大正反应>=逆反应<吸热放热(4).三种应用①判断化学反应可能进行的程度,K值________,反应进行的程度________。同等条件下反应物的转化率________。②判断化学平衡移动的方向,对于可逆反应aA(g)+bB(g)≒cC(g)+dD(g),在一定温度下的任意时刻,反应物与生成物浓度有如下关系:ccC·cdDcaA·cbB=Qc,称为浓度商。Qc<K反应向________方向进行,v正________v逆=K反应处于化学平衡状态,v正________v逆>K反应向________方向进行,v正________v逆。③判断反应的热效应,若升高温度,K值增大,则正反应为________反应;若升高温度,K值减小,则正反应为________反应。例1.下列关于平衡常数的说法正确的是( )A.一定温度下的可逆反应,只有达到平衡状态时才具有平衡常数B.化学平衡移动时,平衡常数一定改变C.对于一个确定的反应来说,平衡常数的数值越大,反应限度越大D.化学平衡常数大的可逆反应,所有反应物的转化率一定大C 题型一 化学平衡常数及其影响因素例2.已知下列反应在某温度下的平衡常数:H2(g)+S(s)≒H2S(g) K1S(s)+O2(g)≒SO2(g) K2则在该温度下反应H2(g)+SO2(g)≒O2(g)+H2S(g)的平衡常数为( )A.K1+K2 B.K1-K2C.K1×K2D.K1/K2D针对练习:p120题组一1、2题型二 化学平衡常数的应用4.[2016·金版原创]甲醇是重要的化工原料和清洁液体燃料。工业上可利用CO或CO2来生产甲醇。甲醇制备的相关信息如下表:例题:甲醇是重要的化工原料和清洁液体燃料。工业上可利用或来生产甲醇。甲醇制备的相关信息如下表:(1)反应②的化学平衡表达式为K=______________,该反应是________反应(填“吸热”或“放热”)。某温度下,各物质的平衡浓度符合下式:5c(CO2)·c(H2)=2c(CO)·c(H2O)试判断此时温度为________。cH2O·cCOcH2·cCO2吸热800℃(2)500℃时,向容器中充入1molCO、5molH2O,发生反应②,达到平衡后,其化学平衡常数K________1.0(填“大于”“小于”或“等于”),在其他条件不变的情况下,扩大容器容积,平衡________移动(填“向正反应方向”“向逆反应方向”或“不”),化学平衡常数K2________(填“变大”“变小”或“不变”)。等于不不变4.[2016·金版原创]甲醇是重要的化工原料和清洁液体燃料。工业上可利用CO或CO2来生产甲醇。甲醇制备的相关信息如下表:(3)据上表信息推导出K1、K2与K3之间的关系,K3=________(用K1、K2表示)。500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,此时v正________v逆(填“>”“<”或“=”)。(4)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图1所示,则用H2浓度变化表示此段时间内该反应的平均速率v(H2)=__________________。K1·K2>4.[2016·金版原创]甲醇是重要的化工原料和清洁液体燃料。工业上可利用CO或CO2来生产甲醇。甲醇制备的相关信息如下表:(3)据上表信息推导出K1、K2与K3之间的关系,K3=________(用K1、K2表示)。500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,此时v正________v逆(填“>”“<”或“=”)。(4)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图1所示,则用H2浓度变化表示此段时间内该反应的平均速率v(H2)=__________________。0.15mol·(L·min)-1若某温度下反应①中H2的平衡转化率(α)与体系总压强(p)的关系如图2所示,则平衡状态由A变到B时,平衡常数KA________KB(填“>”“<”或“=”)。4.[2016·金版原创]甲醇是重要的化工原料和清洁液体燃料。工业上可利用CO或CO2来生产甲醇。甲醇制备的相关信息如下表:若某温度下反应①中H2的平衡转化率(α)与体系总压强(p)的关系如图2所示,则平衡状态由A变到B时,平衡常数KA________KB(填“>”“<”或“=”)。=4.[2016·金版原创]甲醇是重要的化工原料和清洁液体燃料。工业上可利用CO或CO2来生产甲醇。甲醇制备的相关信息如下表:(5)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是________(用相应字母表示)。A.容器中总压强不变B.混合气体的平均摩尔质量不变C.混合气体的密度不变D.CO2(g)或CO(g)的浓度不变D4.[2016·金版原创]甲醇是重要的化工原料和清洁液体燃料。工业上可利用CO或CO2来生产甲醇。甲醇制备的相关信息如下表:1、某温度下气体反应达到化学平衡,平衡常数K=cA·c2Bc2E·cF,恒容时,温度降低,K减小。下列说法中正确的是()A.增大c(A)、c(B),K增大,反应进行的程度越大B.降低温度,正反应速率增大C.该反应的焓变为负值D.该反应的化学方程式为:2E(g)+F(g)≒A(g)+2B(g)D题组二:1、某温度下气体反应达到化学平衡,平衡常数K=cA·c2Bc2E·cF,恒容时,温度降低,K减小。下列说法中正确的是()A.增大c(A)、c(B),K增大,反应进行的程度越大B.降低温度,正反应速率增大C.该反应的焓变为负值D.该反应的化学方程式为:2E(g)+F(g)≒A(g)+2B(g)2、(2017·江西省红色六校联考)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:化学反应平衡常数温度℃500800①2H2(g)+CO(g)≒CH3OH(g)K12.50.15②H2(g)+CO2(g)≒H2O(g)+CO(g)K21.02.50③3H2(g+CO2(g)≒CH3OH(g)+H2O(g)K3(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。K1·K2 (2)反应③的ΔH________0(填“>”或“<”)。< 化学反应平衡常数温度℃500800①2H2(g)+CO(g)≒CH3OH(g)K12.50.15②H2(g)+CO2(g)≒H2O(g)+CO(g)K21.02.50③3H2(g+CO2(g)≒CH3OH(g)+H2O(g)K3(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正________v逆(填“>”“=”或“<”)。>化学反应平衡常数温度℃500800①2H2(g)+CO(g)≒CH3OH(g)K12.50.15②H2(g)+CO2(g)≒H2O(g)+CO(g)K21.02.50③3H2(g+CO2(g)≒CH3OH(g)+H2O(g)K3解题建模解答化学平衡计算题的“万能钥匙”——三段式法1.步骤(1)写出涉及的可逆反应的化学方程式。(2)找出起始量、转化量和平衡量中哪些是已知量,哪些是未知量,按“三段式”列出。(3)根据问题建立相应的关系式进行计算。考点2:有关化学平衡的计算2.具体方法(1)分析三个量:即起始量、转化量、平衡量。(2)明确三个关系①对于同一反应物,起始量-转化量=平衡量。②对于同一生成物,起始量+转化量=平衡量。③各变化量之比等于各物质的化学计量数之比。(3)计算模式对于反应:mA(g)+nB(g)pC(g)+qD(g),令A、B起始物质的量(mol)分别为a、b,达到平衡后,A的消耗量为mx,容器容积为VL。mA(g)+nB(g)pC(g)+qD(g)起始(mol)ab00转化(mol)mxnxpxqx平衡(mol)a-mxb-nxpxqx则有:①平衡常数:K=②A的平衡浓度:c(A)平=mol·L-1。③A的转化率:α(A)平=,α(A)∶α(B)==。pxVp·qxVqa-mxVm·b-nxVna-mxVmxa×100%mxa∶nxbmbna④A的体积分数:φ(A)=×100%。⑤平衡与起始压强之比:p平p始=。⑥混合气体的平均密度ρ混=g·L-1。⑦混合气体的平均摩尔质量M=g·mol-1。a-mxa+b+p+q-m-nxa+b+p+q-m-nxa+ba·MA+b·MBVa·MA+b·MBa+b+p+q-m-nx题型三有关化学平衡的计算例题:已知可逆反应:M(g)+N(g)≒P(g)+Q(g) ΔH>0,请回答下列问题:(1)在某温度下,反应物的起始浓度分别为c(M)=1mol·L-1,c(N)=2.4mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为________。(2)若反应温度升高,M的转化率________(填“增大”“减小”或“不变”)。(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)=2mol·L-1,a=______。(4)若反应温度不变,反应物的起始浓度为c(M)=c(N)=bmol·L-1,达到平衡后,M的转化率为________。25%增大641%题型三 有关化学平衡的计算1、(2016·北京朝阳期末)活性炭可处理大气污染物NO,反应原理:C(s)+2NO(g)≒N2(g)+CO2(g)。T℃时,在2L密闭容器中加入0.100molNO和2.030mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol。下列说法不合理的是()A.该温度下的平衡常数是K=916B.达到平衡时,NO的转化率是60%C.3min末达到平衡,则v(NO)=0.01mol·L-1·min-1D.升高温度有利于活性炭处理更多的污染物NOD1、(2016·北京朝阳期末)活性炭可处理大气污染物NO,反应原理:C(s)+2NO(g)≒N2(g)+CO2(g)。T℃时,在2L密闭容器中加入0.100molNO和2.030mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol。下列说法不合理的是()A.该温度下的平衡常数是K=916B.达到平衡时,NO的转化率是60%C.3min末达到平衡,则v(NO)=0.01mol·L-1·min-1D.升高温度有利于活性炭处理更多的污染物NO2.(2016·安徽省“学普”联考)已知反应X(g)+Y(g)≒R(g)+Q(g)的平衡常数与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.2molX和0.8molY,反应初始4s内v(X)=0.005mol/(L·s)。下列说法正确的是()A.4s时容器内c(Y)=0.76mol/LB.830℃达平衡时,X的转化率为80%C.反应达平衡后,升高温度,平衡正向移动D.1200℃时反应R(g)+Q(g)≒X(g)+Y(g)的平衡常数K=0.4温度/℃70080083010001200平衡常数1.71.11.00.60.4B2.(2016·安徽省“学普”联考)已知反应X(g)+Y(g)≒R(g)+Q(g)的平衡常数与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.2molX和0.8molY,反应初始4s内v(X)=0.005mol/(L·s)。下列说法正确的是()A.4s时容器内c(Y)=0.76mol/LB.830℃达平衡时,X的转化率为80%C.反应达平衡后,升高温度,平衡正向移动D.1200℃时反应R(g)+Q(g)≒X(g)+Y(g)的平衡常数K=0.4已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是A.550℃时,若充入惰性气体,ʋ正,ʋ逆均减小,平衡不移动B.650℃时,反应达平衡后CO2的转化率为25.0%C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总补充1、(四川理综2015.7)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:B补充2、(山东理综2014.29题节选)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)K1H<0∆(I)2NO(g)+Cl2(g)2ClNO(g)K2H<0∆(II)(1)4NO2(g)+2NaCl(s)NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(用K1、K2表示)。212KK212KK(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应(II)达到平衡。测得10min内ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)=mol,NO的转化率а1=。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2а1(填“>”“<”或“=”),平衡常数K2(填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是。(2.5×10-275%>不变升高温度补充3、(2015·天津理综)某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g)≒3Z(g)平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )A.m=2B.两次平衡的平衡常数相同C.X与Y的平衡转化率之比为1∶1D.第二次平衡时,Z的浓度为0.4mol·L-1D补充4、(2014·福建卷)已知t℃时,反应FeO(s)+CO(g)≒Fe(s)+CO2(g)的平衡常数K=0.25。(1)t℃时,反应达到平衡时n(CO)∶n(CO2)=______________。(2)若在1L密闭容器中加入0.02molFeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x=________。4:10.05补充5、在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)≒B(g)+C(g)ΔH=+85.1kJ·mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:时间t/h0124816202530总压强p/100kPa4.915.586.327.318.549.509.529.539.53回答下列问题:(1)欲提高A的平衡转化率,应采取的措施为______________________。升高温度、降低压强升高温度、降低压强(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________,平衡时A的转化率为____________,列式并计算反应的平衡常数K(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总=________mol,n(A)=_________mol。pp0-1×100%94.1%A(g)B(g)+C(g)0.10000.10×(1-94.1%)0.10×94.1%0.10×94.1%K=0.0941mol·L-120.0059mol·L-1=1.5mol·L-10.10×pp00.10×2-pp0pp0-1×100%94.1%A(g)B(g)+C(g)0.10000.10×(1-94.1%)0.10×94.1%0.10×94.1%K=0.0941mol·L-120.0059mol·L-1=1.5mol·L-10.10×pp00.10×2-pp0考点三 化学反应进行的方向××√√√限时练正误判断,正确的划“√”,错误的划“×”(1)凡是放热反应都是自发的,吸热反应都是非自发的。()(2)自发反应的熵一定增大,非自发反应的熵一定减小。()(3)常温下,反应C(s)+CO2(g)≒2CO(g)不能自发进行,则该反应的ΔH>0。()(4)放热过程有自发进行的倾向性,但并不一定能自发进行,吸热过程没有自发进行的倾向性,但在一定条件下也可自发进行。()(5)反应能否自发进行需综合考虑焓变和熵变对反应的影响。()考点2化学反应方向(1)判据降低<>>增加熵增不能能重难点梳理(2)一般规律ΔHΔSΔH-TΔS反应情况-+永远是负值在任何温度下过程均自发进行+-永远是正值在任何温度下过程均非自发进行++低温为正高温为负低温时非自发,高温时自发--低温为负高温为正低温时自发,高温时非自发1.[2017·镇江一中测试]下列关于化学反应自发性的说法中正确的是()A.熵增加的化学反应一定能自发进行B.自发进行的化学反应一定能迅速发生C.在一定条件下,吸热反应可自发进行D.电解池中的化学反应属于自发过程2.[2016·宿迁期末]下列反应过程中,ΔH>0,且ΔS>0的是()A.NH3(g)+HCl(g)===NH4Cl(s)B.CaCO3(s)===CaO(s)+CO2(g)C.4Al(s)+3O2(g)===2Al2O3(s)D.HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l)3.下列说法正确的是()A.凡是放热反应都是自发的,因为吸热反应都是非自发的B.自发反应的熵一定增大,非自发反应的熵一定减小C.常温下,反应C(s)+CO2(g)2CO(g)不能自发进行,则该反应的ΔH>0D.反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>04.下列反应在任何温度下都不能自发进行的是();在任何温度下都能自发进行的是();在高温下能自发进行的是();在低温下能自发进行的是()。A.2HgO(s)===2Hg(l)+O2(g)ΔH=+182kJ/molB.2Ag(s)+Cl2(g)===2AgCl(s)ΔH=-254kJ/molC.2N2(g)+O2(g)===2N2O(g)ΔH=+163kJ/molD.2H2O2(l)===2H2O(l)+O2(g)ΔH=-196kJ/molCDAB例题:实验证明,多数能自发进行的反应都是放热反应。对此说法的理解正确的是( )A.所有的放热反应都是自发进行的B.所有的自发反应都是放热的C.焓变是影响反应是否具有自发性的一种重要因素D.焓变是决定反应是否具有自发性的唯一判据C题型一 焓变、熵变与自发反应1.下列过程的熵变的判断不正确的是( )A.溶解少量食盐于水中,ΔS>0B.纯碳和氧气反应生成CO(g),ΔS>0C.H2O(g)变成液态水,ΔS>0D.CaCO3(s)加热分解为CaO(s)和CO2(g),ΔS>0C 针对练习2.下列说法正确的是( )A.放热反应均是自发反应B.ΔS为正值的反应均是自发反应C.物质的量增加的反应,ΔS为正值D.如果ΔH和ΔS均为正值,当温度升高时,反应可能自发进行D 例题:熵变、焓变可作为反应过程进行方向的判据,下列反应一定有自发倾向的是( )A.ΔH<0 ΔS>0B.ΔH>0 ΔS<0C.ΔH<0 ΔS<0D.ΔH>0 ΔS>0A题组二 复合判据的理解与应用1.(2016·吉林通化期末)已知:(NH4)2CO3(s)==NH4HCO3(s)+NH3(g) ΔH=+74.9kJ·mol-1。下列说法中正确的是( )A.该反应中熵变小于0,焓变大于0B.该反应是吸热反应,因此一定不能自发进行C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行D.判断反应能否自发进行需要根据ΔH与ΔS综合考虑D 针对练习2.汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)==2C(s)+O2(g)已知该反应的ΔH>0,简述该设想能否实现的依据:__________________________________________________。超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO≒2CO2+N2。反应能够自发进行,则反应的ΔH____0(填“>”、“<”或“=”)。该反应是焓增、熵减的反应,任何温度下均不自发进行 <2016(天津卷)节选氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:(2)氢气可用于制备H2O2。已知:H2(g)+A(l)=B(l)ΔH1O2(g)+B(l)=A(l)+H2O2(l)ΔH2其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)=H2O2(l)的ΔH____0(填“>”、“<”或“=”)。<



















