







《鲁科版化学20版必修二1.2.1《元素周期律和元素周期表 原子结构 元素周期律》PPT课件》是由用户上传到老师板报网,本为文库资料,大小为420.61 KB,总共有60页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 60页
- 420.61 KB
- VIP模板
- pptx
- 数字产品不支持退货
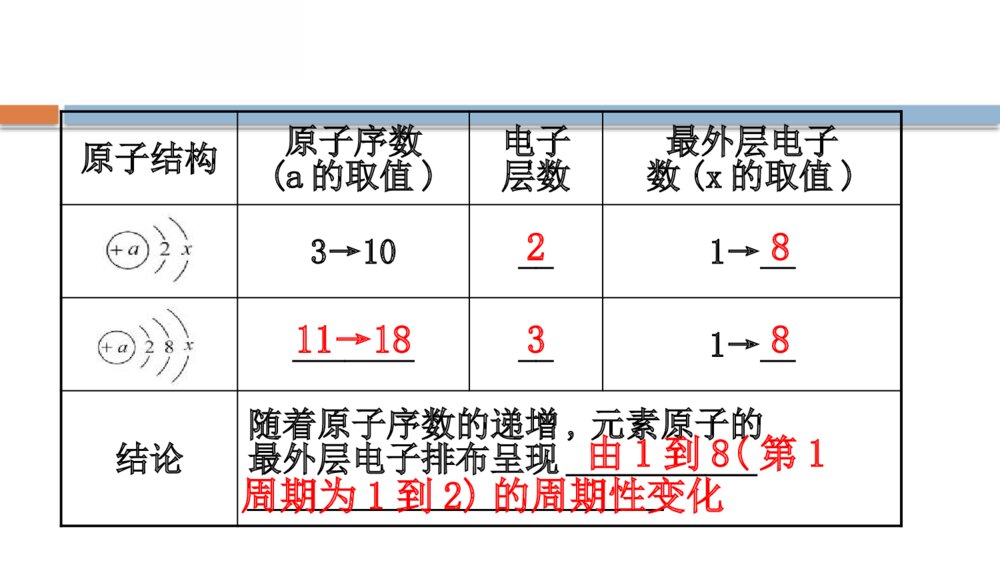
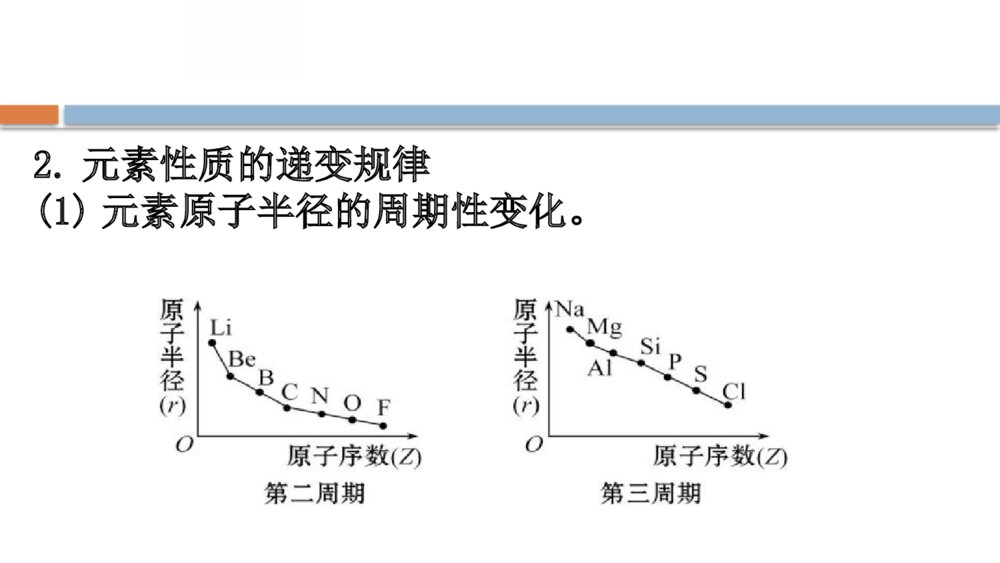
第1章 原子结构 元素周期律第2节 元素周期律和元素周期表第1课时 元素周期律一、原子序数1.概念:元素在元素周期表中的序号。2.原子序数与原子结构的关系:原子序数=_________=_______=___________。核电荷数质子数核外电子数【巧判断】(1)原子和离子都满足“原子序数=核电荷数=核外电子数”的关系。( )提示:×。因离子一定有电子的得失,所以一定不满足这个关系。(2)原子序数为8,核外电子数为8,则质量数一定是16。( )提示:×。原子序数为8,核外电子数为8,但中子数不一定是8,故质量数不一定是16。二、元素周期律1.1~18号元素核外电子排布的变化规律(最外层电子排布)原子结构原子序数(a的取值)电子层数最外层电子数(x的取值)1→2__1→__12原子结构原子序数(a的取值)电子层数最外层电子数(x的取值)3→10__1→___________1→__结论随着原子序数的递增,元素原子的最外层电子排布呈现___________________________________811→1838由1到8(第1周期为1到2)的周期性变化22.元素性质的递变规律(1)元素原子半径的周期性变化。规律:随着原子序数的递增,元素原子的半径呈现__________的周期性变化。由大到小(2)元素主要化合价的周期性变化。以1~18号元素为例探究化合价的变化,图示如下:规律:随着原子序数的递增,元素的最高正化合价呈现_______(O、F除外),最低负化合价呈现_______的周期性变化。+1→+7-4→-1【巧判断】(1)随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现。( )提示:×。在原子的电子层数为1时,最外层电子数是从1增加到2。(2)随着元素原子序数的递增,元素的最高化合价从+1到+7,最低化合价从-7到-1重复出现。( )提示:×。氟元素无正价,氧元素没有最高正化合价,且最低化合价是从-4到-1重复出现。(3)原子序数为15的元素的最高化合价为+3。( )提示:×。原子序数为15的原子结构示意图为,最外层有5个电子,因此其最高化合价为+5价。三、元素周期律1.内容:元素的性质随着_________的递增而呈周期性变化。2.实质:元素性质的周期性变化是_________________周期性变化的必然结果。原子序数原子核外电子排布【微思考】1868年俄国化学家门捷列夫提出了元素周期律的观点,他认为“随着元素相对原子质量的递增,元素的性质呈周期性变化”。请你分析这句话是否正确,并说明原因。提示:错误。元素的性质是随原子序数的递增而呈周期性变化,而不是相对原子质量。限于当时的条件和科学水平,在当时是正确的。知识点一 化合价与最外层电子数之间的关系【重点释疑】1.元素的主要化合价与最外层电子数的关系主族元素最高正化合价=最外层电子数(O、F除外)最低负化合价=最外层电子数-8。|最高正化合价|+|最低负化合价|=8。2.常见元素化合价的特点(1)氢元素:+1、-1、0价,如H2O、NaH、H2。(2)氟元素:-1、0价,如NaF、F2,氟无正价。(3)氧元素:-2、-1、0价,如CaO、Na2O2、O2,氧无最高正价。(4)金属只有正价。(5)非金属元素既有正价又有负价(O、F除外)。 【易错提醒】元素化合价的“三个二”(1)二“特殊”:F无正价,O无最高正价。(2)二“只有”:金属只有正价,只有非金属才有负价。(3)二“等式”:对于主族元素,最高正价=最外层电子数,|最低负价数值|+|最高正价数值|=8(除O、F外)。 【思考·讨论】(1)主族元素的最高正化合价一定等于原子核外最外层电子数吗?提示:不一定,如F为最活泼的非金属元素,只有0价和-1价,无最高正化合价。(2)分析1~18号元素的最高正化合价与最低负化合价的绝对值之差是6、4、2时分别对应什么元素。提示:最高正化合价=原子最外层电子数,最高正化合价+最低负化合价的绝对值=8。最高正化合价与最低负化合价的绝对值之差是6、4、2时分别对应的元素为Cl、S、N和P。【案例示范】【典例】(2019·六安高一检测)下列各组元素中,按最高正价递增的顺序排列的是( ) A.C、N、O、FB.K、Mg、C、SC.H、He、Li、BeD.P、S、Cl、Ar【思维建模】判断元素的化合价思路如下:【解析】选B。根据元素的最高正化合价在数值上一般等于其最外层电子数及特殊元素的化合价来分析各选项。A项,C:+4价,N:+5价,F无正价,O无最高正价;B项,K:+1价,Mg:+2价,C:+4价,S:+6价;C项,H:+1价,He无最高正价,Li:+1价,Be:+2价;D项,P:+5价,S:+6价,Cl:+7价,Ar无最高正价。【母题追问】(1)判断A选项中各元素的最低负化合价。(证据推理与模型认知)提示:根据最低负化合价=最外层电子数-8,可以得出C、N、O、F的最低负化合价分别为-4、-3、-2、-1。(2)D选项中的P、S、Cl三种元素的最高正化合价与最低负化合价的和分别是多少?(证据推理与模型认知)提示:P、S、Cl的最高正化合价分别为+5、+6、+7,最低负化合价分别为-3、-2、-1,三种元素的最高正化合价与最低负化合价的和分别为2、4、6。 【迁移·应用】1.一般能决定元素化合价高低的是( )A.核内电子数B.核外电子数C.核外电子层数D.最外层电子数【解析】选D。元素化合价高低是由最外层电子数决定的。2.某元素X的最高价氧化物对应水化物的化学式是H2XO3,则X的简单气态氢化物的分子式为( )A.HXB.H2XC.XH3D.XH4【解析】选D。X元素的最高价氧化物对应的水化物的化学式为H2XO3,则X的最高正化合价为+4,说明X原子最外层有4个电子,最低负化合价为-4,形成的简单气态氢化物的分子式为XH4。【补偿训练】(2019·聊城高一检测)下列元素的常见化合价从+1至+3依次增大的是( )A.H、He、LiB.Na、Mg、AlC.Al、Be、NaD.N、O、F【解析】选B。A项中He为0价;C项中元素正价化合价分别为+3、+2、+1,与题目要求恰好相反;D项中F无正价。【素养提升】 在现行的元素周期表中,共有118个元素,其中金属元素94个。下面是关于金属元素的一些讨论,据此回答:(1)金属元素有负化合价吗?它们能否形成简单阴离子?提示:金属元素无负化合价,所以不能形成简单阴离子。(2)对于同横行的金属元素,从左到右,其化合价是怎样变化的?提示:同横行的金属元素,从左到右其最外层电子数逐渐增加,所以最高正化合价是逐渐升高的。 【补偿训练】 硒鼓,也称感光鼓,是打印机中很重要的组成部分,决定了打印质量的好坏。硒鼓中用到的感光材料含有元素硒。判断硒元素的最高正化合价和最低负化合价分别是多少?提示:+6价和-2价。根据硒的原子结构示意图可以得出其原子的最外层电子数为6,因此最高正化合价=最外层电子数=+6,最低负化合价=最外层电子数-8=6-8=-2。知识点二 微粒半径大小的比较【重点释疑】1.原子(1)同一横行,从左到右,核电荷数依次增大,原子半径依次减小。如r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。(2)同一纵列,自上而下,电子层数依次增多,原子半径依次增大。如r(Li)r(Cl-)>r(K+)>r(Ca2+)。2S2S3.同一元素的不同粒子:核外电子数越多,半径越大。(1)阳离子:r(原子)>r(阳离子)。如r(Na)>r(Na+)。(2)阴离子:r(原子)r(Fe2+)>r(Fe3+)。 【思考·讨论】(1)对于电子层数相同的原子,为什么其核电荷数越多原子半径越小?提示:原子核带正电荷,核电荷数越多,原子对核外电子的引力越大,原子半径越小。(2)电子层数多的原子的半径一定大于电子层数少的原子半径吗?提示:不一定。只有当微粒的最外层电子数相同时,电子层数越多,半径才越大。【案例示范】【典例】(改编题)化学元素指自然界中一百多种基本的金属和非金属物质,它们只由一种原子组成,其原子中原子核具有同样数量的质子,用一般的化学方法不能使之分解,并且能构成一切物质。到2007年为止,总共有118种元素被发现,其中94种是存在于地球上。下列微粒半径大小的比较中,正确的是( )A.Na+Cl->Na+>Al3+C.NaCl->Na+>Al3+选项分析C项(×)Na、Mg、Al、S的原子半径依次减小D项(×)Na、K、Rb、Cs最外层电子数相同,电子层数依次增多,原子半径依次增大【方法规律】微粒半径大小比较的三步走微粒半径主要是由核电荷数、电子层数和核外电子数决定的。按“三看”规律进行比较:(1)一看电子层数电子层数不同、最外层电子数相同时,电子层数越多,半径越大。例如:r(F)r(Mg)>r(Al)>r(S)>r(Cl),r(S2-)>r(Cl-)>r(K+)>r(Ca2+)。(3)三看电子数核电荷数相同时,电子数越多,半径越大。例如:r(Na+)r(Cl)。 【迁移·应用】1.(2019·承德高一检测)下列各元素原子半径依次增大的是( )A.Na、Mg、AlB.Na、O、FC.P、Si、AlD.C、Si、P【解析】选C。比较元素原子半径的大小有两条规律:①具有相同电子层数的元素,随着原子序数的递增,原子半径递减;②具有相同最外层电子数的元素,随着电子层数的增加,原子半径增大。A项,r(Na)>r(Mg)>r(Al);B项,r(Na)>r(O)>r(F);D项,r(Si)>r(P)>r(C)。2.(2019·三明高一检测)下列粒子半径之比大于1的是( )rCar(K)A.B.rKrMgrSrClC.D.rPrCl+rCar(K)A.B.rKrMgrSrClC.D.rPrCl+【解析】选B。A项,r(K+)r(Mg),>1;C项,r(S)O>F,B错误;离子电子层结构相同,核电荷数越大离子半径越小,则离子半径大小为Ca2+Ca2+>Mg2+,D错误。【课堂回眸】



















