







《高中化学必修一《电解质及其电离》PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为854.5 KB,总共有39页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 39页
- 854.5 KB
- VIP模板
- ppt
- 数字产品不支持退货
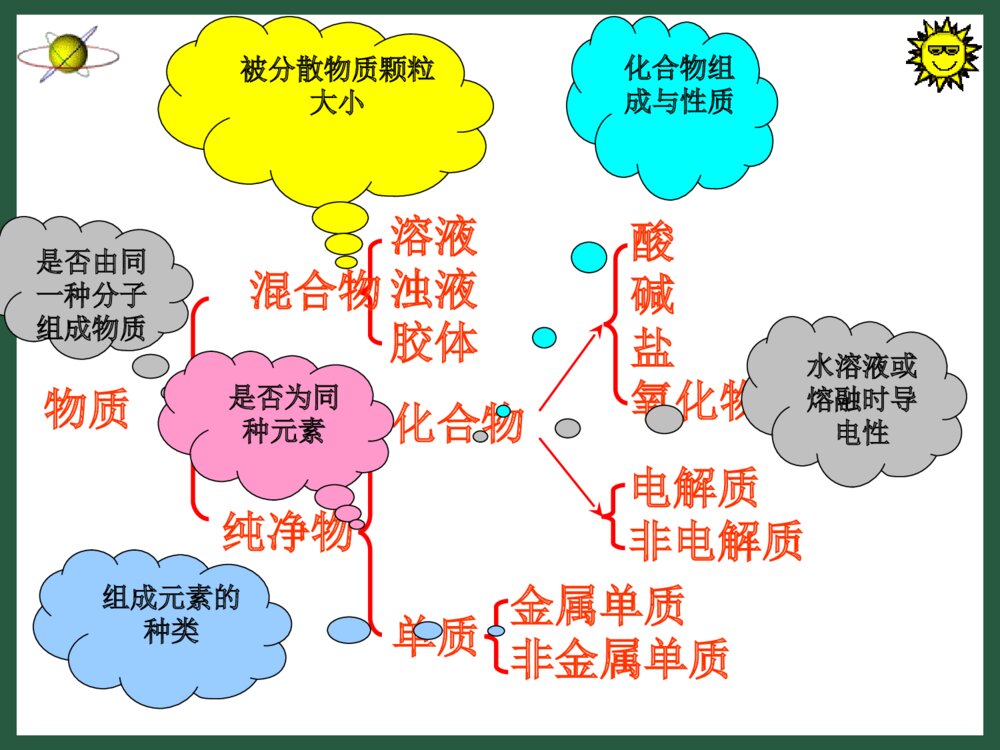
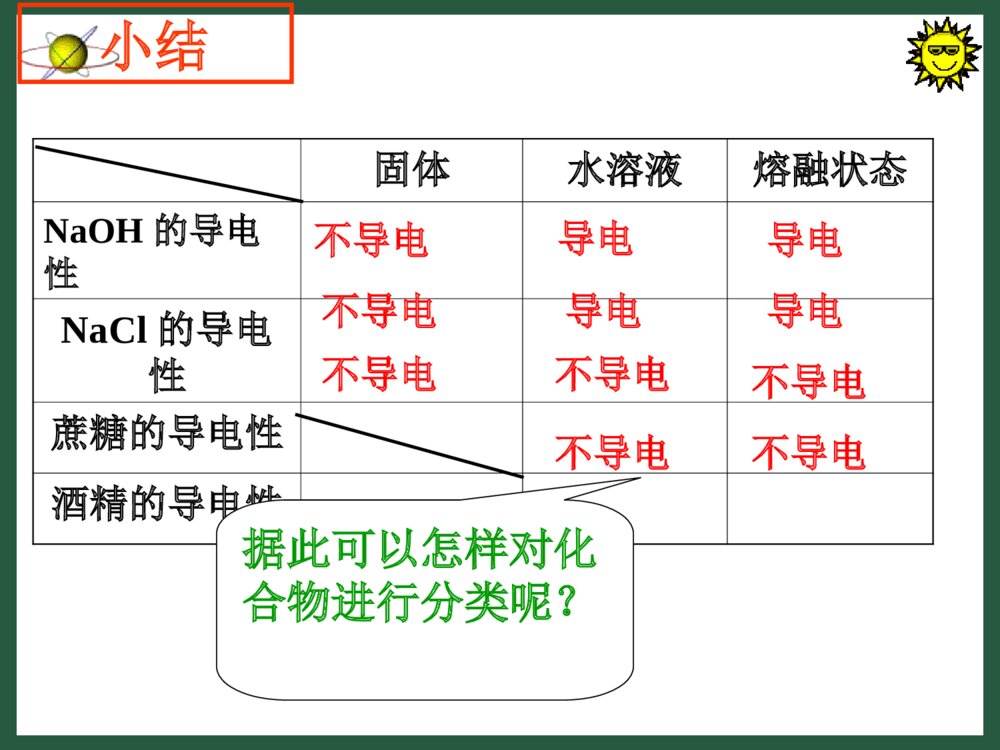
第二节电解质一、电解质及其电离溶液浊液胶体混合物纯净物化合物单质金属单质非金属单质酸碱盐氧化物电解质非电解质是否由同一种分子组成物质被分散物质颗粒大小是否为同种元素化合物组成与性质水溶液或熔融时导电性组成元素的种类物质下列物质哪些可以导电?食盐水溶液、砂糖水溶液、盐酸、NaOH溶液、乙醇、食用醋、菜籽油可以导电的有:食盐水溶液、盐酸、NaOH溶液、食用醋不能导电的有:砂糖水溶液、乙醇、菜籽油实验还证明:⑴NaCl、NaOH、蔗糖固体均不导电,将NaCl、NaOH加热至融化(熔融状态)它们可以导电;⑵将蔗糖加热至融化(熔融状态)蔗糖不导电。知识在线思考讨论3为何NaCl固体不导电?是NaCl固体内部没有带电荷的微粒吗?固体NaCl没有自由移动的离子。NaCl固体中有阴、阳离子,但没有自由移动的离子。NaCl溶液、熔融的NaCl为什么能够导电?NaCl晶体溶解于水后,Na+和Cl-就会逐渐脱离晶体表面而进入溶液,成为自由移动的阴、阳离子。固体NaCl受热融化时,氯化钠晶体中原来排列紧密的Na+ 、Cl-也能成为自由移动的离子。•电解质电离出→自由移动的离子→发生离子定向移动→才导电①纯固体、纯液体是不导电的②电解质在水溶液或有的在熔化状态下才导电离子电荷浓度离子电荷浓度有无自由移动的离子有无自由移动的离子外电场下固体水溶液熔融状态NaOH的导电性NaCl的导电性蔗糖的导电性酒精的导电性不导电导电导电不导电导电导电不导电不导电不导电不导电不导电小结据此可以怎样对化合物进行分类呢?电解质:在水溶液里或熔融状态下能够导电的化合物非电解质:在水溶液里和熔融状态下都不能导电的化合物一电解质与非电解质如:酸、碱、盐都是电解质。如:蔗糖、酒精等都是非电解质。思考:两个概念以后什么共同点?都是化合物①①硝酸钾溶液能导电,所以硝酸钾溶液是电硝酸钾溶液能导电,所以硝酸钾溶液是电解质。解质。②②铜、石墨均能导电,所以它们是电解质。铜、石墨均能导电,所以它们是电解质。③③在熔融状态和水溶液中都能导电的化合物在熔融状态和水溶液中都能导电的化合物才是电解质。才是电解质。④蔗糖、酒精在水溶液或融化状态下均不导电,所以它们是非电解质。⑤能够导电的物质一定是电解质。××××√【思考讨论1】•为了保证人体生理活动的正常进行,需要维持体内的电解质平衡,存在于细胞液和体液中的Na+、K+、Cl-等对这种平衡发挥着重要作用。剧烈运动或天气炎热会引起大量出汗,出现电解质浓度失衡、紊乱,使神经和肌肉的应激受到影响,就会产生恶心、呕吐和肌肉痉挛等症状,因此,在高温环境中工作或从事剧烈运动的人们,要及时补充水分和盐分,以维持体内的水、电解质平衡2、电解质的电离物质溶于水或受热熔化时,离解成自由移动的离子的过程称为电离。(1)电离:思考:电离的条件是什么?电离需不需要通电?电离的结果是什么?水溶液或熔融状态电离不需要通电产生能自由移动的离子Na2SO4例:电离方程式的书写NaClNaOHKNO3注意电离过程,原子团不能拆遵守原子个数守恒、电荷守恒=Na++Cl-=Na++OH-=K++NO3-=2Na++SO42-(2)电离的表示方法电离方程式1、下列电离方程式离错误的是()A.Al2(SO4)3=2Al+3+3SO4-2B.FeCl3=Fe3++Cl3-C.HCl=H++Cl-D.Na2CO3=Na++CO32-ABD课堂练习1书写下列物质的电离方程式HNO3HClH2SO4KOHBa(OH)2NaOH课堂练习2【应用】:你可以给酸、碱、盐下个定义吗?HNO3=H++NO3-HCl=H++Cl-H2SO4=2H++SO42-电离时生成的阳离子全部是氢离子的化合物叫做酸酸的定义KOH=K++OH-Ba(OH)2=Ba2++2OH-NaOH=Na++OH-电离时生成的阴离子全部是氢氧根离子的化合物叫做碱碱的定义Na2CO3(NH4)2SO4BaCl2盐的定义电离时生成金属阳离子(或铵离子)和酸根阴离子的化合物叫做盐。=2Na++CO32-=2NH4++SO42-=Ba2++2Cl-CuSO4=Cu2++SO42-不一定NaHSO4=Na++H++SO42-【思考】电离出氢离子的电解质一定是酸吗?*3.强电解质和弱电解质强电解质:在水溶液中完全电离的电解质。包括强酸、强碱和大部分的盐。常见的强酸有硫酸、硝酸、盐酸,强碱有氢氧化钠、氢氧化钾、氢氧化钡。弱电解质:在水溶液中部分电离的电解质。包括弱酸、弱碱和水。醋酸电离的方程式:CH3COOHCH3COO-+H+。氨水电离的方程式:NH3•H2ONH4++OH-。化合物非电解质电解质电离不电离一定条件是否电离强电解质全部电离部分电离在水溶液中弱电解质•1:下列物质属于非电解质的是•A.HClOB.Cl2•C.NH4HCO3D.蔗糖•2.下列物质属于电解质的是•A.NaCl固体B.NaCl溶液•C.酒精D.K3、下列物质中:①Cu②KCl固体③K2SO4溶液④CO2⑤蔗糖⑥氯水•属于电解质的是,•属于非电解质的是,•既不属于电解质也不属于非电解质。②②④⑤④⑤①③⑥①③⑥44:下列物质离能导电的电解质是::下列物质离能导电的电解质是:AA、、MgClMgCl22晶体晶体BB、、SOSO22CC、液态、液态HClDHClD、熔融的、熔融的KOHKOH3.下列状态时,能导电的电解质是()A.液态氯化氢B.熔融食盐C.胆矾晶体D.食用醋B4.下列电离方程式错误的是()。A.NaHCO3==Na++H++CO32-B.NaHSO4(溶液)==Na++H++SO42-C.MgCl2==Mg2++2Cl—D.Ba(OH)2==Ba2++2OH-A5.下列物质能导电的有_______,属于电解质的有_______,属于非电解质的有_______。①熔融的氯化钠②KNO3溶液③碳酸钙固体④石墨⑤乙醇溶液⑥蔗糖①②④①③⑥*7、电解质溶于水后电离出的阴、阳离子是能够导电的,而且溶液的导电能力与溶液中离子所带的电荷的浓度有关,下列溶液的导电能力最强的是()。A.0.2mol/LNaCl溶液B.0.15mol/LMgCl2溶液C.0.2mol/LBaCl2溶液D.0.25mol/LHCl溶液*8、下列物质,既能导电又属于电解质的是()A.MgCl2晶体B.NaCl溶液C.液态HClD.熔融的KOHCD二、填空题1、下列物质属于电解质的是;属于非电解质的是;能导电的物质是;其水溶液能够导电的物质。①氨水②蔗糖③烧碱④NH3·H2O⑤CO2⑥碳酸钙⑦CH3COOH⑧铜⑨NaCl溶液⑩石墨2、请判断正误,并分析原因①HCl的水溶液导电,但液态的HCl不导电。②导电性强的溶液,自由移动的粒子数目一定多③电解质在固态时不导电,在固态时导电的物质一定不是电解质×√√③④⑥⑦②⑤①⑧⑨⑩①③④⑤⑦⑨练习四:书写电离方程式1.K2SO42.NH4Cl3.CuCl2=2K++SO42-=NH4++Cl-=Cu2++2Cl-离子方程式问题探究三问题讨论1电解质溶液间的反应实质是离子间的反应。离子方程式------用实际参加反应的离子符号来表达的化学反应方程式。什么是离子方程式?问题讨论3酸、碱、盐在离子方程式中哪些该拆、哪些不该拆?⑴易溶于水的强电解质都要拆开成离子形式;⑵单质、氧化物、气体都写成化学式;⑴写出化学方程式⑵改写化学方程式⑶写出离子方程式基本步骤AgNO3+KCl=AgCl↓+KNO3Ag++NO3-+K++Cl-=AgCl↓+K++NO3-Ag++Cl-=AgCl↓离子方程式的含义问题解决1Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3BaCl2+K2SO4=BaSO4↓+2NaClBa2++SO42-=BaSO4↓表示一类反应可溶性钡盐可溶性硫酸盐只生成硫酸钡沉淀知识迁移将离子方程式改为符合反应事实的化学方程式请将下列离子方程式分别改写成不同的两个化学方程式:Ag++Cl-=AgCl↓H++OH-=H2O问题解决2离子反应的应用1、检验离子的存在【例】待测液中Cl-的检验实验:2、判断离子能否共存离子间不发生化学反应(不生成沉淀、气体、难电离的物质)就可以大量共存【例】判断下列各组离子能否大量共存①Ca2+Na+CO32-NO3-②Ba2+Na+SO42-NO3-③H+K+Cl-OH-④H+K+CO32-SO42-⑤Na+K+CO32-OH-(×)(×)(×)(×)(√)课堂练习1、写出下列反应的离子方程式:①Ba(NO3)2溶液中加Na2SO4溶液:②铁屑加入CuSO4溶液中2、将下列离子方程式改写成两个不同的化学反应方程式:①Cu2++2OH-=Cu(OH)2↓②CO32-+2H+=CO2↑+H2O谢谢大家!



















