








《第一课时·化学反应的快慢PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为1.82 MB,总共有24页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 24页
- 1.82 MB
- VIP模板
- ppt
- 数字产品不支持退货
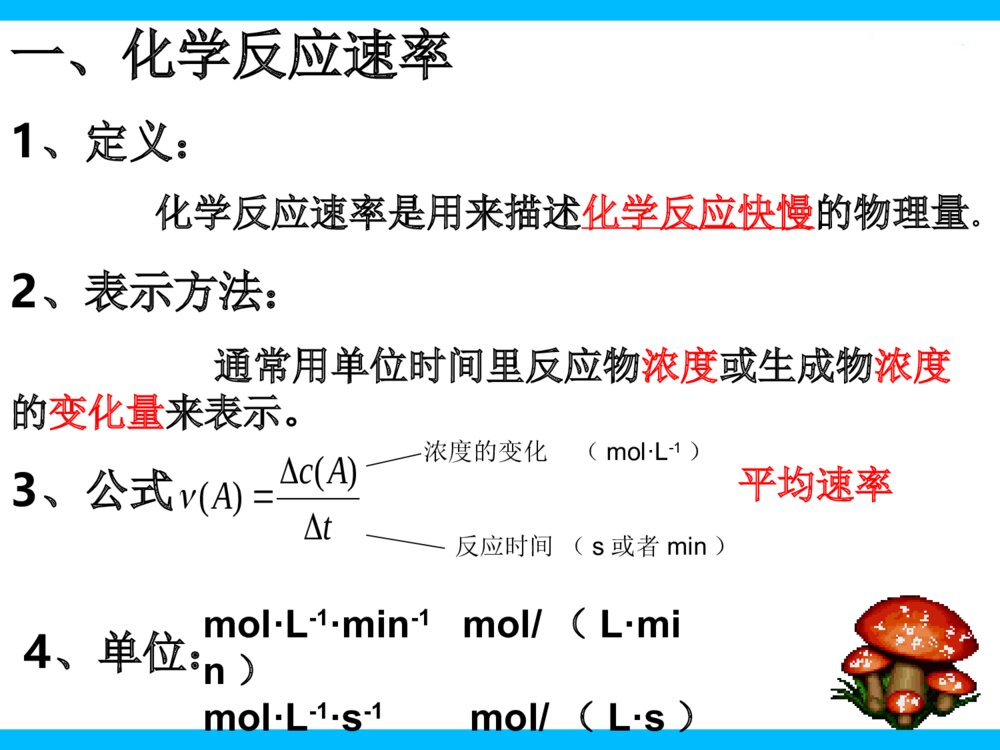
铝热反应焰火司母戊鼎溶洞化学反应有快慢之分化学反应的快慢第一课时一、化学反应速率1、定义:化学反应速率是用来描述化学反应快慢的物理量。2、表示方法:通常用单位时间里反应物浓度或生成物浓度的变化量来表示。3、公式:4、单位:mol·L-1·min-1mol/(L·min)mol·L-1·s-1mol/(L·s)浓度的变化反应时间平均速率(mol·L-1)(s或者min)tAcA)()(解:起始量(mol):210变化量(mol):10.515s末量(mol):2-11-0.51则△C(SO2)=1/2mol/L=0.5mol/L△C(O2)=0.5/2=0.25mol/L△C(SO3)=1/2mol/L=0.5mol/LV(SO2)=C(SO△2)/t=0.5mol/L/5s=△0.1mol/(L·s)2SO2+O22SO3△催化剂υ(SO2):υ(O2):υ(SO3)=2:1:2例题:在2L的密闭容器中,加入2molSO2和1molO2,发生,在5s末时,测得容器中含有1mol的SO3,求v(SO2)、v(O2)、v(SO3)2SO2+O22SO3△催化剂同理可得V(O2)=0.05mol/(L·s)V(SO3)=0.1mol/(L·s)想一想1、同一个化学反应,用不同的物质来表示其化学反应速率,数值是否相同?结论:反应速率的数值可能相同,也可能不同。2、反应速率数值之比与化学方程式前的系数之间有何关系?结论:反应速率之比等于反应方程式前的系数之比。注意问题:1、对于同一反应来说,用不同物质表示化学反应速率时数值可能相同,也可能不同,因此必须注明是哪一种物质表示的反应速率2、各物质的反应速率数值之比等于反应方程式中各物质的系数之比3、化学反应速率表示的是一段时间内的平均速率化学反应有快慢之分,日常生活中有时需要化学反应迅速发生,有时需要减缓反应速率,那么,是什么因素影响了化学反应速率?又该如何控制反应进行的快慢呢?想一想认识化学反应的快慢试剂:表面积大致相同的镁条、铁片、锌粒,过氧化氢溶液(3%),盐酸(0.5mol.L-1,3mol.L-1),碳酸钙粉末,块状碳酸钙,二氧化锰粉末、三氯化铁溶液。仪器:试管、药匙、镊子、胶头滴管、酒精灯,试管夹、烧杯、量筒一个实验结果受多种因素的影响,为了使实验结论更具有说服力,可以采取实验的方法,从不同的角度改变实验条件,探究各种因素对化学反应的影响。通过什么现象了解化学反应的快慢?1、对于有气体参加的反应,可以通过观察气泡鉴定逸出的快慢来判断反应的快慢2、对于有颜色变化的反应,可以通过观察颜色变化来判断对照实验一、表面积大致相同的铜片、锌片、镁条分别与同浓度的盐酸反应实验二、块状碳酸钙与粉末状碳酸钙与等浓度盐酸反应实验三、表面积大致相同的锌粒分别与0.5mol/L、3.0mol/L盐酸反应实验四、等体积的过氧化氢溶液分别放入两支试管中,每一支试管中加入少量的三氯化铁溶液,一支试管放在冷水中,另一支试管放在热水中实验五、取等体积的过氧化氢溶液于试管中,其中一支试管加入少量二氧化锰反应物本身性质接触面积反应物浓度温度催化剂温度对化学反应速率的影响思考:温度对化学反应速率产生了什么样的影响?升高温度,可以加快反应速率降低温度,可以减慢反应速率实验四、等体积的过氧化氢溶液分别放入两支试管中,每一支试管中加入少量的三氯化铁溶液,一支试管放在冷水中,另一支试管放在热水中实验内容实验现象结论铜片与盐酸,镁条与盐酸反应且产生气泡的速率比锌片碳酸钙与盐酸反应产生气体的速率快锌粒与的盐酸反应产生的气泡的速率较快物质之间能否反应以及反应的快慢是由决定参加反应的固体物质颗粒越,与其他反应物的接触面积越,反应速率越快反应物浓度越,化学反应速率越快参加反应的物质本身的性质表面积大致相同的铜片、锌片、镁条分别与同浓度的盐酸反应块状碳酸钙与粉末状碳酸钙与等浓度盐酸反应表面积大致相同的锌粒分别与0.5mol/L、3.0mol/L盐酸反应取等体积的过氧化氢溶液于试管中,其中一支试管加入少量二氧化锰的试管产生气泡的速率快使用可以加快反应速率不反应快粉末状小大3mol/L大加入二氧化锰催化剂结论:影响化学反应速率的因素:(1)内因:主要由参加反应的物质本身的性质决定的(2)外因:浓度:增大反应物的浓度,可以加快化学反应速率;减少反应物的浓度,可以减慢化学反应速率。温度:升高温度,可以加快反应速率,(温度越高,反应速率越快)降低温度,可以减慢反应速率,(温度越低,反应速率越慢)催化剂:多数情况下使用催化剂可以加快化学反应速率。反应物间的接触面积:反应物间接触面积越大,反应速率越快其他:压强(对于有气体参加的反应)、光波、电磁波、超声波、溶剂等联系实际思考:生产生活中我们如何调控化学反应的快慢?食物腐败金属腐蚀1、决定化学反应速率的主要因素是()A、温度B、反应物浓度C、催化剂D、反应物本身的性质2、把下列四种Na2CO3溶液,分别加进四个盛有10mL浓度为2mol·L-1的盐酸的烧杯中,立即搅拌(假定搅拌前反应没有发生)反应发生,此时反应最快的是()。(A)20mL、2、5mol·L-1(B)20mL、2mol·L-1(C)10mL、5mol·L-1(D)30mL、2mol·L-1DCBC3、在一定温度下,100ml6mol/L硫酸与过量的锌粒反应,为了减慢反应速率但又不影响生成氢气的总量,可向反应物中加适量的()A、碳酸钠固体B、蒸馏水C、硫酸钾溶液D、烧碱溶液4、解释“在28℃时,鲜牛奶4小时后变质,但在冰箱中,鲜牛奶48小时候后变质”的原因。答:温度降低,使牛奶变质的速率减慢5、在密闭容器中进行反应,A与B反应生成C,其反应速率分别用υ(A)、υ(B)、υ(C)(mol·L-1·s-1)表示,υ(A)、υ(B)、υ(C)之间有如下所示的关系:υ(B)=3υ(A);3υ(C)=2υ(B)。则此反应可表示为()(A)2A+3B=2C(B)A+3B=2C(C)3A+B=2C(D)A+B=CB课堂小结:一、化学反应速率定义、公式、单位、应用二、影响化学反应的因素影响因素内因外因浓度温度反应物间的接触面积催化剂(主要因素)(次要因素)物质本身性质1、课本:练习与活动(1---4)2、自学提要:夯实双基(第一课时)



















