

《晶体化学基本原理PPT化学课件下载》是由用户上传到老师板报网,本为文库资料,大小为7.52 MB,总共有83页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 83页
- 7.52 MB
- VIP模板
- ppt
- 数字产品不支持退货
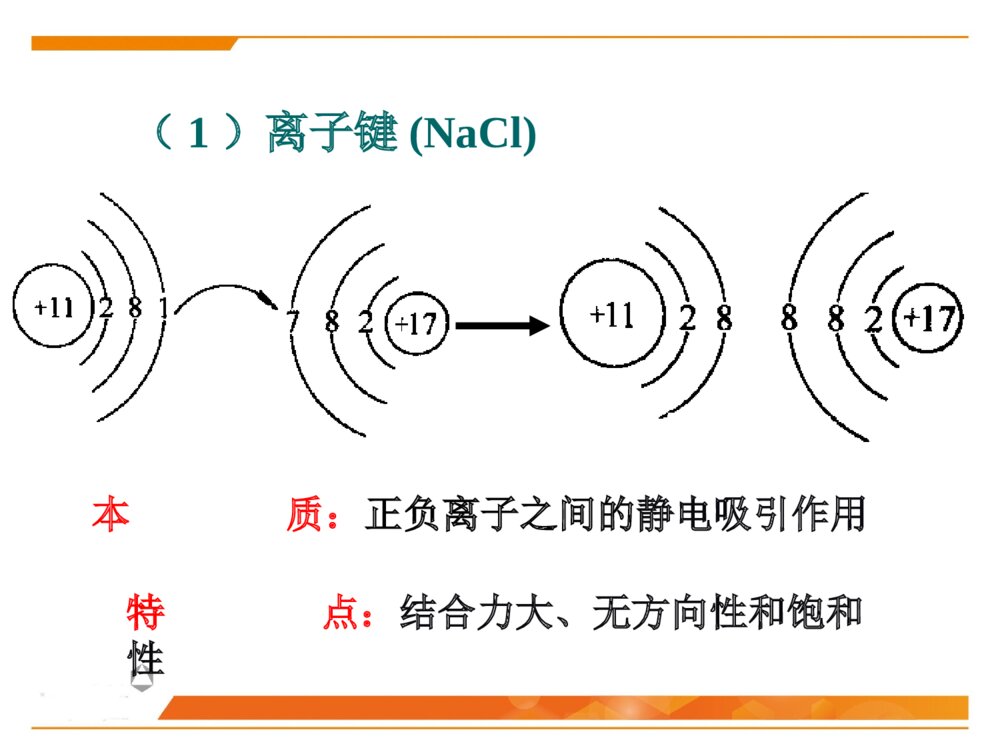
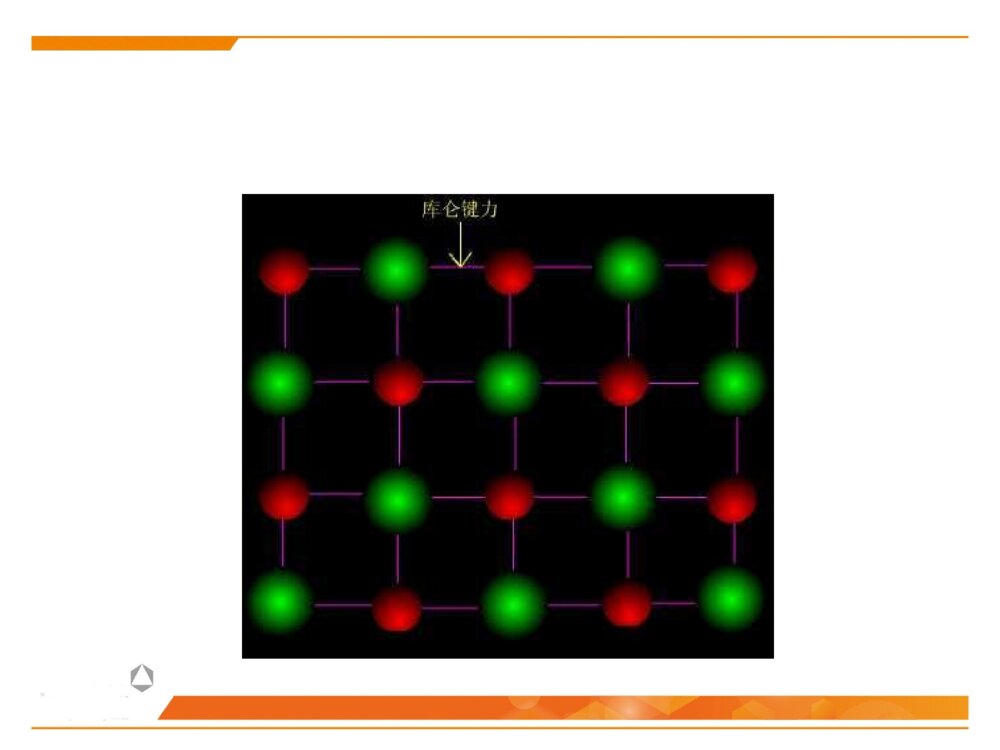
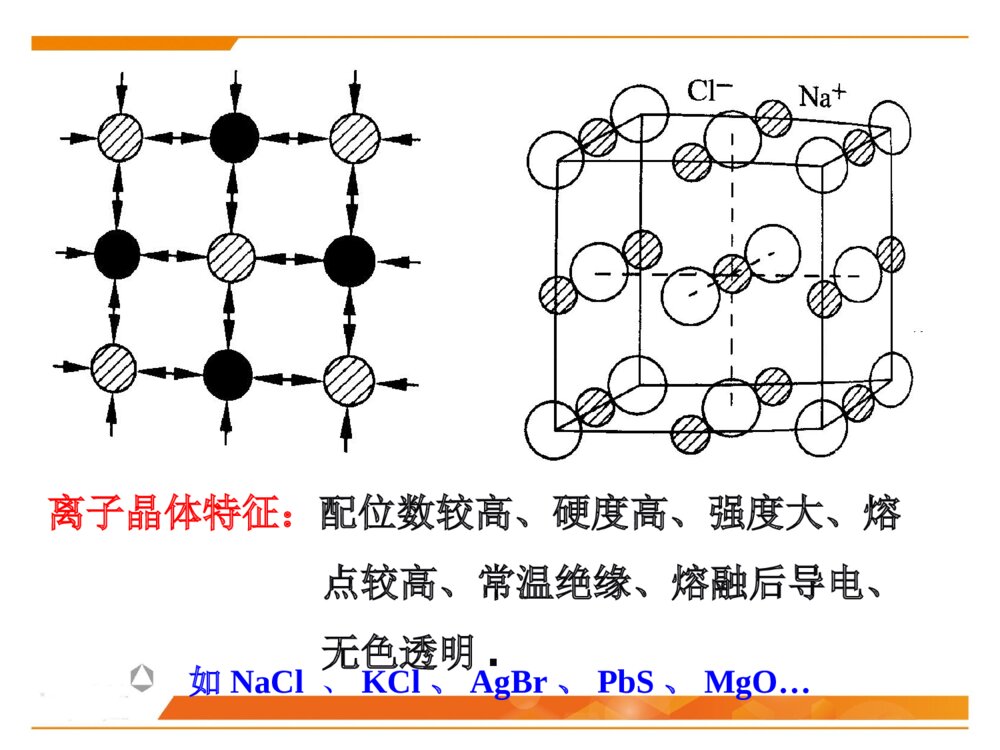
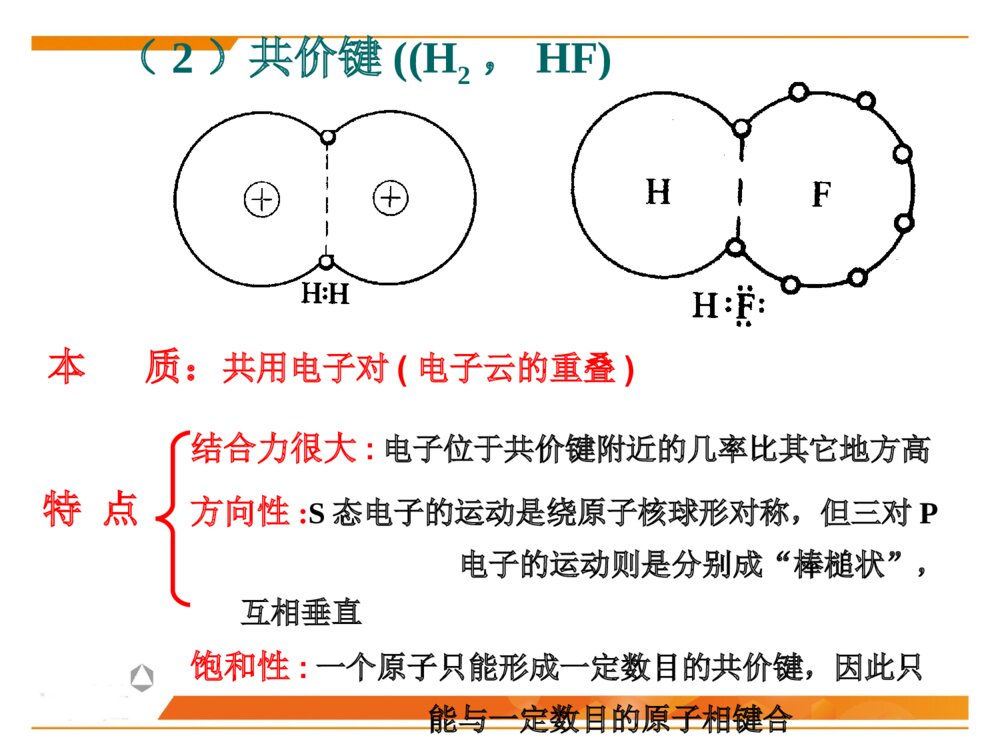
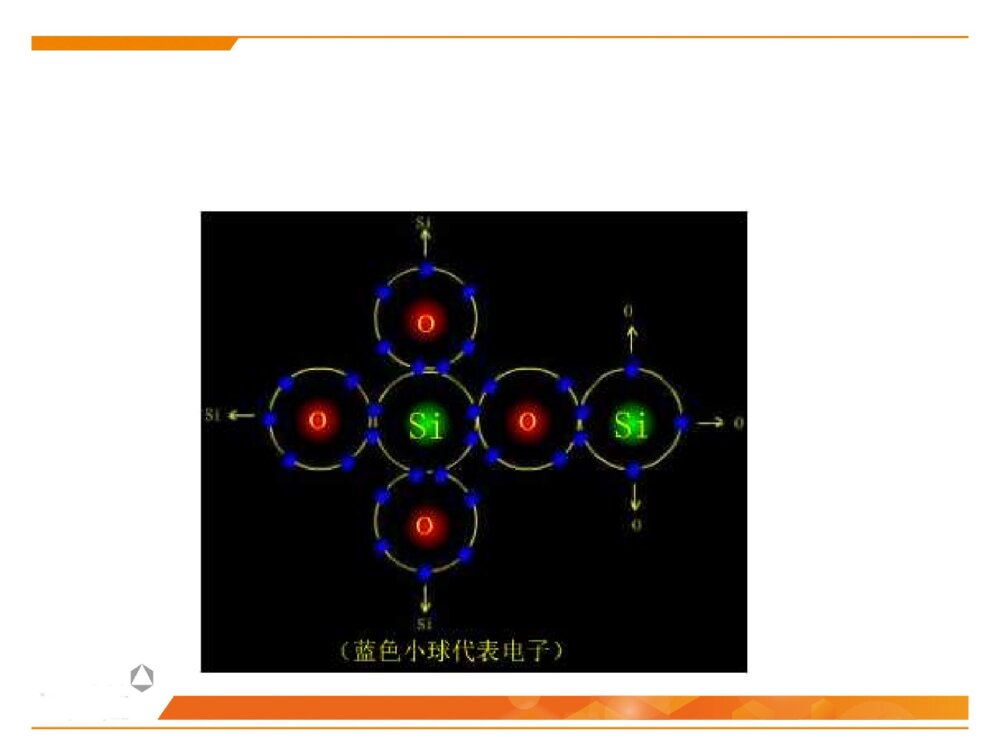
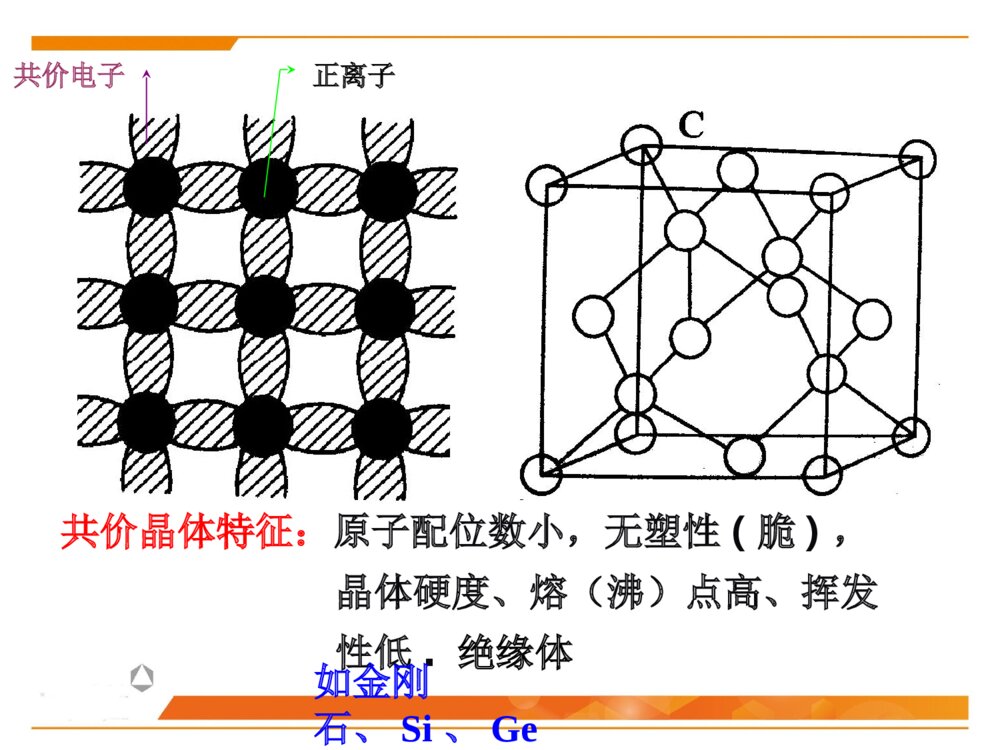
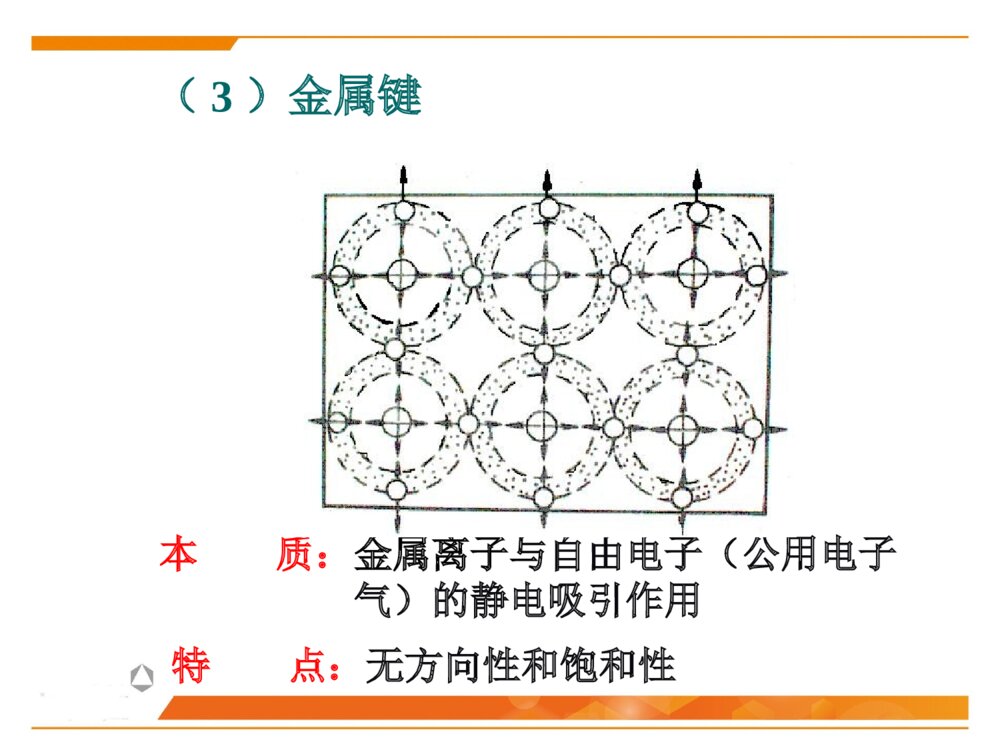
第二节晶体化学基本原理晶体中的结合键晶体中质点的堆积化学组成与晶体结构的关系同质多晶与类质同晶鲍林规则一、晶体中的结合键结合键:原子之间的结合力,主要表现为原子间吸引力和排斥力的合力结果。(基本结合或一次键)离子键共价键金属键化学键(派生结合或二次键)范德华键氢键离子极化……物理键1、晶体中键的类型(1)离子键(NaCl)本质:正负离子之间的静电吸引作用特点:结合力大、无方向性和饱和性离子晶体特征:配位数较高、硬度高、强度大、熔点较高、常温绝缘、熔融后导电、无色透明.如NaCl、KCl、AgBr、PbS、MgO…(2)共价键((H2,HF)本质:共用电子对(电子云的重叠)特点结合力很大:电子位于共价键附近的几率比其它地方高方向性:S态电子的运动是绕原子核球形对称,但三对P电子的运动则是分别成“棒槌状”,互相垂直饱和性:一个原子只能形成一定数目的共价键,因此只能与一定数目的原子相键合共价晶体特征:原子配位数小,无塑性(脆),晶体硬度、熔(沸)点高、挥发性低.绝缘体共价电子正离子如金刚石、Si、Ge(3)金属键本质:金属离子与自由电子(公用电子气)的静电吸引作用特点:无方向性和饱和性金属晶体特征:配位数较高、密度大、电阻随温度升高而增大、强韧性好、导电和导热性良好、特有金属光泽电子云金属原子(4)分子间力(范德华键——I2)本质:原子(分子、原子团)之间的偶极矩作用——分子间力特点:结合力小,无方向性和饱和性极化原子之间吸引力正负电荷中心不重合分子晶体特征:熔点低,硬度小、绝缘性良好静电力:极性分子间永久偶极距诱导力:极性分子与非极性分子间诱导偶极距色散力:非极性分子间瞬时偶极距分子间作用力按原因和特性分为三种:(5)氢键(H2O)本质:分子间力特点:方向性、饱和性形成条件:分子中有氢和电负性很强的其它非金属元素。这样才能形成极性分子和一个裸露的质子晶体中五种键型的比较键型离子键共价键金属键范德华键氢键作用力静电库仑力共用电子对静电库仑力分子间力特点无方向性无饱和性方向性饱和性无方向性无饱和性无方向性无饱和性饱和性方向性晶体性质离子晶体(NaCl)共价晶体(Cl2、Si-O)金属晶体(Cu、Fe)分子晶体(干冰CO2)氢键晶体(冰H2O)熔点高、硬度大、导电性能差、膨胀系数小熔点高、硬度大、导电性能差良好的导电性、导热性、延展性、塑性★混合键在材料中单一结合键的情况并不是很多,大部分材料的原子结合键往往是不同键的混合。过渡金属:半金属共价键极性共价键陶瓷化合物:气体分子、聚合物、石墨:共价键+范德华键金刚石:典型的共价键石墨:层状晶体 ,层面内三个共价键,与层面垂直方向还应有一个电子,具有金属键性质 ,层面之间靠很弱的范德华键结合。层片之间非常容易运动 ,沿层片方向是一种良导体。石墨:混合键金刚石与石墨晶体结构2、晶体中键的表征键型四面体3、晶体中离子键、共价键比例的估算电负性——可定性的判断结合键的类型电负性:是指各元素的原子在形成价键时吸引电子的能力,用以表征原子形成负离子倾向的大小。鲍林用电负性差值△X=XA-XB来计算化合物中离子键的成份。差值越大,离子键成分越高。电负性差值越大,离子键分数越高。离子键分数与电负性差值(XA-XB)的关系当两个成键原子的电负性相差很大时,如周期表中I-VII族元素组成的化合物,主要是离子键;电负性相差小的元素的原子之间成键,主要是共价键,也有一定的离子键成份,价电子不仅为两原子共享,而且应偏向于电负性大的原子一边;同种原子之间成键,由于电负性相同,可以是共价键,也可能是金属键。判断NaCl、SiC、SiO2的键性例:一般情况下,可用经验公式估算A、B两种元素组成的陶瓷中离子键性比例:PAB=1-exp[-(xA-XB)2/4]xA-XB为AB两元素的电负性,PAB为陶瓷的离子键比例键能(原子的结合能):原子在平衡距离下的作用能。其大小相当于把两个原子完全分开所需作的功,结合能越大,原子结合越稳定。不论何种类型的结合键,固体原子间总存在两种力:一是吸引力,来源于异类电荷间的静电吸引;二是同种电荷之间的排斥力。4、结合键的本质结合键的类型及键能的大小对材料的物理性能和力学性能有重要影响。物理性能:熔点、密度……力学性能:弹性模量、强度、塑性……5、结合键与性能结合键种类键能(kJ/mol)熔点硬度导电性键的方向性离子键586-1047高高固态不导电无共价键63-712高高不导电有金属键113-350有高有低有高有低良好无分子键<42低低不导电有1、最紧密堆积原理晶体中各原子或离子间的相互结合,可以看作是球体的堆积。球体堆积的密度越大,系统的势能越低,晶体越稳定。此即球体最紧密堆积原理。适用范围:典型的离子晶体和金属晶体。二、晶体中质点的堆积等径球体的紧密堆积:晶体由一种元素组成,单质(原子),如:Cu、Ag、Au不等径球体的紧密堆积:由两种以上元素组成,离子,如NaCl、MgO质点的堆积方式:根据质点的大小不同,球体最紧密堆积方式分为等径球和不等径球两种情况。2、等径球体的堆积(1)堆积方式等径球体在平面上的紧密排列第二层球体落于B或C孔隙上第三层位于第一层正上方第三层位于一二层间隙六方最紧密堆积面心立方最紧密堆积第三层球体叠加时,有两种完全不同的堆叠方式:1)六方紧密堆积按ABABAB……的顺序堆积,球体在空间的分布与空间格子中的六方格子相对应。例:金属锇Os、铱Ir……密排六方结构:(0001)面2)面心立方紧密堆积按ABCABC……的顺序堆积,球体在空间的分布与空间格子中的立方格子相对应。例:Cu、Au、Pt面心立方紧密堆积:(2)密堆积结构中的间隙1)空隙形式四面体空隙:八面体空隙:正四面体,由4个球构成,空隙A或B正八面体,由6个球构成,空隙C2)空隙分布每个球周围有8个四面体空隙;每个球周围有6个八面体空隙3)空隙数量n个等径球最紧密堆积时,整个系统四面体空隙数为2n个,八面体空隙数为n个。66n48n4)空隙大小四面体间隙大小:r=0.225R八面体间隙大小:r=0.414R5)空间利用率(堆积系数、堆积密度、致密度)一般采用空间利用率(堆积系数)来表征密堆系统总空隙的大小。其定义为:晶胞中原子体积与晶胞体积的比值。例:求面心立方紧密堆积时的致密度。303034arZVV堆积系数(3)体心立方堆积体心立方堆积比较简单、对称性高,是金属中常见的三种原子堆积方式之一。近似密排面为:(110)面致密度:68.02%;四、八面体空隙不等边;空隙大小:分别为0.155R和0.291R;n个球作体心立方堆积时,存在3n个八面体空隙、6n个四面体空隙,空隙较多。3、不等径球体的堆积大球按最紧密或近似最紧密堆积;小球填充在八面体或四面体空隙中。离子晶体中:半径较大的阴离子作最紧密或近似最紧密堆积;半径小的阳离子填充在八面体或四面体空隙中。原子半径:孤立态原子半径:从原子核中心到核外电子的几率密度趋向于零处的距离,亦称为范德华半径。结合态原子半径:当原子处于结合状态时,根据x-射线衍射可以测出相邻原子面间的距离。对于金属晶体,则定义金属原子半径为:相邻两原子面间距离的一半。(一)质点的相对大小(原子半径与离子半径)三、化学组成与晶体结构的关系每个离子周围存在的球形力场的半径即是离子半径。对于离子晶体,定义:正、负离子半径之和等于相邻两原子面间的距离,可根据x-射线衍射测出。离子半径:指离子或原子在晶体结构中处于相接触时的半径,此时原子或离子间的静电吸引和排斥作用达到平衡。原子和离子的有效半径:在晶体结构中,一个原子或离子周围与其直接相邻的原子或异号离子数数目称为原子(或离子)的配位数,用CN来表示。单质晶体:均为12;离子晶体:小于12,一般为4或6;共价晶体:配位数较低,小于4。(二)配位数与配位多面体1、配位数配位多面体:晶体结构中,与某一个阳离子结成配位关系的各个阴离子的中心连线所构成的多面体。2、配位多面体三角形配位四面体配位八面体配位立方体配位r+r-3、离子的配位数与的关系临界离子半径比(r+/r-):在紧密堆积的阴离子恰好相互接触,并与中心阳离子也恰好接触的条件下,阳离子半径与阴离子半径之比,即每种配位体的阳、阴离子半径比的下限。阳离子配位数的大小主要与正、负离子的临界半径比(r+/r-)有关例:以NaCl晶体为例,求八面体配位时的r+/r-阳离子的配位数与阴阳离子半径比的关系:干冰CO2B2O3离子极化是指离子在外电场作用下,改变其形状和大小的现象。(三)离子极化1、极化过程一个离子受到其他离子所产生的外电场的作用下发生极化,用极化率α表示一个离子以其本身的电场作用于周围离子,使其他离子极化,用极化力β表示被极化:自身被极化主极化:极化周围其它离子2、一般规律正离子β大α小负离子β小α大▲18电子构型的正离子Cu2+、Cd2+的α值大3、离子极化对晶体结构的影响键性变化极化电子云重叠(偶极)结构类型发生变化离子间距减小离子键→共价键配位数CN↓负离子在正离子电场中被极化使配位数降低AgClAgBrAgIAg+和X-半径之和(nm)Ag+-X-实测距离(nm)极化靠近值(nm)r+/r-值理论结构类型实际结构类型实际配位数0.123+0.172=0.2950.2770.0180.715NaClNaCl60.123+0.188=0.3110.2880.0230.654NaClNaCl60.123+0.213=03360.2990.0370.577NaCl立方ZnS4例:极化对卤化银晶体结构的影响结晶化学定律:哥希密特(Goldschmidt)晶体的结构取决于其组成基元(原子、离子或离子团)的数量关系、大小关系与极化性能。无机化合物结构类型化学式类型AXAX2A2X3ABO3ABO4AB2O4结构类型举例氯化钠型金红石型刚玉型钙钛矿型钨酸矿型尖晶石型实例NaClTiO2α-Al2O3CaTiO3PbMoO4MgAl2O4四、同质多晶与类质同晶1、概念同质多晶:化学组成相同的物质,在不同的热力学条件下,结晶成结构不同的晶体的现象。由此而产生的每一种化学组成相同但结构不同的晶体,称为变体(也称晶型)。类质同晶:化学组成相似或相近的物质,在相同的热力学条件下,形成具有相同晶体结构的现象。例如:C2、同质多晶转变根据多晶转变前后晶体结构变化和转变速度的情况不同,分为:在同质多晶中,各个变体是在不同的热力学条件下形成的,因而具有各自稳定存在的热力学范围。当外界条件改变,变体之间就可能发生结构上的转变。位移性转变:质点间位移、键长、键角的调整,转变速度快(高低温型转变)。重建型转变:旧键的破坏,新键的形成,转变速度慢。例:SiO2β-石英(低温稳定型)α-石英(高温稳定型)α-磷石英根据多晶转变的方向,可分为:可逆转变(双向转变):当温度高于或低于转变点时,两种变体可以反复瞬时转变,位移性转变都属于可逆转变。不可逆转变(单向转变):指转变温度下,一种变体可以转变为另一种变体,而反向转变却几乎不可能,少数重建性转变属于不可逆转变。1、鲍林第一规则——配位多面体规则在离子晶体中,在每一正离子周围,形成一个负离子配位多面体,正负离子之间的距离取决于离子半径之和,正离子的配位数则取决于离子半径之比。例如:NaCl晶体,Na+半径为0.102nm,Cl-半径为0.181nm五、鲍林规则2、鲍林第二规则——静电价规则nZS=正离子配位数正离子电荷数=静电键强度iiSZ=负离子电荷数在一个稳定的离子晶体结构中,每一负离子的电价(电荷数)等于或近似等于相邻正离子分配给这个负离子的静电键强度的总和,其偏差≤价。41应用一:判断晶体结构是否稳定应用二:判断(确定)共用一个顶点的八面体的数目如:NaCl晶体如:[SiO4]、[AlO6]、[MgO6]3、鲍林第三规则——配位多面体连接方式规则在配位结构中,两个负离子多面体以共棱,特别是共面方式存在,会降低这个结构的稳定性。对于高电价、低配位的正离子,这种效应特别显著。10.580.330.580.701例:[SiO4]、[AlO6]例:岛状镁橄榄石(Mg2SiO4)4、鲍林第四规则——不同配位多面体连接规则若晶体结构中,含有一种以上的正离子,则高电价、低配位的多面体倾向于不共用多面体的点、棱、面等几何要素。[SiO4]、[MgO6][SiO4]、[Si2O7]5、鲍林第五规则——节约规则(晶体组成规则)同一晶体结构中,组成不同的结构基元的数目趋向于最小。例:(1)SiO2(2)柘榴石(Ca3Al2Si3O12)其中:CNCa=8,CNAl=6,CNSi=4本节重点最紧密堆积原理影响离子晶体结构的因素配位数与配位多面体离子极化同质多晶鲍林规则的应用



















