





《化学反应的速率PPT课件下载(共41页)》是由用户上传到老师板报网,本为文库资料,大小为2.45 MB,总共有41页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
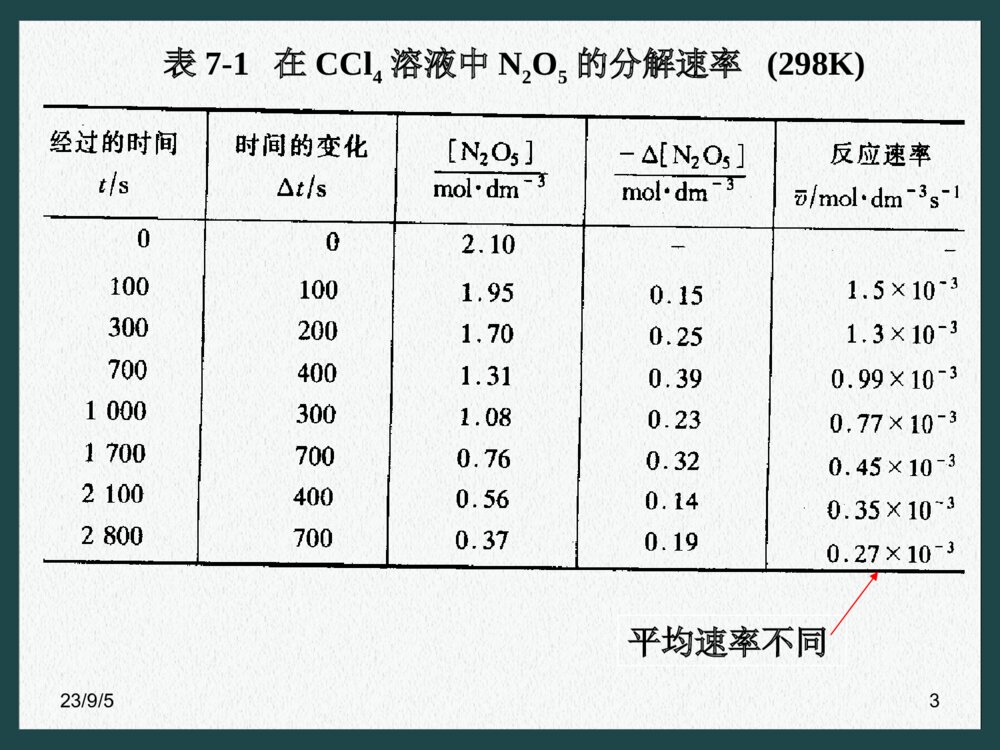
- 41页
- 2.45 MB
- VIP模板
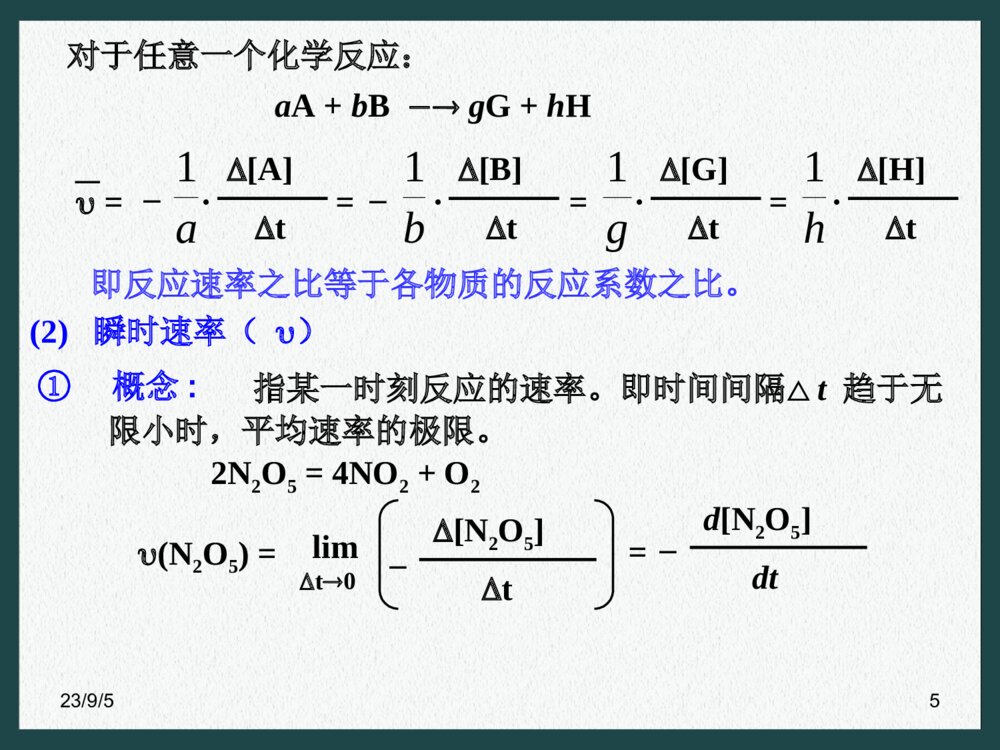
- ppt
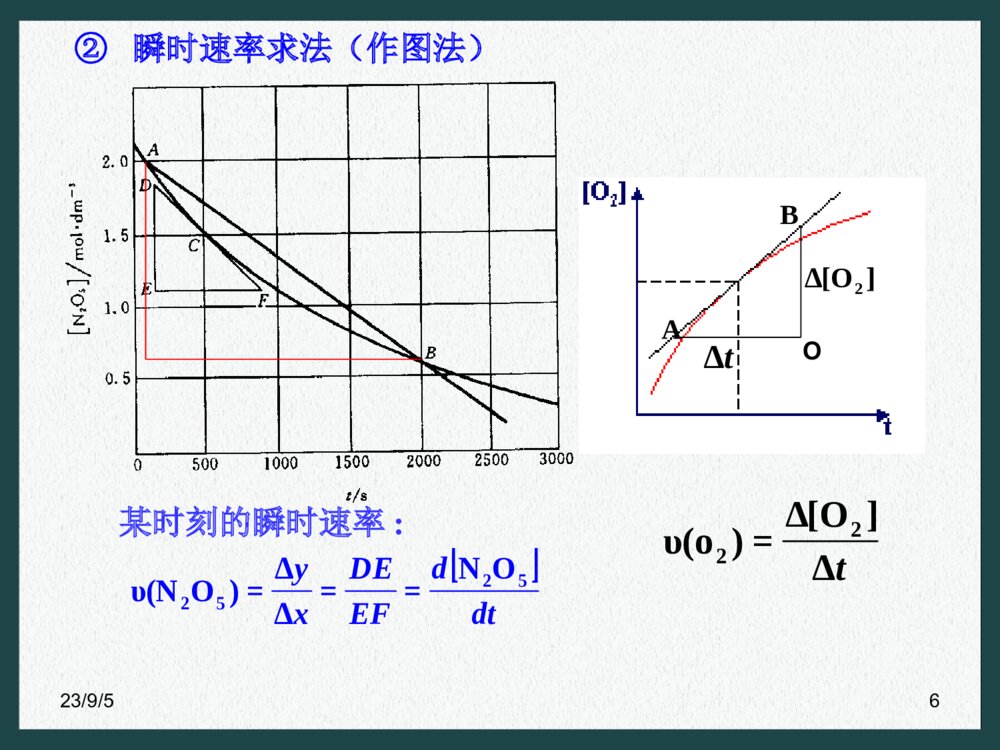
- 数字产品不支持退货
23/9/51§7.1化学反应速率的定义及其表示方法§7.2反应速率理论简介§7.3影响化学反应速率的因素化学热力学不能预测反应的速度和反应机理。化学动力学是研究化学反应的现实性的学科。的反应研究对象:0<ΔθmrG教学内容:教学内容:23/9/52§7-1化学反应速率的定义及其表示方法定义:在一定条件下,反应物转变为生成物的速率。用单位时间内反应物浓度的减少或生成物浓度的增加来表示。在CCl4溶液中N2O5的分解反应:2N2O5=4NO2+O2t1[N2O5]1t2[N2O5]2[N2O5]2–[N2O5]1t2–t1=–(N2O5)=-速率;单位:mol·dm-3·s-1;时间:s、min、h、d方法:(1)平均速率()υ–[N2O5]t23/9/53表7-1在CCl4溶液中N2O5的分解速率(298K)平均速率不同23/9/542N2O5=4NO2+O2=(N2O5)t=100s[N2O5]t–=1.510–3mol·dm–3·s–1[O2]t=(O2)=0.7510–3mol·dm–3·s–1同一个化学反应,用不同物质的浓度变化表示反应速率时,的数值不一定相同。(P280)[NO2]t=(NO2)=3.010–3mol·dm–3·s–1数值不同之间的关系:iυ[N2O5]t–21·=[NO2]t41·=[O2]t·1123/9/55aA+bBgG+hH指某一时刻反应的速率。即时间间隔△t趋于无限小时,平均速率的极限。(2)瞬时速率()(N2O5)=limt0[N2O5]t–d[N2O5]dt–====[G]t·g1[H]t·h1[A]t·a1–[B]t·b1–=对于任意一个化学反应:即反应速率之比等于各物质的反应系数之比。2N2O5=4NO2+O2①概念:23/9/56②瞬时速率求法(作图法)[]dtdEFDExy5252ON==ΔΔ=)O(Nυ]O[Δ2tΔABOtΔ]O[Δ=)o(υ22某时刻的瞬时速率:23/9/572-1碰撞理论(视分子为无内部结构的刚性球)§7-2反应速率理论简介1918年,美国物理化学家路易斯(Lewis)提出气体分子运动论碰撞理论2HI(g)H2(g)+I2(g)若[HI]=1.010-3mol·dm-3碰碰碰碰=3.51028dm-3·s-1T=973K时反应速率=5.8104mol·dm-3·s-1实际速率=1.210–8mol·dm-3·s-123/9/58活化分子-能发生反应的分子。活化分子组在全部分子中所占有的比例,以及活化分子组所完成的碰撞数占碰撞总数的比例,都符合马克斯韦尔–波耳兹曼分布。f=eEaRTf:能量因子。能量满足要求的碰撞占总碰撞次数的分数,即有效碰撞分数。Ea:能发生有效碰撞的活化分子组所具有的最低能量。(1)发生反应的两个基本条件有效碰撞-能发生反应的碰撞。23/9/59NO2+CO=NO+CO2图7-2分子的有效碰撞和无效碰撞NOOOCNOOOC无效碰撞有效碰撞发生反应的必要和充分条件:①分子要有足够高的能量。(必要条件,E≧E0)②碰撞的方位要合适。(充分条件)EaRTZPeZPf==υ碰撞频率方位因子,值在1~10-9之间23/9/510不同的反应,活化能大小不同:2SO2+O22SO3N2+3H22NH3HCl+NaOHNaCl+H2O251kJ·mol-1175.5kJ·mol-120kJ·mol-1Ea(2)活化能(Ea)普通分子变为活化分子至少需要吸收的能量。一般的化学反应Ea=60~250kJ·mol–1,Ea=0的极少,如:Br+Br=Br2Ea<0的极少,如:2NO+O2=2NO2Ea=-5.6kJ·mol-1Ea越大,反应越慢。Ea<40反应快,Ea>400反应极慢。23/9/511(1)活化配合物反应物分子的动能活化配合物的势能2-2过渡状态理论(活化配合物理论)美国物理学家艾林(Eyring)1935年提出。两个具有足够平均能量的反应物分子定向碰撞时,分子中的化学键要经过重排,能量要重新分配。在反应过程中,要经过一个中间的过渡状态,反应物分子先形成活化配合物,然后才变为产物。活化配合物也可以变为反应物。23/9/512(2)反应历程––势能图正反应的活化能:Ea=NAiEa=NAi逆反应的活化能:NO2+COO–N···O···C–OrHm1=EaO–N···O···C–ONO+CO2rHm2=–EaNO2+CONO+CO2rHm=Ea–Ea+)影响反应速率的三个因素:活化配合物的浓度活化配合物的分解几率活化配合物的分解速率+)rHm23/9/513\'mr=ΔaaEEH-反应热:吸热反应,0>Δ,′>mrHEEaa放热反应,0<Δ,′



















