







《金属及其化合物 金属的化学性质》是由用户上传到老师板报网,本为文库资料,大小为4.9 MB,总共有62页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 62页
- 4.9 MB
- VIP模板
- pptx
- 数字产品不支持退货
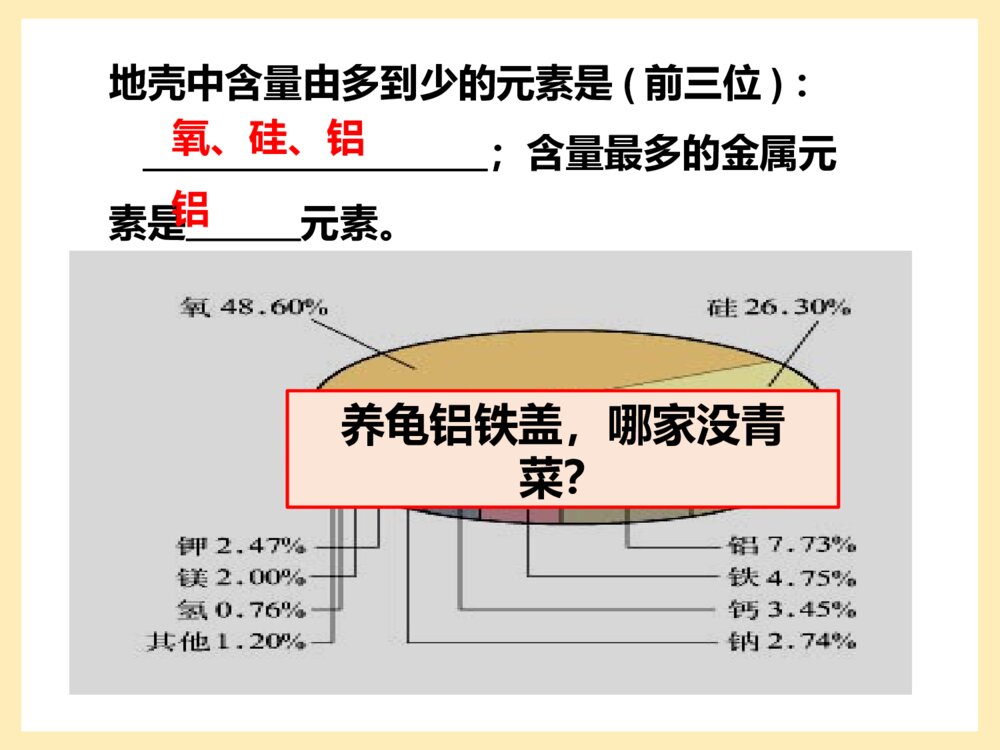
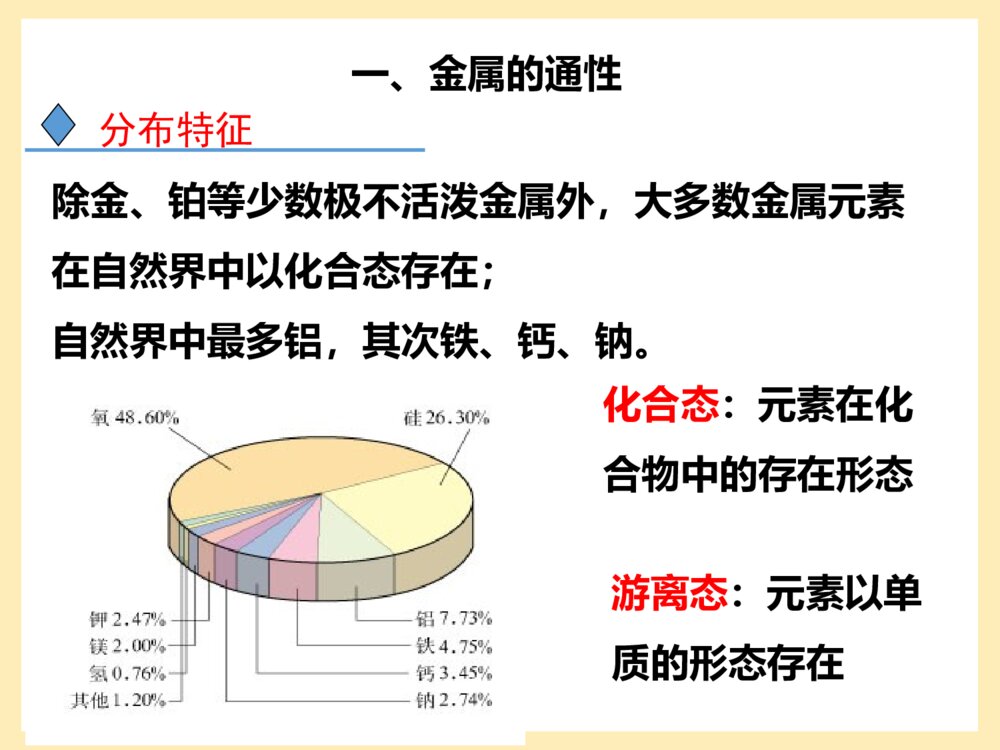
第一节金属的化学性质第三章金属及其化合物地壳中含量由多到少的元素是(前三位):;含量最多的金属元素是元素。氧、硅、铝铝养龟铝铁盖,哪家没青菜?一、金属的通性分布特征除金、铂等少数极不活泼金属外,大多数金属元素在自然界中以化合态存在;自然界中最多铝,其次铁、钙、钠。化合态:元素在化合物中的存在形态游离态:元素以单质的形态存在物理通性2、金属的颜色、光泽绝大多数金属都是银白色,具有金属光泽,少数金属是特殊颜色如铜是紫红色,金是金黄色。1、金属在常温下的状态除汞是液体外,其他在常温下是固体;一、金属的通性3、良好的导电、导热性4、延展性延性:拉成细丝的性质。展性:压成薄片的性质。分析下列图片,写出反应的化学方程式。①铝丝与硫酸铜溶液反应②镁条燃烧③铜丝与硝酸银溶液反应④镁条与稀盐酸反应2Al+3CuSO4=Al2(SO4)3+3Cu2Mg+O2=2MgOCu+2AgNO3=Cu(NO3)2+2AgMg+2HCl=MgCl2+H2↑9化学性质(1)金属与非金属(如氧气、氯气、硫)反应4Al+3O2==2Al2O32Mg+O2==2MgO2Cu+O2==2CuO4Fe+3O2==2Fe2O3(铁锈)3Fe+2O2===Fe3O4(磁性氧化铁)点燃△点燃点燃常温(2)金属与酸的反应排在H前面的金属能置换出酸里的氢金属活动性顺序表:KCaNaMgAlZnFeSnPb(H)CuHgAgPtAuZn+H2SO4==ZnSO4+H2Fe+2HCl==FeCl2+H2(3)与盐反应(金属之间的置换反应)排在前面的金属能把排在后面的金属从其盐溶液中置换出来。如:2Al+3CuSO4==3Cu+Al2(SO4)3Cu+2AgNO3==2Ag+Cu(NO3)2依据Na、Mg、Al的原子结构示意图,分析它们的原子结构有什么特点,与金属的化学性质有什么联系?NaMgAl金属最外层上的电子一般少于4个,反应中很容易失去电子,表现出较强的还原性。(做还原剂)钠,镁,铝的还原性强弱?化学通性1、化合态金属元素只有正化合价2、金属单质易失电子,表现还原性3、易与氧气,氯气反应,得到氧化物和氯化物4、活动性排在氢前的金属元素与酸反应得到盐和氢气5、与盐反应,置换出活动性弱的金属单质一、金属的通性二、金属的性质1、金属与非金属单质反应(1)钠与氧气的反应从煤油中取一小块金属钠,用刀切去一端的外皮,观察实验现象.现象:切口处可观察到银白色的金属光泽,在空气中很快变暗。1)金属与氧气的反应从以上实验,我们了解到金属钠的哪些物理和化学性质?物理性质:1.为银白色的固体2.质软(硬度小)化学性质:很活泼,常温下能与氧气反应.4Na+O2===2Na2ONa的性质3.密度比煤油大钠必须保存在隔绝空气环境中,实验室将钠保存在煤油或石蜡中现象:先熔化成小球,后燃烧产生黄色火焰,生成淡黄色固体2Na+O2===Na2O2△特殊的氧化物——过氧化钠:Na2O2+1-1注意事项:1、用镊子取出钠后,要用滤纸吸干钠及镊子表面的煤油,用镊子夹紧放在玻璃片上,切去表面的外皮后,放在坩埚中加热。2、坩埚加热时应与泥三角配套使用。3、观察到钠开始燃烧后,应立即撤掉酒精灯,并将酒精灯熄灭。4、实验结束时,要用坩埚钳将坩埚和泥三角取下,并放在石棉网上。绝对不可以直接用手去拿或直接将它们放在桌子上。探究内容〔实验3-1〕取一小块金属钠,用小刀切去一端的外皮,观察实验现象。〔实验3-2〕把一小块金属钠放在坩埚上,加热,有何现象发生?现象反应方程式结论在钠的切口处可以观察到银白色的金属光泽,切口处在空气中很快变暗。4Na+O2===2Na2O(1)钠与氧气反应钠受热先熔化成银白色的小球,接着就燃烧起来,燃烧时火焰呈黄色,有烟产生,最后生成淡黄色固体。2Na+O2===Na2O2△钠的化学性质很活泼,在常温或加热的条件下都能跟氧气反应生成不同的产物,但加热时与氧气的反应更加剧烈。(条件不同,现象不同,产物不同。)Na2O与Na2O2哪一种物质更稳定?2Na2O+O2==2Na2O2△现象:铝箔熔化,表面失去光泽,熔化的铝并不滴落。因为铝表面有一层氧化膜保护了铝。即使打磨过的铝箔,在空气中也会很快生成新的氧化膜。构有薄膜的Al2O3的熔点(2050℃)高于Al(660℃),没有熔化,包在铝的外面使熔化的液态铝不会滴落下来。加热铝箔现象解释:资料卡片:Al2O3和MgO致密,熔点高,做耐火材料。熔而不滴落4Al+3O2=======2Al2O3常温或点燃应用:人们日常用的铝制品,表面总是覆盖着保护膜,这层膜起着保护内部金属的作用,这也正是性质活泼的铝在空气中能够稳定存在的原因。也由于氧化膜的存在,使得性质活泼的金属铝成为一种应用广泛的金属材料。结构→性质→用途铝的氧化膜2)金属与硫反应2Na+S==Na2SFe+S==FeS2Cu+S==Cu2S2Na+Cl2====2NaCl2Fe+3Cl2====2FeCl3Cu+Cl2====CuCl2点燃点燃点燃(3)金属与氯气反应二、金属与酸和水反应我得意的笑,又得意的笑…无所谓,我无所谓…God!Saveme!!为什么受伤的总是我!思考:观察此图,你有何看法?结论:金属活动性顺序表中(H)前面的金属与酸反应产生H2。金属越活泼,与酸反应越剧烈。1)钠与水反应概括现象性质2Na+2H2O=2NaOH+H2↑浮熔游、响红钠浮在水面上立刻熔成一个小球在水面上四处游动,发出“嘶嘶声”反应后溶液变红密度比水小反应放热,熔点低产生气体生成碱性物质现象:产生轻微的爆鸣声如何检验金属钠与水反应生成的气体是H2氢气结论:2Na+2H2O===2NaOH+H2将钠放入硫酸铜溶液中,能否置换出铜单质?将钠放入盐酸中,钠将先和H2O反应,还是先和HCl反应?2Na+CuSO4=Cu+Na2SO42Na+2HCl=2NaCl+H2↑课堂思考:×2NaOH+CuSO4=Cu(OH)2↓+Na2SO42Na+2H2O=2NaOH+H2↑钠与酸反应时,如酸过量则钠只与酸反应,地不足量则钠先与酸反应再与水反应Na与酸反应产生氢气的量由Na决定。2Na~~H2一般规律:(先酸后水再盐)钠与酸溶液反应时,钠直接与溶液中的酸反应,但当钠与其它溶液反应时,一般是钠先与水反应生成氢氧化钠和氢气,然后再看生成的氢氧化钠是否与原溶液中的溶质反应!讨论:钠的保存、在自然界的存在、用途、制法保存在煤油或石蜡油里。易与空气中的氧气反应易与水反应钠着火的处理?性质:用干燥的沙土扑灭保存:决定(1)做还原剂,用以将钛,锆,铌,钽等在国防工业上有重要用途的金属从其熔融的卤化物中还原出来.(2)做化工原料,用以生产丁钠橡胶,氢化钠,过氧化钠,氰化钠等含钠化合物金属钠的用途(3)制造合金.钠与汞的合金钠汞齐,用做有机合成的还原剂.钠铅合金Na4Pb,用于汽油抗爆剂四乙基铅生产:Na4Pb+4C2H5Cl=(C2H5)4Pb+4NaCl.钠钾合金,在室温下呈液态,它的密度,粘度小,比热大,导热率高,用做核反应堆的冷却剂和热交换剂.(4)做电光源.钠蒸气的黄光透雾力强,用钠制造的高压钠灯广泛用于公路照明.镁与沸水反应铁与水蒸气的反应铁不能与冷、热水反应,(可以在水,氧气的条件下被腐蚀生锈,主要成分是Fe2O3)但能否与水蒸气反应?实验装置:1.水蒸气的发生装置2.水蒸气与铁粉反应装置3.产物的检验(收集)装置水蒸气的发生装置水蒸气与铁粉反应装置产物收集装置方案1:方案2:3Fe+4H2O(g)Fe3O4+4H2方案3:转移8e-现象:加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声。注意事项:1、整套装置试管口应低于试管底;2、先预热;3、加热一会儿后再将导管插入到肥皂水中,用燃着的火柴去点燃肥皂泡,可发出爆鸣声;4、实验结束时,应先从肥皂水中撤出导管,再移去燃着的酒精灯。3Fe+4H2O(g)====Fe3O4+4H2高温金属与水反应小结Mg+2H2O====Mg(OH)2+H2↑100℃2Na+2H2O=2NaOH+H2↑2K+2H2O=2KOH+H2↑(剧烈,氢气易爆炸)金属性越强,越容易与水反应1.下列关于钠的叙述中,不正确的是()A.钠燃烧时发出黄色的火焰B.钠燃烧时生成氧化钠C.钠有很强的还原性D.钠原子的最外层只有一个电子BB2.下列关于铝的叙述中,不正确的是()A.铝是地壳中含量最多的金属元素B.在常温下,铝不能与氧气反应C.铝是一种比较活泼的金属D.在化学反应中,铝容易失去电子,是还原剂三.铝与氢氧化钠溶液的反应1.铝与稀盐酸的反应化学方程式为:2.铝与氢氧化钠溶液的反应2Al+2NaOH+2H2O==2NaAlO2+3H22Al+6HCl==2AlCl3+3H2(可看作分两步进行)铝既能与强酸反应,又能与强碱反应,是两性金属铝既能与强酸溶液反应也能与强碱溶液反应,因此酸、碱可直接侵蚀铝的保护膜以及铝制品本身,铝制品餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物。四、物质的量在化学方程式计算中的应用2Na+2H2O=2NaOH+H2↑化学计量数之比2:2:2:1物质的量之比2mol:2mol:2mol:1mol横(量)相当,竖(单位)相同化学计量数之比等于物质的量之比扩大NA倍2NA:2NA:2NA:NA实验室用6.5gZn与足量盐酸完全反应。求:①Zn的物质的量;②参加反应HCl的物质的量;③生成H2的体积(标况下)。解:n(Zn)=m(Zn)M(Zn)6.5g65g/mol==0.1mol2、根据化学方程式进行计算的基本步骤:(1)根据题意写出相关反应的化学方程式(2)找出相关物质的计量数之比(3)对应计量系数,找出相关物质的物质的量(要求的量用n(B)或设未知数x、y等代表)(4)根据计量关系进行计算。Zn+2HCl==ZnCl2+H2解:12n(HCl)0.1moln(HCl)=0.2mol1n(H2)n(H2)=0.1molV(H2)=n(H2)×Vm=0.1mol×22.4L/mol=2.24L120.1moln(HCl)=110.1moln(H2)=Zn+2HCl==ZnCl2+H21mol22.4LV(H2)0.1mol1mol0.1mol=22.4LV(H2)(1)横(量)相当,竖(单位)相同;(2)带单位运算,结果单位要合理。注意:新解法:将8.1g铝与足量的氢氧化钠反应,计算生成氢气___L,需要氢氧化钠__mol,有__mol电子发生转移。2Al+2NaOH+2H2O=2NaAlO2+3H2↑~6e-54g2mol22.4L6mol8.1gxmolyLzmolX=0.3molY=3.36LZ=0.9mol∴生成氢气3.36L,需要氢氧化钠0.3mol,有0.9mol电子发生转移。[例1]除去镁粉中混有的少量铝粉,可选用的试剂是()。A.稀盐酸C.氢氧化钠溶液B.稀硫酸D.氨水点拨:Mg、Al都是活泼的金属,与盐酸、稀硫酸均能发生反应,但与氨水都不反应,Al能与NaOH溶液反应,而Mg不能,故可用NaOH溶液除去Al杂质。答案:C二、物质的量在化学方程式计算中的应用1.物质的量与各物理量之间的关系。2.化学方程式中化学计量数与各化学计量间的关系。2Na+2H2O===2NaOH+H2↑质量化学计量数46g236g280g22g1微粒个数2NA2NA2NANA物质的量2mol2mol2mol1mol结论:化学方程式中化学计量数之比=参加反应的各物质的微粒个数之比=参加反应的各物质的物质的量之比=参加反应的各物质的气体体积(相同条件,适用于气体反应)之比。3.物质的量应用于化学方程式计算的解题步骤。[例2]在500mLNaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6L,该NaOH溶液的浓度为)。A.1.0mol/LC.1.5mol/LB.2.0mol/LD.3.0mol/L点拨:铝粉过量,则计算时依据反应方程式:2Al+2NaOH+2H2O===2NaAlO2+3H2↑和物质的量比等于体积比。答案:B易混易错钠、铝、铁化学性质的比较3Fe+4H2O(g)项目NaAlFe与O2反应常温下氧化成Na2O,加热时生成Na2O2,Na保存在煤油中常温下氧化生成致密的氧化膜,使得铝耐腐蚀,纯氧中可燃在潮湿空气中易生锈,在纯氧中点燃生成Fe3O4与H2O反应2Na+2H2O===2NaOH+H2↑受氧化膜阻碍Fe3O4+4H2与酸反应2Na+2H+===2Na++H2↑2Al+6H+===2Al3++3H2↑Fe+2H+===Fe2++H2↑项目NaAlFe与盐反应2Na+2H2O+Cu2+===2Na++Cu(OH)2↓+H2↑2Al+3Cu2+==2Al3++3CuFe+Cu2+===Fe2++Cu与碱反应与水反应2Al+2OH-+2H2O==+3H2↑不反应2AlO-22AlO-21.铝与酸及氢氧化钠溶液反应的计算技巧。金属铝与强酸、强碱溶液反应的离子方程式分别为:2Al+6H+==2Al3++3H22Al+2OH-+2H2O==2AlO2-+3H2当两个反应中铝的量相同时,生成的氢气的体积取决于铝与酸或碱的相对关系。方法指津(2)等物质的量的HCl和NaOH分别与足量的铝反应,产生的氢气的体积比为1∶3。(3)一定量的铝分别与一定量的盐酸和NaOH溶液反应,若产生氢气的体积比介于1∶3和1∶1之间时,有:①铝与盐酸反应时,铝过量而盐酸不足;②铝与NaOH溶液反应时,铝不足而NaOH过量。(1)等物质的量的铝分别与足量盐酸和NaOH溶液反应,产生的氢气的体积比为1∶1。2.由于铝既能与酸反应,又能与碱反应,故当其他金属混有铝杂质时,如铁粉中混有铝粉,可选用加入强碱溶液充分反应后过滤来提纯金属。[例3]等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5∶7,则甲、乙两烧杯中的反应情况可能分别是()。A.甲、乙中都是铝过量B.甲中铝过量,乙中碱过量C.甲中酸过量,乙中铝过量D.甲中酸过量,乙中碱过量解析:因为等量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生H2的体积比为1∶1,足量的铝分别与等物质的量浓度、等体积的盐酸和氢氧化钠溶液反应,产生H2的体积比为1:3,而今产生H2的体积比:,所以反应的情况为:甲中铝不足,盐酸不足;乙中铝不足,氢氧化钠过量。答案:B13



















