




《化学平衡的移动的PPT课件下载(共71页)》是由用户上传到老师板报网,本为文库资料,大小为2.57 MB,总共有71页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 71页
- 2.57 MB
- VIP模板
- ppt
- 数字产品不支持退货
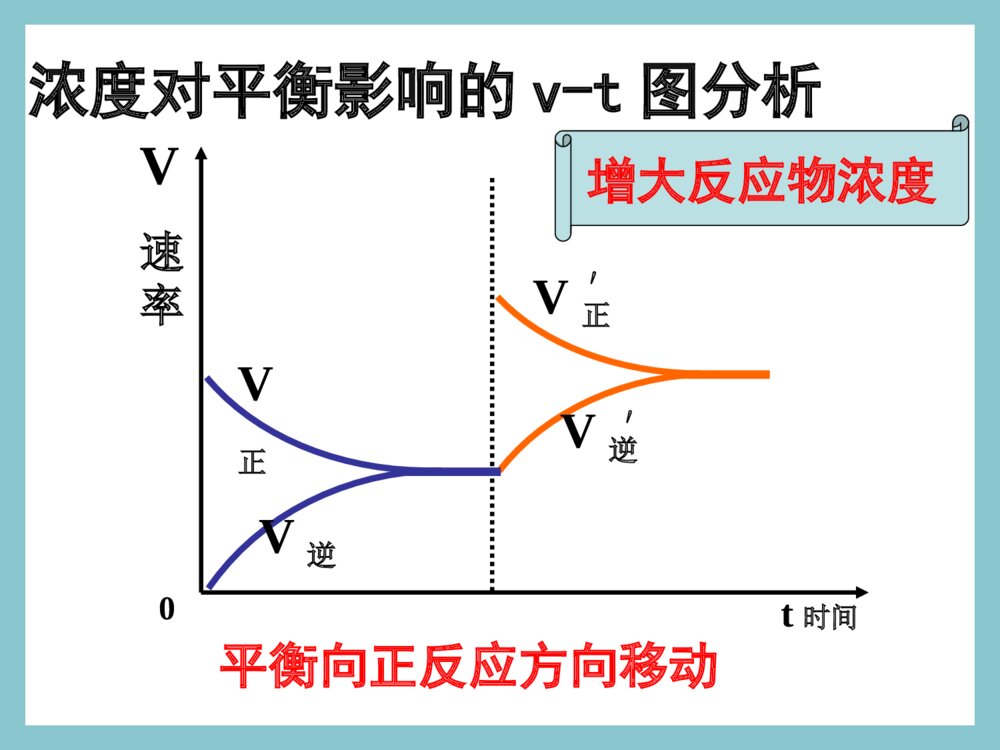
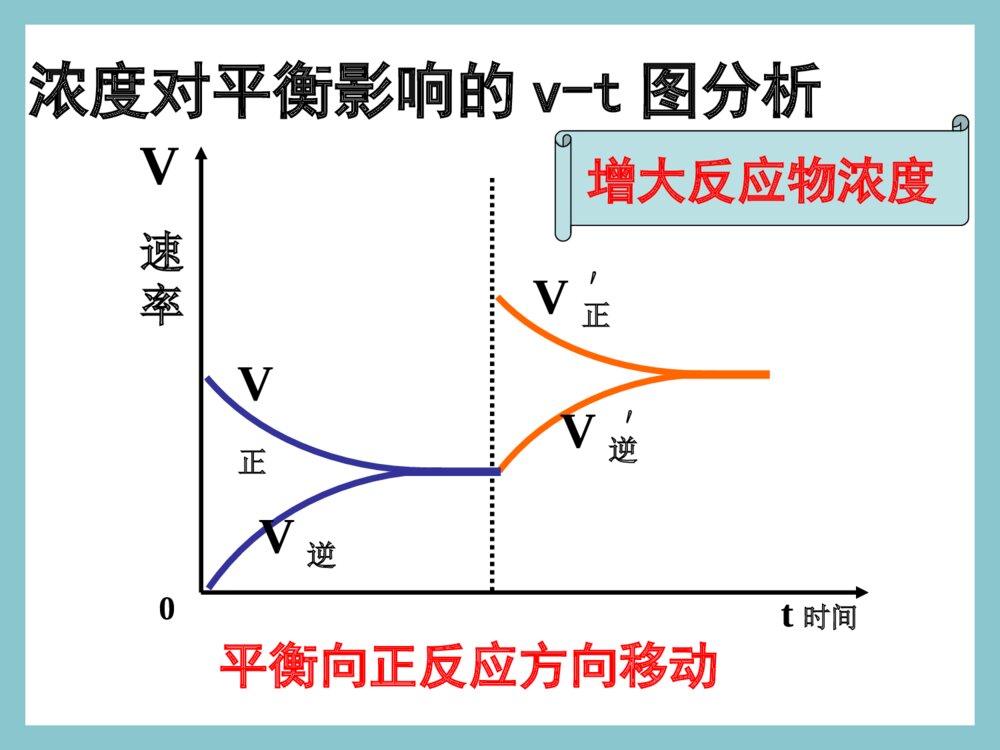
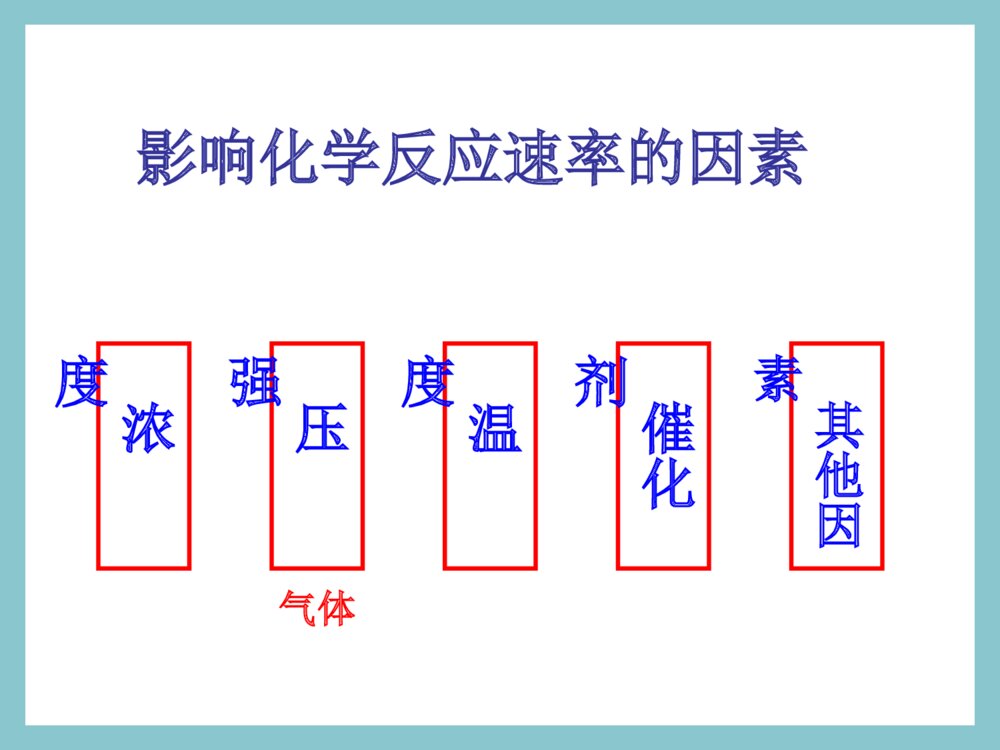
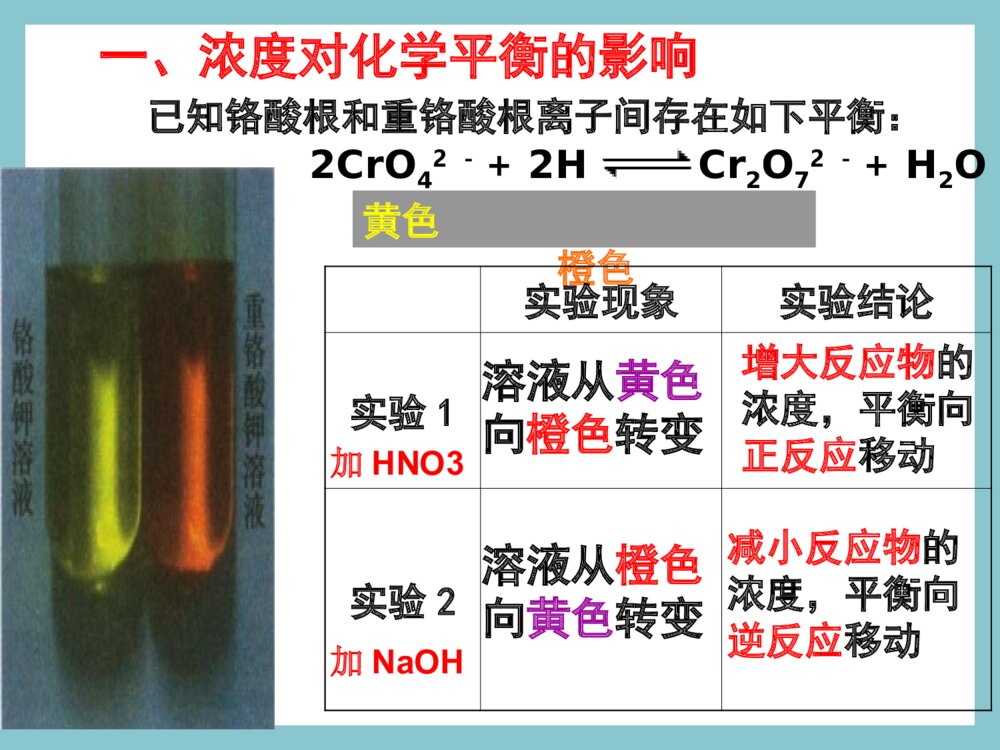
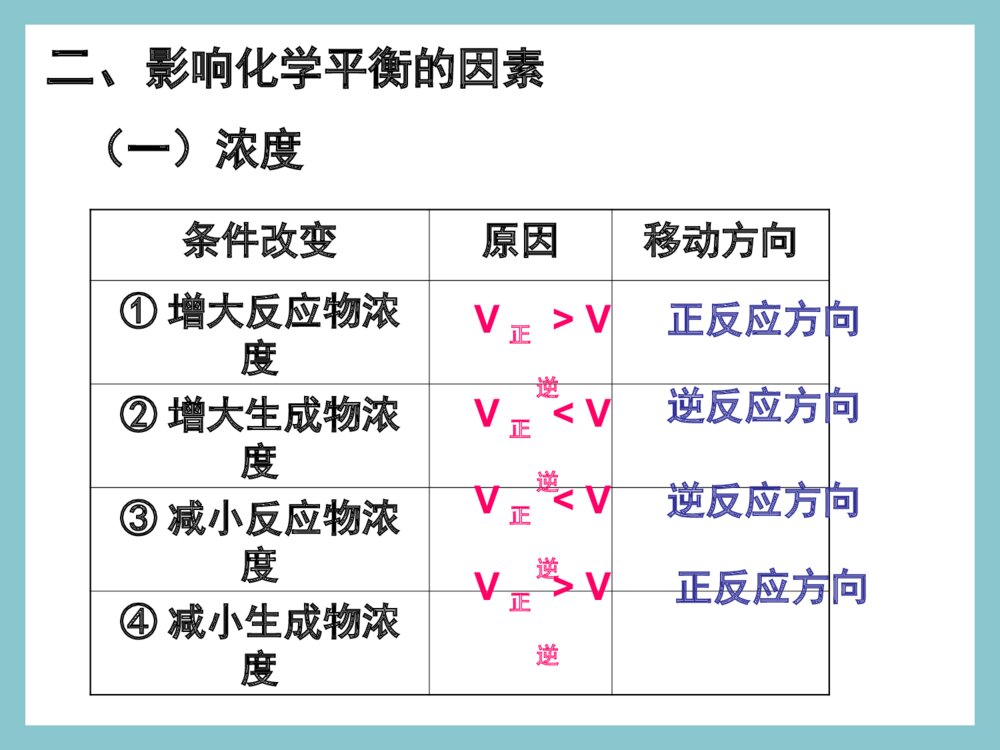
化学平衡的移动浓度对平衡影响的v-t图分析V正V逆′′V速率V正V逆0t时间平衡向正反应方向移动增大反应物浓度一、化学平衡的移动一、化学平衡的移动11、概念:改变外界条件,破坏原有的平、概念:改变外界条件,破坏原有的平衡状态,建立起新的平衡状态的过程。衡状态,建立起新的平衡状态的过程。((P49P49))旧平衡旧平衡VV正正=V=V逆逆条件改变条件改变vv正正≠≠vv逆逆新平衡新平衡VV\'\'正正=V=V\'\'逆逆2、移动的原因:外界条件发生变化。①若V正>V逆,平衡向正反应方向移动。平衡不移动。②若V正=V逆,平衡向逆反应方向移动。③若V正<V逆,二、化学平衡移动的方向二、化学平衡移动的方向当外界条件改变后:当外界条件改变后:注意:移动的方向:由v正和v逆的相对大小决定。浓度对平衡影响的v-t图分析V正V逆′′V速率V正V逆0t时间平衡向正反应方向移动增大反应物浓度浓度压强温度催化剂其他因素影响化学反应速率的因素气体一、浓度对化学平衡的影响已知铬酸根和重铬酸根离子间存在如下平衡:2CrO42-+2H+Cr2O72-+H2O黄色橙色实验现象实验结论实验1实验2加HNO3加NaOH溶液从黄色向橙色转变溶液从橙色向黄色转变增大反应物的浓度,平衡向正反应移动减小反应物的浓度,平衡向逆反应移动二、影响化学平衡的因素(一)浓度条件改变原因移动方向①增大反应物浓度②增大生成物浓度③减小反应物浓度④减小生成物浓度V正>V逆V正V逆V正0粉红色蓝色三、温度对化学平衡的影响2NO2N2O4△H<0红棕色无色结论及应用:大量实验研究表明,在其他条件不变的情况下,升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动。N2+3H22NH3△H<0四、催化剂对化学平衡的影响催化剂降低了反应的活化能,正反应的活化能降低,逆反应的活化能也降低,正反应的活化分子百分数增加几倍,逆反应的活化分子百分数也增加几倍,正逆反应速率增加的倍数相等,加催化剂,不能使平衡发生移动,只影响到达平衡的时间。改变反应条件平衡移动①②③增大反应物浓度减少生成物浓度向正方向移动减小反应物浓度增加生成物浓度向逆方向移动增大压强减小压强向体积增大的方向移动升高温度向吸热反应方向移动向放热反应方向移动降低温度[总结]改变反应条件时平衡移动的方向向体积缩小的方向移动早在1888年,法国科学家勒夏特列就发现了这其中的规律,并总结出著名的勒夏特列原理,也叫化学平衡移动原理:如果改变影响平衡的一个条件(如浓度、温度、或压强等),平衡就向能够减弱这种改变的方向移动。化学平衡移动原理——勒夏特列原理如果改变影响平衡的一个条件(如浓度、温度、或压强等),平衡就向能够减弱这种改变的方向移动。注意:①是“减弱”这种改变,不是“消除”这种改变②勒夏特列原理适用于任何动态平衡体系(如:溶解平衡、电离平衡、沉淀平衡、水解平衡等),未平衡状态不能用此来分析③平衡移动原理只能用来判断平衡移动方向,但不能用来判断建立平衡所需时间。练习与实践8.在硫酸工业中有如下反应:请回答以下问题:(1)为什么在生产上要用过量的空气?(2)为什么要使用催化剂?(3)为什么不在高温下进行反应?2SO2(g)+O2(g)2SO3(g)△H<0N2(g)+3H2(g)2NH3(g)△=-92.4kJ·mol-1已知N2与H2反应合成NH3是一个可逆反应,其热化学方程式为:合成氨的工艺流程如图2-24所示。在工业生产中,可以通过以下途径来提高合成氨的产率。请利用有关知识分析采取这些措施的原因。1.向反应器中注入过量N2。2.采用适当的催化剂。3.在高压下进行反应。4.在较高温度下进行反应。浓度对平衡影响的v-t图分析1V正V逆′′V速率V正V逆0t时间平衡向正反应方向移动增大反应物浓度浓度对平衡影响的v-t图分析2V逆V正′′V速率V正V逆0t时间平衡向逆反应方向移动增大生成物浓度浓度对平衡影响的v-t图分析3V正V逆′′V正V逆t时间V速率0平衡向逆反应方向移动减小反应物浓度浓度对平衡影响的v-t图分析4V逆V正′′V正V逆t时间V速率0平衡向正反应方向移动减小生成物浓度信息提示!!有关化学平衡的计算规则和化学平衡移动原理有着广泛的适用性,可用于研究所有的化学动态平衡,如后续即将讨论的电离平衡、水解平衡和沉淀溶解平衡等。我们要学会用平衡的观点去解释有关的化学现象,揭示化学反应的规律。练习与实践7.在一定条件下,反应:在一密闭体系中达到化学平衡。(1)请写出该反应的平衡常数表达式:(2)请说明改变下列条件时,平衡如何移动。a.保持压强不变,升高温度;b.保持温度不变,缩小容器的体积;c.保持体积不变,通入氢气。H2(g)+I2(g)2HI(g)△H<0练习与实践1.某一化学反应,反应物和生成物都是气体,改变下列条件一定能使化学平衡向正反应方向移动的是()A.增大反应物浓度B.减小反应容器的体积C.增大生成物浓度D.升高反应温度2.压强变化不会使下列化学反应的平衡发生移动的是()A.Fe2O3(g)+3CO(g)2Fe(s)+3CO2(g)B.N2+3H22NH3C.2SO2(g)+O2(g)2SO3(g)D.C(s)+CO2(g)2CO(g)练习与实践3.已知化学反应2A(?)+B(g)2C(?)达到平衡,当增大压强时,平衡向逆反应方向移动,则()A.A是气体,C是固体B.A、C均为气体C.A、C均为固体D.A是固体,C是气体练习与实践4.反应A(g)+3B(g)2C(g)△H<0达平衡后,将气体混合物的温度降低,下列叙述中正确的是()A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动C.正反应速率和逆反应速率都减小,平衡向正反应方向移动D.正反应速率和逆反应速率都减小,平衡向逆反应方向移动练习与实践5.一定条件下,二氧化氮和四氧化二氮之间存在下列平衡:2NO2(g)N2O4在测定NO2的相对分子质量时,下列条件中测定结果误差最小的是()A.温度130℃、压强3.03×105PaB.温度25℃、压强1.01×105PaC.温度130℃、压强5.05×104PaD.温度0℃、压强5.05×104pa练习与实践6.在一密闭容器中,反应aA(g)bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则()A.平衡向正反应方向移动了B.物质A的转化率减小了C.物质B的质量分数增加了D.a>b化学平衡状态只有在一定的条件下才能保持。当外界条件改变时,原有平衡状态被破坏,一段时间后会达到新的平衡状态。化学平衡的移动,就是改变外界条件,破坏原有的平衡状态,建立起新的平衡状态的过程。浓度引起平衡移动的浓度引起平衡移动的v-tv-t图分析图分析②减小生成物浓度tt221、浓度的变化对化学平衡的影响V正>V逆平衡正向移动VV((逆逆))VVVV((正正))ttV(V(正正)=V)=V((逆逆))00tt11①增大反应物浓度tt22VV((正正))VV((逆逆))VV((正正)=V)=V((逆逆))tt33VV((正正))VV((逆逆))VV((正正)=)=VV((逆逆))tt3300VVttVV((正正))VV((逆逆))VV((正正)=)=VV((逆逆))tt11结论:增加反应物浓度或减小生成物的浓度都可使平衡正向移动浓度引起平衡移动的浓度引起平衡移动的v-tv-t图分析图分析②减小反应物浓度tt221、浓度的变化对化学平衡的影响V逆>V正平衡逆反应方向移动VV((逆逆))VVVV((正正))ttV(V(正正)=V)=V((逆逆))00tt11①增大生成物浓度tt22VV((逆逆))VV((正正))VV((正正)=V)=V((逆逆))tt33VV((逆逆))VV((正正))VV((正正)=)=VV((逆逆))tt3300VVttVV((正正))VV((逆逆))VV((正正)=)=VV((逆逆))tt11结论:增加生成物浓度或减小反应物的浓度都可使平衡向逆反应方向移动2、压强变化对化学平衡的影响(1)、增大压强,对于有气体参加和气体生成的化学反应来讲,由于缩小了体积,气体的浓度增大,提高了反应速率。(2)、若两边都有气体,则改变压强同时改变正逆反应速率,当反应前后分子数目不同,速率改变倍数不一样,分子数目多的一侧速率改变倍数大。(3)、当反应前后体积相同时,增大倍数相同。对于某些有气体参与的可逆反应,由于压强的改变引起了浓度的改变,有可能使平衡发生移动。VV小>VV大平衡向气体体积减小的方向移动VV大>VV小平衡向气体体积增大的方向移动结论:增加压强可使平衡向气体减小的方向移动;减小压强可使平衡向气体体积增大的方向移动.压强引起平衡移动的压强引起平衡移动的v-tv-t图分析图分析②减小压强tt222、压强的变化对化学平衡的影响VV((逆逆))VVVV((正正))ttV(V(正正)=V)=V((逆逆))00tt11①增大压强tt22VV((正正))VV((逆逆))VV((正正)=V)=V((逆逆))tt33VV逆逆VV正正VV((正正)=)=VV((逆逆))tt3300VVttVV((正正))VV((逆逆))VV((正正)=)=VV((逆逆))tt11N2+3H22NH3对于反应前后气体分子数目不变的反应对于反应前后气体分子数目不变的反应压强引起平衡移动的相关v-t图分析VVtt00VV((正正))VV((逆逆))⑤⑤增大压强增大压强⑥⑥减小压强减小压强VVtt00VV((正正))VV((逆逆))V正=V逆V正=V逆V正=V逆平衡不移动H2(g)+I2(g)2HI(g)3、温度变化对化学平衡的影响注意:温度的变化一定会影响化学平衡,使平衡发生移动结论结论:在其他条件不变时,温度升高,会使:在其他条件不变时,温度升高,会使化学平衡向吸热反应的方向移动,温度降低化学平衡向吸热反应的方向移动,温度降低会使化学平衡向放热的方向移动。会使化学平衡向放热的方向移动。3、温度变化对化学平衡的影响温度的改变对正逆反应速率都会产生影响,但影响的程度不同,温度的变化对吸热反应的速率比放热反应的速率影响大。具体表现在:升高温度,正、逆反应速率都增大,但增大的倍数不一样,吸热反应增大的倍数大。降低温度,正、逆反应速率都减小,但降低的倍数不一样,吸热反应降低的倍数大。3、温度变化对化学平衡的影响VV吸热吸热VV放热放热VVtt00VV((正正))VV((逆逆))①①升高温度升高温度V吸>V放平衡向吸热方向移动结论:其他条件不变,升高温度平衡向吸热反应方向移动温度引起平衡移动的相关v-t图分析3、温度变化对化学平衡的影响温度引起平衡移动的相关v-t图分析②②降低温度降低温度VVtt00VV((正正))VV((逆逆))VV放热放热VV吸热吸热V放>V吸平衡向放热反应方向移动结论:其他条件不变,降低温度平衡向放热反应方向移动t时间加入正催化剂VV速率VV正VV逆0VV逆=VV正正′′催化剂同等程度的改变正、逆反应速率(V正=V逆)使用催化剂,对化学平衡无影响。正催化剂能缩短平衡到达的时间4、使用催化剂对化学平衡的影响t时间加入负催化剂VV速率VV正VV逆0VV逆=VV正正′′ 四、几种平衡图像mA(g)+nB(g)pC(g)+qD(g);△H⑴转化率-时间对于反应△H<0m+n>p+qm+n=p+qm+n0△H>0mA(g)+nB(g)pC(g)+qD(g);△Hm+n>p+qm+n>p+q⑶转化率-温度-压强图mA(g)+nB(g)pC(g)+qD(g);△Hm+n>p+q△H<0m+n0⑷含量-温度-压强图mA(g)+nB(g)pC(g)+qD(g);△Hm+n>p+q△H>0m+n0图象题1B1.对于达到平衡的可逆反应:X+YW+Z增大压强则反应速率的变化图象如右下图所示。据此分析X、Y、W、Z的聚集状态是()A.Z、W均为气态,X、Y中有一种为气体B.Z、W中有一种为气体,X、Y均为气体C.X、Y、Z均为非气体,W为气体D.X、Y均为气体,Z、W皆为非气体vV(正)V(正)V(逆)V(逆)时间t2.已知某可逆反应:mA(气)+nB(气)pC(气)△H在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p和反应物B在混合气体中的百分含量B%的关系曲线。由曲线分析,下列判断正确的是()A.T1T2p1p2m+npH<0△B.C.D.T1T2p1p2m+npH>0△T1T2p1p2m+npH>0△T1T2p1p2m+npH<0△0t1t2t3tB%T1P2T2P2T2P1C图象题2图象题33.已知反应3A(g)+B(g)C(s)+4D(g)H<0△下图中a、b表示一定条件下,D的体积分数随时间t的变化情况,若要使曲线b变为曲线a,可采取的措施是()增大B的浓度升高反应温度缩小反应容器的体积加入催化剂143212312343A.B.C.D.D%ab时间tD图象题4mA(固)+nB(气)pC(气)+Q上述可逆反应在一定条件下反应,B的体积分数B%与压强的关系如右图所示,有关叙述正确的是A.m+npB.npC.x点的状态时混合体系中v正v逆D.x点的状态比y点的状态混合体系中的反应速率快•x•y压强B%4.np(1)混合气体的颜色不再改变()(2)混合气体的平均相对分子质量不变()(3)混合气体的密度不变()(4)混合气体的压强不变()(5)单位时间内消耗2nmolNO2的同时生成2nmolO2()(6)O2气体的物质的量浓度不变()1.在固定体积的的密闭容器中发生反应:2NO22NO+O2该反应达到平衡的标志是:化学平衡状态的判断练习题2.已知:CO(g)+NO2(g)CO2(g)+NO(g)在一定条件下达到化学平衡后,降低温度,混合物的颜色变浅下列关于该反应的说法正确的是____________A.该反应为放热反应B.降温后CO的浓度增大C.降温后NO2的转化率增加D.降温后NO的体积分数增大E.增大压强混合气体的颜色不变F.恒容时,通入He气体,混合气体颜色不变G.恒压时,通入He气体,混合气体颜色不变ACDF化学平衡计算1在一定条件下,合成氨反应达到平衡后,混合气体中NH3的体积分数为25%,若反应后条件保持不变,则反应后缩小的气体积与原反应物体积的比值是()A.1/5B.1/4C1/3.D1/2.[解]N2+3H22NH31322V设原反应物体积为V,反应后缩小的体积为xx(V-x)•25%=解之,得:x=1/5V所以,其比值为:1:5A化学平衡计算2一定条件下,在容积为2L的密闭容器例加入一定物质的量的A气体,发生如下反应并建立平衡:A(g)2B(g)2B(g)C(g)+2D(g)测得平衡时各物质的量浓度是:[A]=0.3mol/L,[B]=0.2mol/L[C]=0.05mol/L。最初向容器里加入A的物质的量是________。A(g)2B(g)2B(g)C(g)+2D(g)始a0转平0.30.20.20.050.050.100.30.30.15n(A)=a=(0.15+0.3)mol/L2L=0.9mol[解]0.9mol练习4:在一密闭容器中充入1molNO2,建立平衡:2NO2N2O4测得NO2转化率为a%。在其它条件不变时,再充入1molNO2,待新平衡建立时,又测NO2的转化率为b%,问a、b值的大小关系。ba﹥



















