






《《金属的腐蚀和防护》化学选修一PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为1.75 MB,总共有23页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 23页
- 1.75 MB
- VIP模板
- ppt
- 数字产品不支持退货
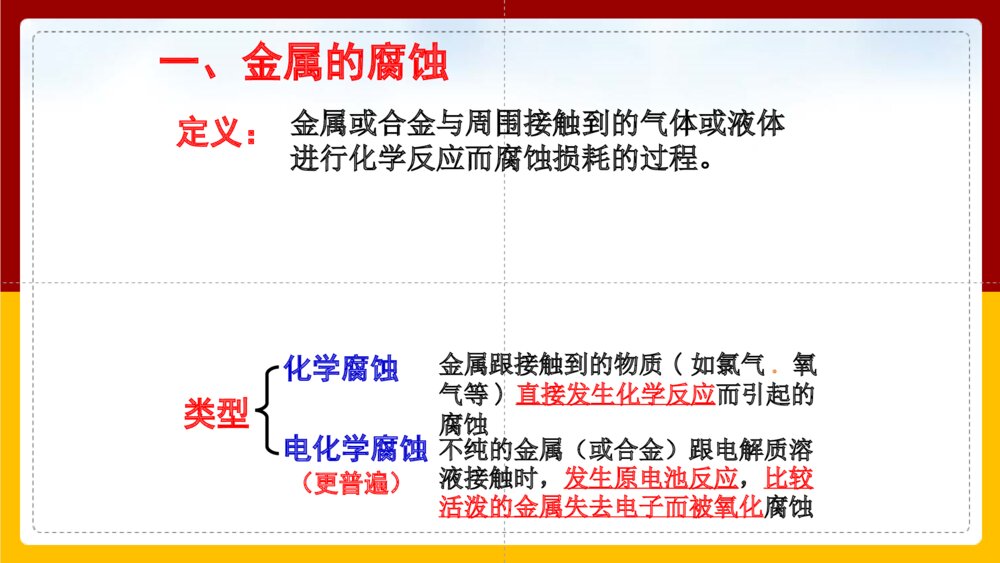
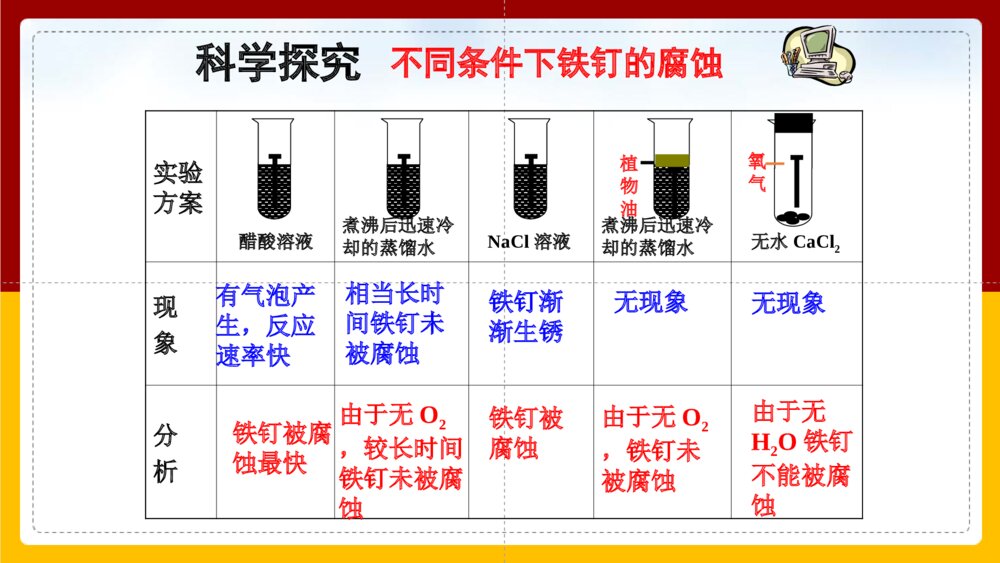
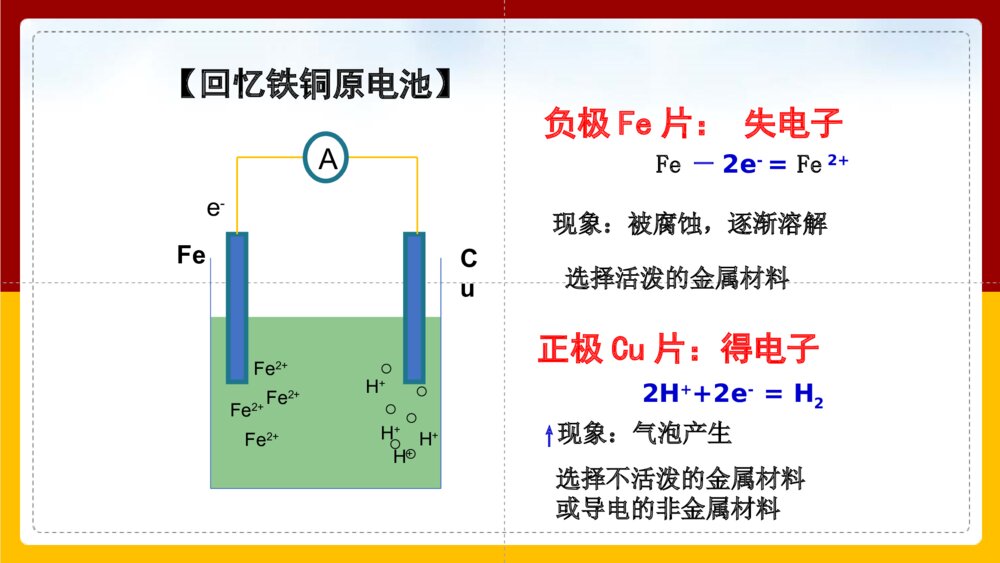
金属腐蚀的现象锈蚀的铜狮锈蚀的闸门锈蚀的轮船锈蚀的楼梯全球每分钟就有1吨钢腐蚀成铁锈.铁锈Fe2O3·XH2O铜绿Cu2(OH)2CO3金属的腐蚀对国民经济带来的损失是惊人的,统计报告,全世界每年由于腐蚀而报废的金属设备和材料,约相当于金属年产量的1/3。 全世界每年因金属腐蚀造成的直接经济损失约达70000亿美元,约占各国国内生产总值(GDP)的2%~4%,是地震、水灾、台风等自然灾害造成损失总和的6倍,至于因设备腐蚀损坏而引起的停工减产、产品质量下降、污染环境、危害人体健康甚至造成严重事故的损失,就更无法估计了。金属腐蚀的危害金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。类型化学腐蚀电化学腐蚀定义:金属跟接触到的物质(如氯气.氧气等)直接发生化学反应而引起的腐蚀不纯的金属(或合金)跟电解质溶液接触时,发生原电池反应,比较活泼的金属失去电子而被氧化腐蚀(更普遍)一、金属的腐蚀金属跟接触到的物质(如O2、CI2、SO2等)直接发生化学反应而引起的腐蚀。1、化学腐蚀(2)原理:(1)定义:(3)影响因素:金属跟氧化剂直接发生氧化还原反应。金属的活泼性---内因金属越活泼,越易被腐蚀;金属所处的环境温度越高,腐蚀速率越快;氧化剂浓度越大,腐蚀速率越快。家用燃气灶放在南极已差不多90年食品罐头一般情况下,温度的升高会加快化学反应速率。因此,温度对化学腐蚀的影响较明显。实验方案煮沸后迅速冷却的蒸馏水煮沸后迅速冷却的蒸馏水现象分析有气泡产生,反应速率快相当长时间铁钉未被腐蚀铁钉被腐蚀最快由于无O2,较长时间铁钉未被腐蚀铁钉渐渐生锈铁钉被腐蚀无现象由于无O2,铁钉未被腐蚀无现象由于无H2O铁钉不能被腐蚀植物油NaCl溶液醋酸溶液无水CaCl2氧气科学探究不同条件下铁钉的腐蚀铁生锈的必需条件:空气+水加速铁生锈的条件:空气+电解质溶液铁钉遇到酸或有O2、H2O存在的情况下,铁均可被腐蚀,遇到电解质时,一般腐蚀速率更快。结论:在新疆吐鲁番和海南省两地,哪个地区铁生锈相对慢一些?为什么?新疆吐鲁番,因为该地区相对干燥,水分稀少,而海南地区潮湿多雨,温度高,易发生电化学腐蚀。2、电化学腐蚀不纯的金属(或合金)跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化。这种腐蚀叫做电化学腐蚀。AFe2+Fe2+Fe2+Fe2+H+H+H+H+e-FeCu【回忆铁铜原电池】负极Fe片:失电子Fe-2e-=Fe2+正极Cu片:得电子2H++2e-=H2↑现象:被腐蚀,逐渐溶解现象:气泡产生选择活泼的金属材料选择不活泼的金属材料或导电的非金属材料在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜。水能电离出少量的H+和OH-,同时由于空气中CO2的溶解,使水里的H+增多:H2O+CO2H2CO3H++HCO3-这样在钢铁表面形成了一层电解质溶液的薄膜,它跟钢铁里的铁和少量的碳构成无数微小的原电池。FeCFe2+Fe2+Fe2+Fe2+e-O2H2OH2OOH-OH-OH-OH-O2、H2OFe(OH)3Fe2O3·XH2O钢铁在酸性极弱或中性条件下的腐蚀情况Fe–2e-==Fe2+2H2O+O2+4e-==4OH-——吸氧腐蚀2Fe+2H2O+O2=2Fe(OH)2正极:负极:总反应:FeCH+H+H+H+H+H+Fe2+Fe2+Fe2+Fe2+e-钢铁在酸性条件下的腐蚀情况正极:负极:——析氢腐蚀Fe–2e-==Fe2+2H++2e-==H2↑总反应:Fe+2H+=Fe2++H2↑钢铁的析氢腐蚀和吸氧腐蚀比较钢铁的析氢腐蚀和吸氧腐蚀比较Fe2O3·nH2O(铁锈)水膜呈酸性水膜呈中性或酸性很弱Fe-2e-=Fe2+2Fe-4e-=2Fe2+2H++2e-=H2↑O2+2H2O+4e-=4OH-Fe+2H2O=Fe(OH)2+H2↑2Fe+2H2O+O2=2Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3金属的腐蚀以电化腐蚀为主,电化腐蚀又以吸氧腐蚀为主(pH≥5.6时)若pH<5.6时则为析氢腐蚀。析氢腐蚀吸氧腐蚀条件电极反应负极Fe(-)正极C(+)总反应联系金属腐蚀的实质金属的腐蚀种类原理区别腐蚀速度联系金属的化学腐蚀与电化学腐蚀比较金属原子失去电子被氧化而消耗的过程: M-ne-=Mn+化学腐蚀电化学腐蚀金属和其它物质直接接触发生氧化还原反应而引起的腐蚀不纯金属或合金发生原电池反应,使较活泼的金属失电子被氧化而引起的腐蚀直接发生氧化还原反应发生原电池反应腐蚀过程无电流产生有电流产生金属直接被腐蚀较活泼金属被腐蚀电化学腐蚀>化学腐蚀往往同时发生,但电化学腐蚀更普遍,危害更大化学腐蚀和电化学腐蚀都是铁等金属原子失去电子变成阳离子的过程。也就是说,金属在腐蚀过程中,发生了氧化还原反应。总结:金属腐蚀的本质影响金属腐蚀的因素:1、金属的本性:金属越活泼,就越容易失去电子而被腐蚀。2、介质:(通常指气体或液体)金属直接接触的环境条件,腐蚀性气体或电解质溶液都容易导致金属被腐蚀金属阳离子失e-氧化还原反应金属原子烤蓝涂机油烤漆涂凡士林镀锌镀铬[[交流研讨交流研讨]]你知道自行车的金属部件采用了什么样的防护措施吗?请根据生活常识以及下图总结金属防护常用的方法,并解释这些方法为什么可以达到防止金属腐蚀的目的。健身器材刷油漆健身器材刷油漆衣架和电线的外面包上一层塑料层衣架和电线的外面包上一层塑料层某些工具的“机械转动部位”涂某些工具的“机械转动部位”涂油脂(机油),为什么不能用油油脂(机油),为什么不能用油漆漆自行车的钢圈和车铃是在钢上镀上一层既耐腐蚀又耐磨的Cr用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块必须定期更换制成不锈钢,在金属表面镀一层比要保护的金属更活泼的金属。用牺牲锌块的方法来保护船身,锌块必须定期更换锌块牺牲阳极的阴极保护法.外加电流的阴极保护法通电后,电子被强制流向被保护的钢铁设备,抑制钢铁发生失电子作用,从而被保护常用于防止土壤、海水及河水中的金属设备的腐蚀。总结:金属防护的常用方法(1)在金属表面覆盖保护层:a.涂矿物质油脂、油漆或覆盖搪瓷塑料.b.镀抗蚀金属-电镀、热镀、喷镀法.c.用化学方法使其表面形成一层致密氧化膜,如烤蓝.(2)改变金属内部组成结构而增强抗腐蚀能力,如制成不锈钢.(3)电化学保护法.a.牺牲阳极的阴极保护法.b.外加电流的阴极保护法.防腐措施由好到坏的顺序:外接电源的阴极保护法>牺牲阳极的阴极保护法>有一般防腐条件保护>无防腐条件—排除造成腐蚀的因素不会,因为月球上缺少水分和氧气。请你预测铁在月球上会不会生锈?为什么?为什么一块铜板上有铁铆钉时,铁钉更易生锈?铜板表面凝结一层水膜,空气中二氧化碳和二氧化硫等,沿海空气中的氯化钠等溶入其中形成电解质溶液。铜板(+)与铁铆钉(-)及电解质溶液便构成了原电池,相对活泼的铁被腐蚀。烧过菜的铁锅如果未及时洗净(残液中含NaCl),第二天便出现红棕色锈斑(主要成分为Fe2O3nH•2O)。请问这种腐蚀是化学腐蚀还是电化学腐蚀?为什么?解析:属于电化学腐蚀。因为铁锅是由生铁做成的,铁锅生锈是因为Fe-C-NaCl形成原电池。铁作负极,失去电子变成亚铁离子,从而被腐蚀。



















