






《高三化学一轮复习PPT课件下载(共30页)》是由用户上传到老师板报网,本为文库资料,大小为461.69 KB,总共有30页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 30页
- 461.69 KB
- VIP模板
- pptx
- 数字产品不支持退货
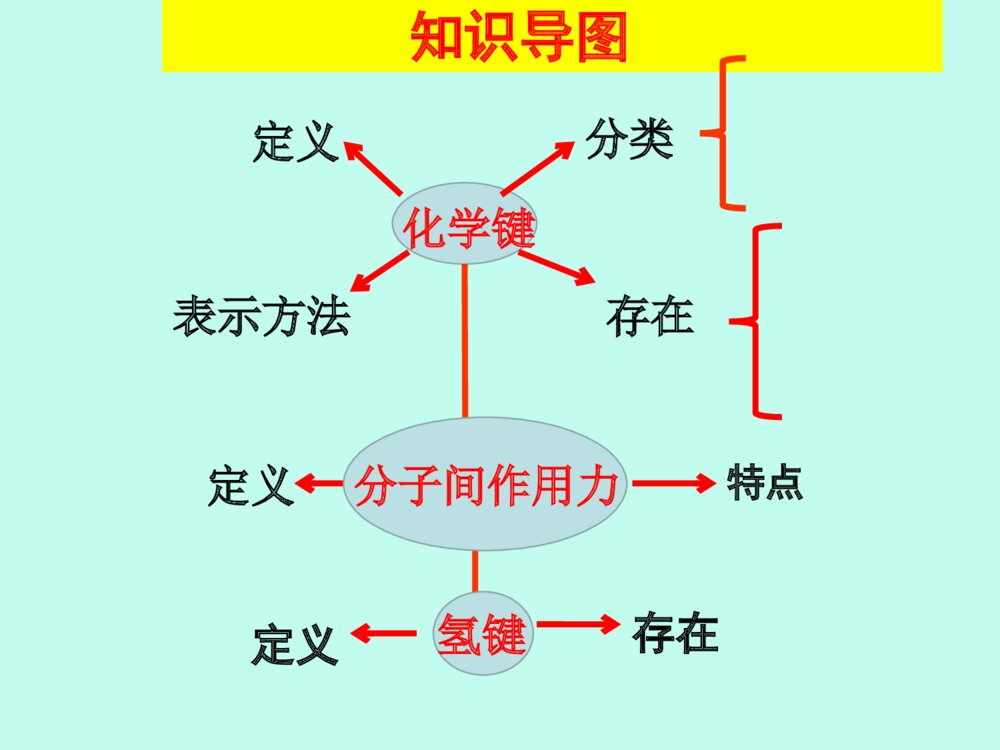
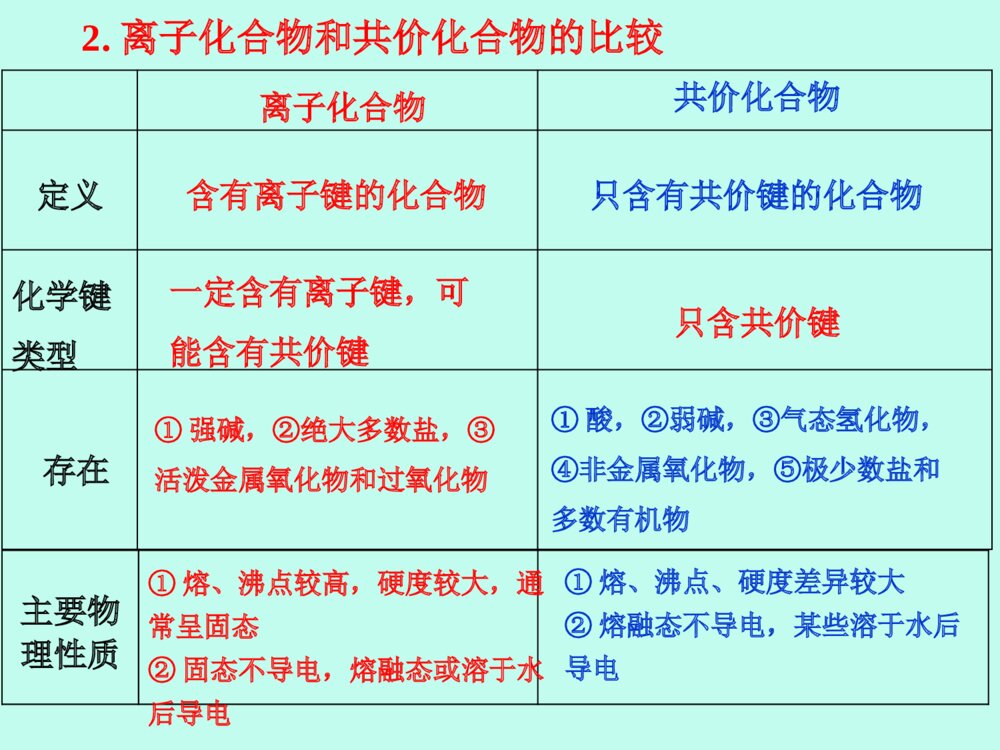
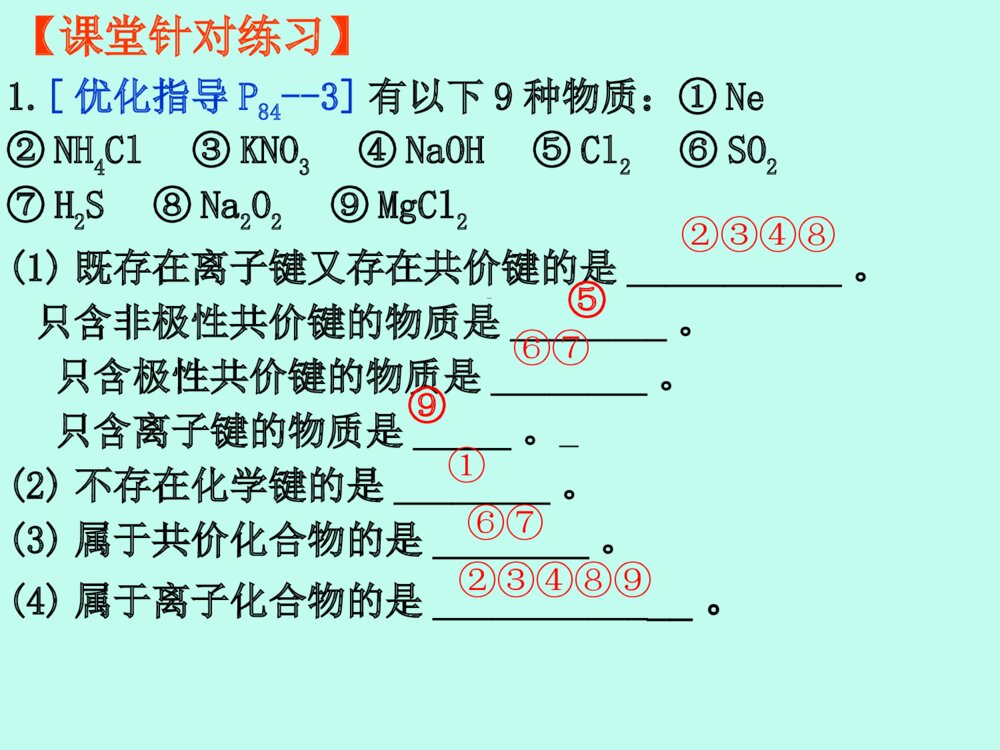
化学键高三化学备课组高三化学一轮复习:考纲要求1.了解化学键的定义。2.了解离子键、共价键的形成。3.了解离子化合物和共价化合物。4.了解化学键和分子间作用力的区别。5.了解氢键的存在对物质性质的影响。化学键定义知识导图分类表示方法存在定义特点定义存在分子间作用力氢键重难点突破考点一:离子键、共价键及其与物质类别的关系【考情分析】离子键、共价键的类型判断及其与物质类别的关系,是高考的必考内容,考查内容主要是物质所含化学键种类的判断,元素所形成化合物种类的判断。题目常与元素推断、元素周期律、元素周期表相结合,难度较小。[例1] (高考题组合)判断下列说法的正误(正确的打“√”,错误的打“×”)。①化合物HCl与NaCl含有相同类型的化学键。②NaHCO3、HCOONa均含有离子键和共价键。③H与O、H与N均可形成既含极性共价键又含非极性共价键的化合物。④非金属元素组成的化合物中只含共价键。⑤不同元素的原子构成的分子只含极性共价键。⑥常温下,4gCH4含有NA个C—H共价键。√×√××√【感悟高考】[例2] [优化指导P85-4](2015·课标全国Ⅱ,9)原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )•A.元素的非金属性次序为c>b>a•B.a和其他3种元素均能形成共价化合物•C.d和其他3种元素均能形成离子化合物•D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6B B1.离子键和共价键的比较 共价化合物、某些离子化合物非金属单质、某些共价化合物、某些离子化合物离子化合物存在不同种元素的原子同种元素的原子活泼金属元素和活泼非金属元素成键条件原子阴、阳离子成键粒子共用电子对偏向吸引电子能力强的原子一方共用电子对不发生偏移阴、阳离子间的静电作用特点极性键非极性键共价键离子键键型【要点归纳】2.离子化合物和共价化合物的比较①酸,②弱碱,③气态氢化物,④非金属氧化物,⑤极少数盐和多数有机物①强碱,②绝大多数盐,③活泼金属氧化物和过氧化物存在只含共价键一定含有离子键,可能含有共价键化学键类型只含有共价键的化合物含有离子键的化合物定义共价化合物离子化合物主要物理性质①熔、沸点较高,硬度较大,通常呈固态②固态不导电,熔融态或溶于水后导电①熔、沸点、硬度差异较大②熔融态不导电,某些溶于水后导电1.[优化指导P84--3]有以下9种物质:①Ne ②NH4Cl ③KNO3 ④NaOH ⑤Cl2 ⑥SO2 ⑦H2S ⑧Na2O2 ⑨MgCl2(1)既存在离子键又存在共价键的是___________。只含非极性共价键的物质是________。只含极性共价键的物质是________。只含离子键的物质是_____。(2)不存在化学键的是________。(3)属于共价化合物的是________。(4)属于离子化合物的是_____________。②③④⑧①⑥⑦②③④⑧①⑥⑦②③④⑧⑨⑤⑥⑦⑨【课堂针对练习】2.[优化指导P84--4](2016·上海奉贤一模)下列有关物质结构的叙述正确的是( )•A.在离子化合物中不可能存在非极性共价键•B.由电子定向移动而导电的物质一定是金属晶体•C.有键能很大的共价键存在的物质的熔沸点一定很高•D.只含有共价键的物质不一定是共价化合物D 解析:含有离子键的化合物是离子化合物,离子化合物中可能含有极性键或非极性键,如Na2O2,故A错误;多数物质导电都是靠电子定向移动的,不仅仅是金属,还包括石墨等,故B错误;分子晶体的熔沸点高低取决于分子间作用力的大小,与共价键的强弱无关,故C错误;只含共价键的物质不一定是共价化合物,可能是多原子单质,如臭氧等,故D正确。D•[方法指导]离子化合物、共价化合物的判断方法3.[优化指导P84--1](2017·延安调研)在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )A.将SO2通入水中 B.烧碱溶于水C.将HCl通入水中 D.硫酸氢钠溶于水D 4.[优化指导P84--2]从化学键的观点看,化学反应的实质是“旧键的断裂和新键的形成”,据此你认为下列属于化学变化的是( )①对空气进行降温加压 ②金刚石变成石墨 ③NaCl熔化 ④碘溶于CCl4中 ⑤HCl溶于水电离出H+和Cl- ⑥电解熔融的Al2O3制取AlA.②③⑤ B.②⑤⑥C.②⑥ D.②③⑤⑥CDD 【要点归纳】3.物质变化与化学键的关系(1)一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。(2)有化学键被破坏的变化不一定是化学变化,如HCl溶于水、NaCl晶体熔化.(3)许多非金属单质和许多共价化合物在熔化时并不破坏共价键,如O2、HCl、CO2、H2O等.例1:(2017·四川四市联考题)下列解释正确的是( )A.H2O很稳定,是因为水分子之间存在氢键B.HF的熔、沸点在同族元素的氢化物中出现反常,是因为HF分子中有氢键C.卤素单质从上到下熔沸点升高,是因为它们的组成结构相似,从上到下其摩尔质量增大,分子间的范德华力增大D.氨气极易溶于水,与氢键没有关系C考点二:化学键、分子间作用力和氢键的对比【思维建模】化学键、分子间作用力和氢键的对比相互作用化学键分子间作用力氢键存在范围分子内相邻原子(离子)之间分子之间含H—F、O—H、N—H键的分子之间作用力比较强很弱比化学键弱,比分子间作用力强影响范围物质的物理性质及化学性质物质的物理性质物质的物理性质对物质性质的影响①离子键:成键离子半径越小、离子所带电荷越多、离子键越强,离子化合物的熔、沸点越高;②共价键:原子半径越小,共用电子对越多,共价键越强,单质或化合物的稳定性越强①影响物质的熔沸点、溶解度等物理性质;②组成和结构相似的分子,随着相对分子质量的增大,物质的熔、沸点逐渐升高分子间氢键的存在使物质的熔、沸点升高,在水中的溶解度增大,如熔、沸点:H2O>H2S,HF>HCl;乙醇与水混溶1.下列各组物质发生状态变化时所克服的微粒间的互相作用属于同种类型的是()A食盐和蔗糖熔化B钠和硫的熔化C碘和干冰的升华D二氧化硅和氧化钠熔化C2.下列过程中,共价键被破坏的是()A.碘升华B.溴蒸气被木炭吸附C.蔗糖溶于水D.氯化氢气体溶于水D【课堂针对练习】3.(2017全国理综III)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是()A.氢化物沸点:B.氧化物对应水化物的酸性:C.化合物熔点:D.简单离子的半径:233YXYZDWWYWY



















