





《《硫的转化》高一化学教案PPT课件》是由用户上传到老师板报网,本为文库资料,大小为1.63 MB,总共有45页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 45页
- 1.63 MB
- VIP模板
- ppt
- 数字产品不支持退货
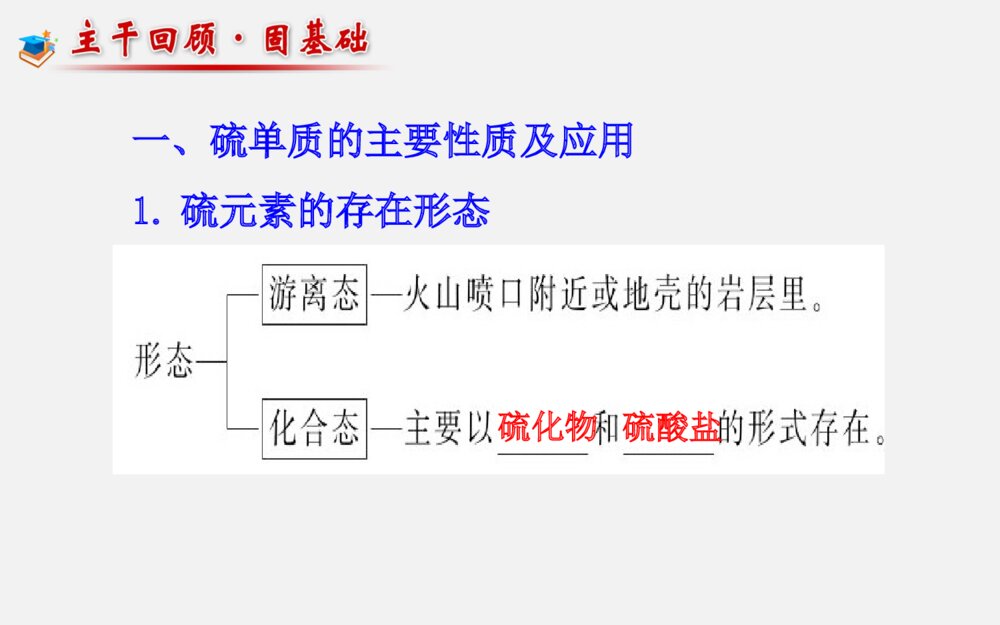
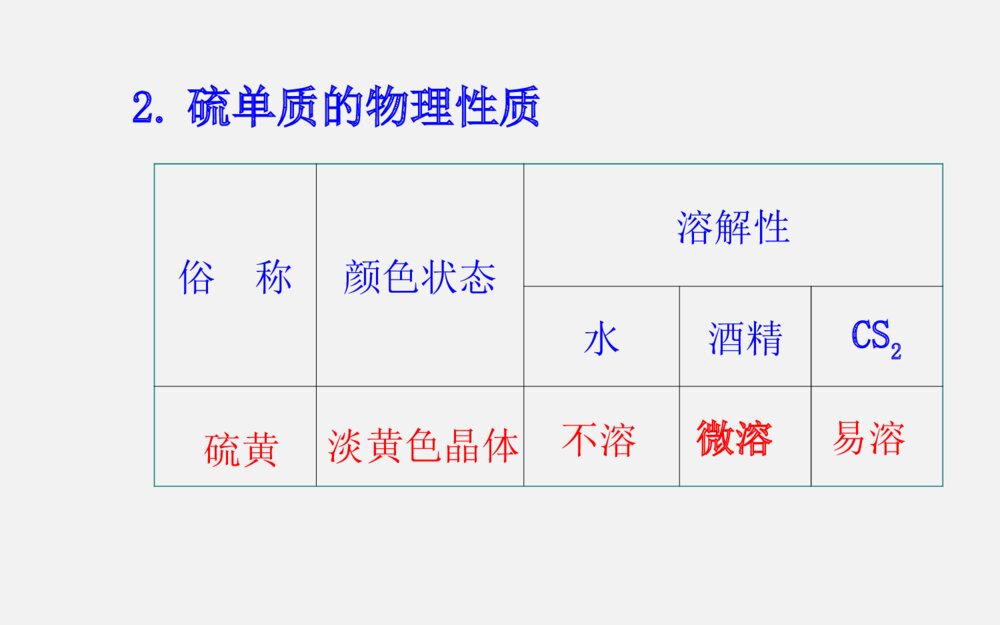
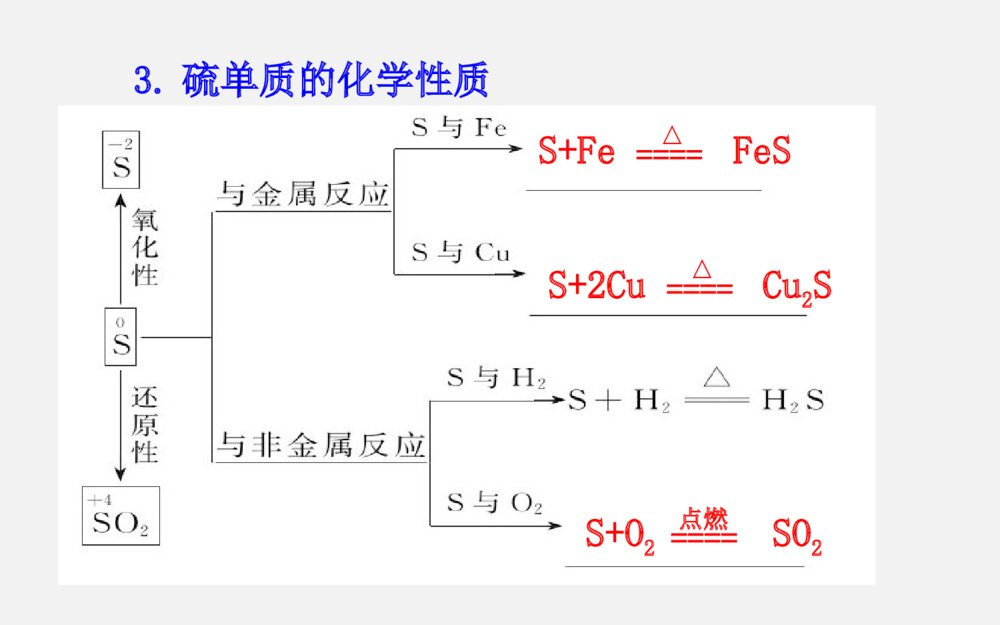
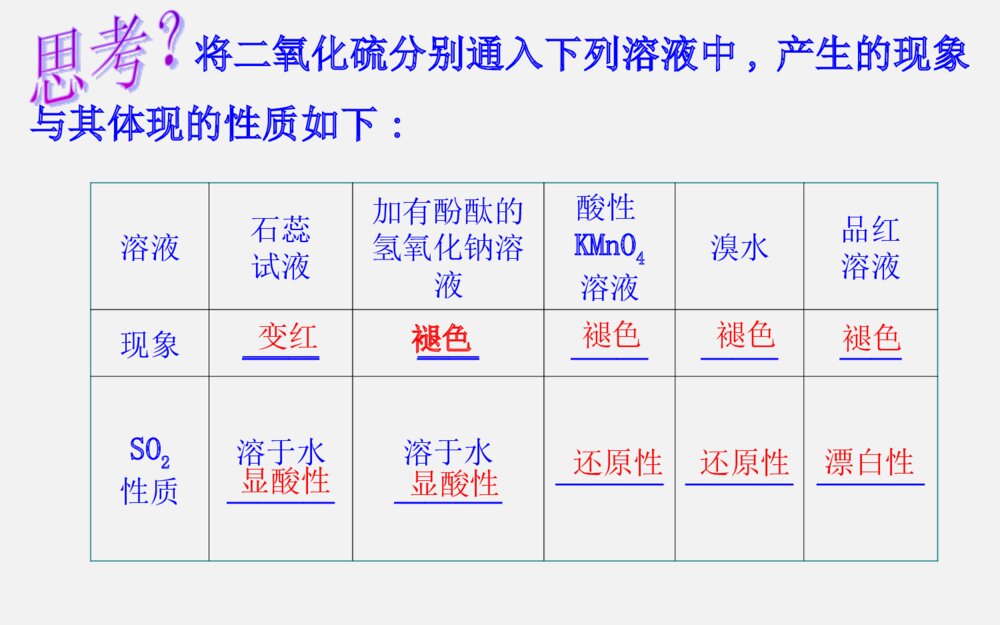
第三章第3节 硫的转化考纲展示考点关注(1)SO2还原性的应用。如CO2、SO2的鉴别、酸雨的防治等(2)含硫化合物之间的相互转化关系(3)浓硫酸的特性、SO42-的检验三年13考高考指数★★★★★(1)了解硫单质及其重要化合物的主要性质及应用(2)了解硫单质及其重要化合物对环境质量的影响命题趋势1、热点预测:由于硫元素的多种价态及各种价态化合物的相互转化内容丰富,也是氧化还原反应的重要素材,命题空间广阔,而且与生产、生活及社会联系紧密,预计该专题仍是2014年考查元素化合物的热点,题型延续选择题及填空题形式。2、趋势分析:预计2014年继续通过工业生产流程题、实验题等形式进行考查,可能会出现实验设计探究题,考查中学教材中未学过的某些硫的化合物的制备及性质,考生应予以高度重视。一、硫单质的主要性质及应用1.硫元素的存在形态硫化物硫酸盐2.硫单质的物理性质 俗称颜色状态溶解性水酒精CS2硫黄淡黄色晶体不溶易溶微溶3.硫单质的化学性质S+FeFeSS+2CuCu2SS+O2SO2点燃====△====△====单质硫还可与强碱溶液发生反应:3S+6OH-2S2-+SO32-+3H2O应用:可用于洗涤附着在试管内壁上的硫====△二、硫的氧化物的性质及其应用1.(1)物理性质:颜色气味毒性密度溶解性比空气无色刺激性有毒大易溶于水(2)化学性质:SO2+2NaOH====Na2SO3+H2OSO2+NaOH====NaHSO3品红SO2+2H2O+Cl2====H2SO4+2HCl△催化剂2SO2+O22SO3====加热时,红色褪去将二氧化硫分别通入下列溶液中,产生的现象与其体现的性质如下:溶液石蕊试液加有酚酞的氢氧化钠溶液酸性KMnO4溶液溴水品红溶液现象_______________________SO2性质溶于水_______溶于水____________________________变红褪色褪色显酸性显酸性还原性还原性漂白性褪色褪色2.实验室制法3.SO2对大气的污染与防治:①来源:化石燃料的燃烧及含硫矿石的冶炼。②危害:污染大气,危害人体健康,形成酸雨(pH<5.6)。形成酸雨的反应过程③防治:开发新能源、燃煤除硫、处理工业废气。Na2SO3+H2SO4===Na2SO4+SO2↑+H2O2.三氧化硫(1)SO3的物理性质:熔点16.8℃,沸点44.8℃,在常温下为_____,在标准状况下为_____。(2)SO3的化学性质:具有酸性氧化物的通性。①与水反应:_______________(放出大量的热)②与氧化钙反应:________________③与氢氧化钠反应:______________________液态固态SO3+H2O====H2SO4SO3+CaO====CaSO4SO3+2NaOH====Na2SO4+H2O三、硫酸的性质及SO42-离子的检验1.硫酸的物理性质(1)浓硫酸为无色、黏稠的油状液体,难挥发。能以任意比与水互溶,稀释浓硫酸的方法是:____________________________________。(2)浓硫酸对人体皮肤有强烈的腐蚀作用。如果不慎在皮肤上沾上少量浓硫酸时,处理方法是:____________________________________________。将浓硫酸沿器壁慢慢注入水中并不断搅拌立即用大量水冲洗,然后涂上3%~5%的NaHCO3溶液2.硫酸的化学性质(1)稀硫酸具有酸的通性:硫酸是一种二元强酸,在水溶液中的电离方程式为____________________,能与酸碱指示剂、金属、碱性氧化物、碱、盐等物质发生反应。2244HSO====2HSO(2)浓硫酸的特性:NH3、H2S、HI钝化Cu+2H2SO4(浓)CuSO4+SO2↑+2H2OC+2H2SO4(浓)CO2↑+2SO2↑+2H2O△====△====(3)SO2-4的检验(1)检验SO2-4时要防止其他离子的干扰:①Ag+干扰:先用盐酸酸化,能防止Ag+干扰,因为Ag++Cl-===AgCl↓。②CO2-3、SO2-3干扰:因为BaCO3、BaSO3也是白色沉淀,与BaSO4白色沉淀所不同的是这些沉淀能溶于强酸中。因此检验SO2-4时,必须用酸酸化(不能用HNO3、H2SO4酸化)。所用钡盐不能用Ba(NO3)2溶液,因为在酸性条件下,SO2-3、HSO-3、SO2等会被溶液中的NO-3氧化为SO2-4,从而得出错误的结论。(3)SO42-离子的检验待测液盐酸酸化取清液滴加BaCl2溶液若产生白色沉淀,则证明有SO42-,否则无。3.硫酸的用途(1)制取化肥,如磷肥、氮肥等。(2)清除金属表面的氧化物。(3)制取挥发性酸。(4)用于精炼石油,制造炸药、农药等。(5)是实验室里常用的试剂。1.(2011·山东高考)要清洗附着在试管壁上的硫,可用的试剂是CS2或热的碱液。()2.(2012·江苏高考)SO2具有氧化性,可用于漂白纸浆。()3.(2012·江苏高考)向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液出现白色沉淀,证明溶液X中一定含有SO42-()4.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫。()5.(2012·山东卷)Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性( )×√×××6.浓硫酸与稀硫酸都可以利用铁制容器贮存.()7.将SO2通入BaCl2溶液中有白色沉淀生成。 ()8.浓硫酸具有强氧化性,SO2具有强还原性,故浓硫酸不能用来干燥SO2 。()9.用澄清石灰水可以鉴别CO2和SO2 。()10.浓硫酸与铁加热反应后,铁片有剩余,生成的气体除SO2、水蒸气外还有H2.()×√×××考点1硫的转化1.硫元素的化合价与氧化性、还原性之间的关系硫及其化合物的转化关系图2.硫及其化合物之间的转换规律(1)不同价态的硫是通过氧化还原反应规律联系的,相同价态的硫是通过酸碱反应规律联系的。(2)当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降,如(3)相邻价态的粒子不发生氧化还原反应:如S和H2S、S和SO2、SO2和浓硫酸之间不发生氧化还原反应。(4)当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态,如2H2S+SO2====3S↓+2H2O2Na2S+Na2SO3+3H2SO4====3Na2SO4+3S↓+3H2O(5)含硫物质的连续氧化:【高考警示】(1)除硫元素以外中学阶段常见的符合ABCD转化关系的还有:氮元素:N2NONO2HNO3钠元素:NaNa2ONa2O2NaOH碳元素:CCOCO2H2CO3在实际解题中要注意区分。2O2HO2O2HO2HO2HO2O2O2O2O2O2O(2)S2-和SO32-可共存,只有在酸性环境中才发生反应:2S2-+SO32-+6H+====3S↓+3H2O(3)含+6价硫的化合物不一定都有强氧化性,如浓硫酸具有氧化性,而稀硫酸、硫酸盐中的硫元素均不表现氧化性。(4)验证+4价硫(SO2、SO32-)的氧化性时,只能利用-2价硫作为还原剂。【针对训练】1、(2013·天津模拟)能实现下列物质间直接转化的元素是( )单质氧化物酸或碱A. 硅B. 硫C.铜 D.铁2O2HONaOHHCl或盐B考点2二氧化硫和二氧化碳性质的比较和鉴别SO2CO2物理性质颜色气味毒性溶解性无色、有刺激性气味易溶(体积比1∶40)可溶(体积比1∶1)有毒无毒无色、无味考点2二氧化硫和二氧化碳性质的比较和鉴别SO2CO2酸性氧化物弱氧化性还原性漂白性对环境的影响鉴别3.鉴别SO2和CO2的方法通常可用以下方法:(1)用品红溶液:使品红溶液褪色的是SO2;不能使品红溶液褪色的是CO2。(2)用氢硫酸。出现浑浊的是SO2;无明显现象的是CO2。2H2S+SO2===2H2O+3S↓(3)用高锰酸钾溶液。使紫色褪去的是SO2;无明显现象的是CO2。2KMnO4+5SO2+2H2O===K2SO4+2MnSO4+2H2SO4(4)用溴水。使橙色褪去的是SO2;无明显现象的是CO2。Br2+2H2O+SO2===2HBr+H2SO4(5)用硝酸酸化的硝酸钡溶液。产生白色沉淀的是SO2;无明显现象的是CO2。(6)用FeCl3溶液。使棕黄色颜色变浅的是SO2;无明显现象的是CO2。2FeCl3+SO2+2H2O===FeCl2+FeSO4+4HCl 【针对训练】2、下列实验中能证明某气体为SO2的是( )①使澄清石灰水变浑浊 ②使湿润的蓝色石蕊试纸变红 ③使品红溶液退色 ④通入足量NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入溴水中,能使溴水退色,再滴加Ba(NO3)2溶液有白色沉淀产生A.都能证明 B.都不能证明C.③④⑤均能证明D.只有⑤能证明D3.下列化学实验事实及其解释都正确的是( ) A.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸 B.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 C.SO2具有还原性,故可作漂白剂 D.将SO2通入品红溶液中,溶液退色后加热恢复原色,将SO2通入溴水中,溴水退色后加热不能恢复原色D【精讲点拨】(1)CO2中的碳元素处于最高价,因而只具有氧化性(CO2→CO,CO2→C)。SO2中的硫元素处于中间价态,因而既具有氧化性,又具有还原性。(2)除去CO2中的SO2气体,可将混合气体通入酸性KMnO4溶液或溴水中,也可通入饱和的NaHCO3溶液(H2SO3的酸性大于H2CO3)。(3)不能用澄清石灰水鉴别CO2和SO2,因为二者均能使澄清石灰水变浑浊。【变式训练 】(2013·三明模拟)下列溶液能够区别SO2和CO2气体的是( )①澄清石灰水 ②H2S溶液③酸性KMnO4溶液 ④氯水⑤品红溶液A.①②③B.②③④C.除①以外D.全部C1.下列措施不可能改善空气质量的是( )A.在大型燃煤锅炉上安装低氮燃烧器,采用烟气脱硝技术B.加强道路扬尘污染控制,强化路面保洁,洒水防尘C.在炼油厂、钢铁厂、发电厂等推广和使用脱硫技术,降低硫氧化物的排放D.增加汽油、柴油等能源的供应量,提倡以汽车代步的现代消费与生活理念D2.(2013·太原模拟)下列五种有色溶液与SO2作用均能褪色,其实质相同的是( )①品红溶液;②酸性KMnO4溶液;③溴水;④滴有酚酞的NaOH溶液;⑤含I2的淀粉溶液A.①④ B.①②③ C.②③⑤ D.③④C3.在某溶液中加入BaCl2溶液,生成白色沉淀,加入稀硝酸,沉淀不溶解,则下列关于该溶液所含离子的推断中正确的是()A.一定含有B.含有和Ag+C.可能含有或Ag+或或同时含有和D.可能含有或23CO23SO24SO24SO24SO24SO23SO23SOC5.(2013·深圳模拟)如图是实验室制取SO2并验证SO2某些性质的装置图,试回答:(1)⑥中发生的化学反应方程式为__________________________________________。(2)①中实验现象为_________,证明SO2是__________气体。(3)②中品红溶液 ,证明SO2有 性。(4)③中现象是__________,证明SO2有 性。(5)④中现象是______________,证明SO2有 性。(6)⑤的作用是_________,反应的化学方程式为________________________________________________。【解析】本实验要制取SO2并验证SO2某些性质,所以⑥中发生的为Na2SO3和浓硫酸制取SO2的化学反应。SO2有酸性,能使石蕊试液变红;SO2有漂白性,能使品红溶液褪色;SO2有氧化性,使H2S溶液中出现淡黄色浑浊;SO2有还原性,使碘水褪色;SO2有毒,不能直接排放到空气中。答案:(1)Na2SO3+H2SO4(浓)====Na2SO4+SO2↑+H2O(2)石蕊试液变红 酸性 (3)褪色 漂白 (4)出现淡黄色浑浊 氧化 (5)褪色 还原 (6)吸收多余的SO2,防止污染空气 2NaOH+SO2====Na2SO3+H2O1.(2012·广东高考)下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )选项陈述Ⅰ陈述ⅡASO2有漂白性SO2可使溴水褪色BSiO2有导电性SiO2可用于制备光导纤维C浓硫酸有强氧化性浓硫酸可用于干燥H2和CODFe3+有氧化性FeCl3溶液可用于回收废旧电路板中的铜D2.(2012·山东高考)下列由相关实验现象所推出的结论正确的是( )A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者易溶于水24SOD【反思提升】硫元素在高考中的考查主要涉及如下几个方面:1.与环境保护、绿色化学相联系,以SO2对环境的影响,进一步考查环境污染以及食品安全等社会生活问题。这类问题一般比较简单,比如酸雨的形成和防治可直接根据SO2的性质回答。2.硫及其化合物的综合考查。本部分为元素化合物的重要组成部分,命题中会以各种题型对硫及其化合物之间的转化以及含硫化合物如SO2和H2SO4的性质进行考查。解答此类问题要善于运用比较的方法,通过对两个或两类不同的对象进行比较,找出其相似点或不同点,然后以此为依据分析解决问题。比如SO2漂白性问题的比较、浓稀硫酸不同性质的比较等。3.硫元素知识和简单工艺流程分析或与图表或实验装置等相结合考查。这一类题目通常是将教材重点反应经过精心包装,重新登陆高考。其考查的基本点在于元素及其化合物性质,所以熟练掌握相关反应是破解很多化学题目的关键。因此,掌握教材基本内容,自己尽可能对教材相关反应或通过相关反应来分析对应的实验现象,对教材重点反应,特别是与化工相关的反应或习题进行分析加工是提升学习与得分能力的基础。



















