







《《化学电源·电池原理及制造技术》中南大学课件PPT下载》是由用户上传到老师板报网,本为文库资料,大小为2.3 MB,总共有51页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 51页
- 2.3 MB
- VIP模板
- ppt
- 数字产品不支持退货
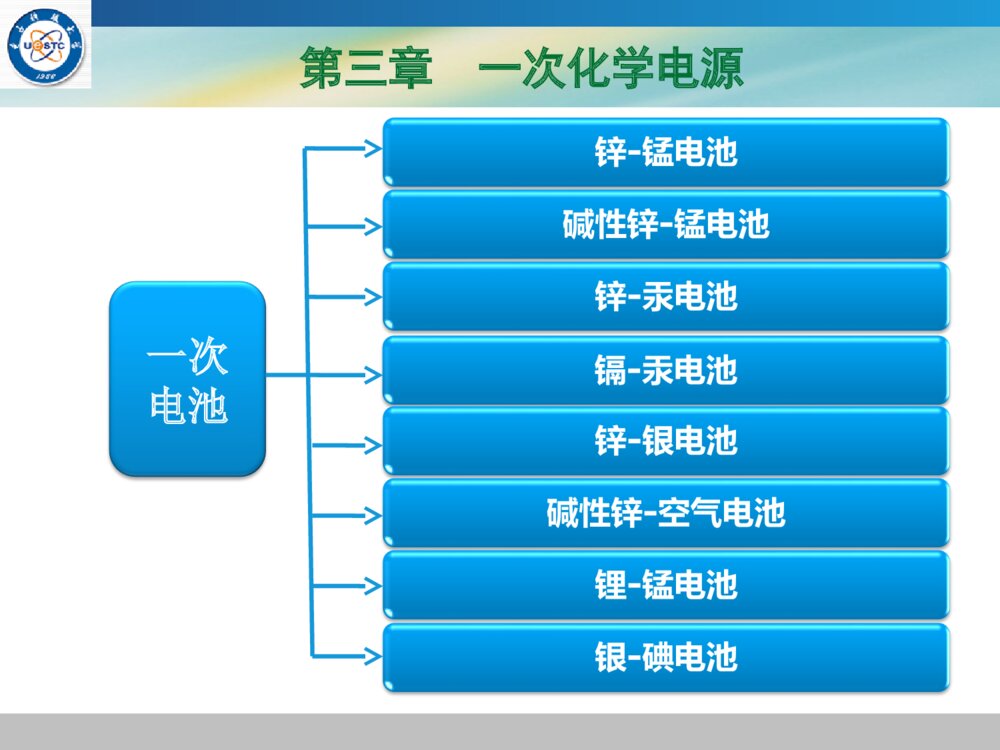
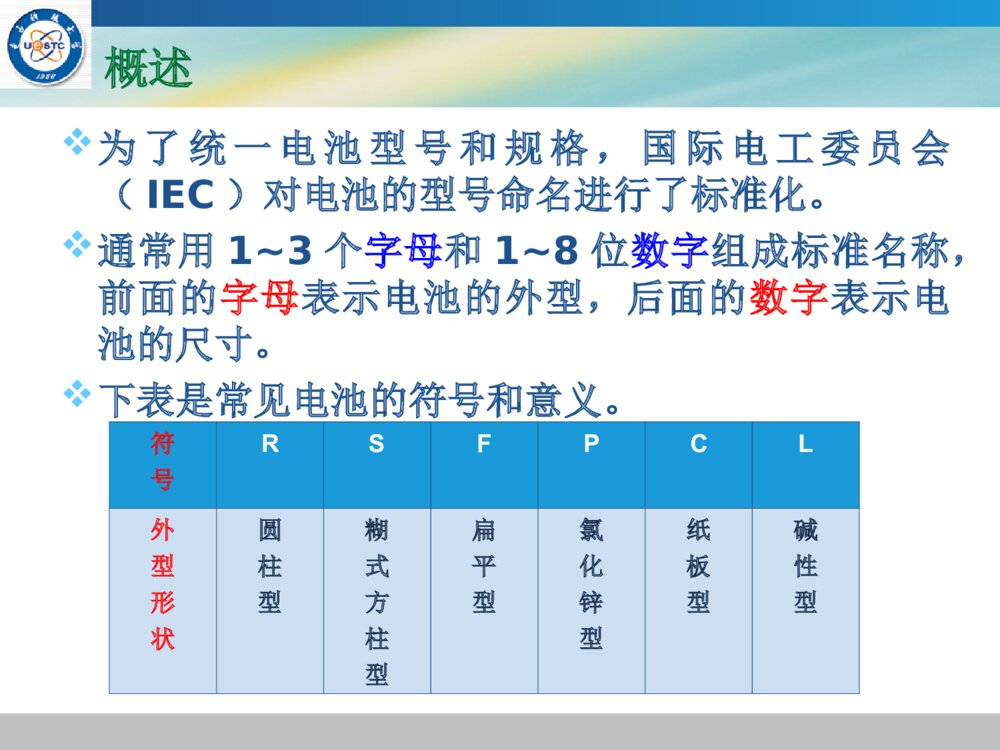
LOGO《《化学电源化学电源》》——电池原理及制造技术电池原理及制造技术郭炳焜,李新海,杨松青编著中南大学出版社(2009)第三章一次化学电源第三章一次化学电源一次电池概述一次电池由于使用方便,价格便宜,因此,一次电池的使用量非常巨大,但同时也给环境造成了很大的压力和危害。在二次电池技术日益成熟的今天,一次电池将越来越被环保性好、性能更优异的二次电池所取代。概述1859年,R.G.Plante首先发明了铅酸蓄电池,距今已经有近150余年的历史了。在近10年后的1868年,法国科学家G.Leclance又第一个发明了锌锰干电池。所谓干电池,是指在电池体系当中的电解质不能流动,如胶态状、糊状,凝胶状电解质等,锌锰电池中的NH4Cl+ZnCl2就是不能流动的淀粉型糊状电解质,所以叫做锌锰干电池。1882年,德国G.Leuchs又率先采用浓KOH溶液代替NH4Cl+ZnCl2作为锌锰电池的电解质,从而发明了碱性锌锰电池。概述巴格达电池莱顿瓶伏打电堆早期锌锰电池G.Leclance(1839-1882)概述但是经过了许多年以后,于1965年才开始进行这种碱性锌锰电池的工业化生产。国内是在20世纪70年代末期才开始生产碱性锌锰电池。概述为了统一电池型号和规格,国际电工委员会(IEC)对电池的型号命名进行了标准化。通常用1~3个字母和1~8位数字组成标准名称,前面的字母表示电池的外型,后面的数字表示电池的尺寸。下表是常见电池的符号和意义。符号RSFPCL外型形状圆柱型糊式方柱型扁平型氯化锌型纸板型碱性型概述根据上表,LR表示碱性圆柱型电池。LR14500(AA型电池),就是通常指的5号碱性圆柱型电池。此外,各个国家还有自己的表示方法。如中国有0~7号电池(数字越小,电池体积越大),此外还有特殊用途的异型电池。美国有AA型(5#),AAA型(7#)等。锌锰电池筒式锌锰电池一般分为四大类:1.G.Leclance锌锰电池2.纸板电池3.碱性锌锰电池4.无汞锌锰电池重点介绍G.Leclance锌锰电池和碱性锌锰电池两类。筒式锌锰电池结构锌锰电池G.Leclance锌锰电池:这是最经典的干电池,其电解质是不能流动的淀粉浆糊状NH4Cl+ZnCl2,其电化学表达式为:(-)Zn∣NH4Cl+ZnCl2∣MnO2(+)这种电池所使用的锌筒既充当外壳,又起着负极的作用,但这种电池的性能很差,现已被淘汰。电池放电时的电极反应式为:负极:Zn+2NH4Cl-2e-→Zn(NH3)2Cl2+2H+正极:2MnO2+2H++2e-→2MnOOH锌锰电池电池的总反应式为:Zn+2MnO2+2NH4Cl→2MnOOH+Zn(NH3)2Cl2碱性锌锰电池:电化学表达式:(-)Zn∣KOH∣MnO2(+)电池放电时的电极反应式为:负极:Zn+2OH--2e-→Zn(OH)2↓→ZnO↓+H2O正极:2MnO2+2H2O+2e-→2MnOOH+2OH-电池放电时的总反应式为:Zn+2MnO2+2H2O→2MnOOH+ZnO锌锰电池纸板电池:(-)Zn∣ZnCl2∣MnO2(+)纸板电池的隔膜和电解质与Leclance锌锰电池的都不同。纸板电池是纸板浆层隔膜,其电解质为ZnCl2。碱性锌锰电池的负极为汞齐化锌粉,该类电池的性能非常好,其放电时间是糊式锌锰电池(Leclance锌锰电池)的5~7倍。其它电池的锌负极也是一样。使用锌汞齐的目的是:为了降低电池的内部极化,提高析氢过电位,从而减小锌负极的腐蚀,延长电极的寿命。添加金属汞不仅使电池内部极化降低,极化电阻减小,还能够提高电池的输出电压。锌锰电池在碱性锌锰电池中,负极采用锌汞齐的粉末,是因为汞可以提高锌负极中的析氢过电位,从而减少负极锌的腐蚀。因此汞又被称为“缓蚀剂”。如果将锌锰电池的汞齐化锌粉换成纯锌粉,就变成了无汞碱性锌锰电池(0%Hg)。因为汞具有良好的去极化作用,能够提高析氢过电位,所以完全无汞目前还难以做到。但是现在可以选用替代物来实现无汞化。但是由于环保的要求,电池完全无汞化将是必然的趋势。锌锰电池锌锰电池的工作原理二氧化锰(MnO2)电极:初级过程和次级过程初级过程/反应:MnO2还原为MnOOH有H2O时:MnO2+H2O+e-→MnOOH+OH-有NH4Cl时:MnO2+NH4Cl+e-→MnOOH+NH3+Cl-次级过程/反应:MnOOH进一步还原为Mn(OH)2有H+时:2MnOOH+2H+→MnO2+Mn2++2H2O有H2O时:MnOOH+H2O+e-→Mn(OH)2+OH-锌锰电池碱性锌锰电池和中性锌锰电池放电主要是进行第一步反应,即反应的初级过程/反应,即:MnO2还原为MnOOH。初级过程是一个可逆过程。二氧化锰电极还原的速率控制步骤:1.在酸性溶液中,歧化反应过程是速率控制步骤。2MnOOH+2H+→MnO2+Mn2++2H2O2.在碱性溶液中,H+扩散过程是速度控制步骤。3.在中性溶液中,以上两个过程同时起作用。碱性锌锰电池碱性锌锰电池的工作原理碱性锌锰电池的电化学表达式:(-)Zn∣KOH(饱和ZnO)∣MnO2(+)放电时的电极反应式:负极:Zn+2OH--2e-→Zn(OH)2↓→ZnO↓+H2O正极:2MnO2+2H2O+2e-→2MnOOH+2OH-碱性锌锰电池电池放电总反应:Zn+2MnO2+H2O→ZnO↓+2MnOOH根据Nernst方程,其电动势的表达式为:或:Zn+2MnO2+2H2O→Zn(OH)2↓+2MnOOHE=?2222lnMnOZnHOMnOOHZnOaaaRTEEnFaa碱性锌锰电池锌电极的腐蚀-影响自放电的因素锌电极的腐蚀主要是由电池自放电所造成。在强碱性条件下,锌锰碱性电池的自放电主要由Zn-MnO2-H2O共轭体系中的阴极(正极)析氢反应和阳极(负极)氧化反应所致。即:负极:Zn+4OH--2e-→ZnO22-+2H2O正极:2H2O+2e→H2↑+2OH-总反应:Zn+2OH-→ZnO22-+H2↑该总反应就是腐蚀电池-锌锰碱性电池(锌负极)自放电的总反应:由此可见,自放电白白消耗了负极锌,并析出H2。碱性锌锰电池自放电的后果:自放电白白消耗了(负极)活性物质,降低了(负极)活性物质的使用效率,降低了电池的使用时间和寿命。因此,电池要尽量避免自放电的发生。当然自放电还可能白白消耗正极活性物质。碱性锌锰电池可充碱性锌锰电池MnO2电极:前已述及,MnO2的还原分两步进行(初级过程/反应与次级过程/反应)即:初级过程:MnO2→MnOOH(可逆)次级过程:MnOOH→Mn(OH)2(不可逆)如果电池放电深度停留在第一步的初级过程,则电池具有可逆性,即电池可进行充放电循环。即:MnO2→MnOOHMnO2(可逆)MnOOH→Mn(OH)2→MnOOH(不可逆)碱性锌锰电池根据第一步反应:MnO2+H2O+e-→MnOOH+OH-由Nernst方程,可知其电极电位:根据第二步反应:MnOOH+H2O+e-→Mn(OH)2+OH-由于第二步反应不可逆,因此可充碱性锌锰电池一定要限制其放电深度,一般放电深度控制在35%以内时可逆性较好。22()()lnlnMnOsHOMnOOHsOHaaRTRTFaFa碱性锌锰电池一般情况下,放电深度越深,电池循环性能越差,寿命越短;反之,放电深度越浅,电池的循环性能越好,寿命越长。MnO2电极的5个影响因素:MnO2晶型,电解液KOH浓度(pH值),掺杂/杂质情况,充放电制度,MnO2电极形成的压力等。严格执行充放电制度是延长可充碱性锌锰电池寿命的基本保证。严格限制过充电和过放电,避免次级过程/反应发生。锌锰电池可充碱性锌锰电池的开路电压(Vo)为1.55V,工作电压(Vc)为1.25V,放电终止电压(Ve)为0.9~1.0V,充电终止电压为2.0~2.5V。在上述条件下,电池的充放电循环寿命较长,自放电率较低,贮存性能也较好。充电是放电的逆过程,充电反应是放电反应的逆反应。锌锰电池无汞锌锰电池:无汞锌锰电池就是锌锰电池的无汞化。由于Hg具有“缓蚀剂”和提高析氢过电位的作用,从而降低负极锌的腐蚀。无汞化势必影响锌锰电池的性能,因此,工业上采用了无污染或污染很小的替代“缓蚀剂”。目前使用较多的替代“缓蚀剂”主要有:铟(In)和锡(Sn)。此外还有铋(Bi)、铅(Pb)和铝(Al)等。不同添加元素的作用并不相同,下表列出了几种“缓蚀剂”的作用。锌锰电池In抑制氢气产生,降低锌粒表面接触电阻。Sn增大析氢过电位,抑制氢气析出。Bi加入量必须适当。放电时,锌粉的析气量随Bi量的增加而减小;但过放电时,锌粉的析气量随Bi量的增加而增大。Pb增大析氢过电位,抑制氢气析出。Al降低锌粉析氢活性,增强缓蚀效果。Fe,Co,Ni,Cu,Pt,Pd析氢过电位较小的元素,属于有害元素,在电池中需要严格限制其含量。锌锰电池电池用二氧化锰:二氧化锰有很多种:(1)硬锰矿(-MnO2)(2)软锰矿(-MnO2)(3)斜方锰矿(-MnO2)(4)水锰矿(-MnOOH)(5)菱锰矿(MnCO3)根据不同来源,MnO2可分为:天然MnO2(NMD);化学MnO2(CMD);电解MnO2(EMD)。活性物质常用-MnO2和-MnO2。锌锰电池锌锰电池材料和锌锰电池的制造工艺正极:常用高纯度的电解MnO2(-MnO2);可充碱性锌锰电池多用高纯度的-MnO2;负极:常用高纯度的锌粉,对铁含量有严格限制。碱性锌锰电池的负极常用汞齐化锌粉或合金锌粉。电解质溶液:35%~40%的KOH溶液。制造工艺:电极制作多采用卷绕式和叠片式。锌锰电池锌锰电池的主要性能包括:电动势、开路电压、工作电压,电池内阻、放电容量和贮存性能等。(1)电动势:根据MnO2晶型和质量不同,一般在1.4V~1.6V之间。(2)开路电压:1.5V~1.8V(3)工作电压:1.25V~1.55V(4)电池内阻:不大于1Ω(5)放电容量:与放电制度有关,一般比能量不小于55Wh/kg。(6)贮存性能:普通锌锰电池1~3年。碱性锌锰电池达5~8年。锌汞电池锌汞电池:即锌-氧化汞电池。锌汞电池的优点与缺点优点:体积比能量高,放电平台优良,贮存性能好,放电平稳。缺点:由于使用了汞,对环境污染大。主要用途:小型医疗仪器,电子手表,助听器,袖珍计算器,记忆电源等。锌汞电池工作原理锌汞电池的电化学表达式为:(-)Zn∣KOH∣HgO(C)(+)负极放电反应:Zn+2OH--2e-→Zn(OH)2↓→ZnO↓+H2O(-1.245V)正极放电反应:HgO+H2O+2e-→Hg+2OH-(0.98V)电池放电总反应:Zn+HgO→Hg+ZnO电池的标准电动势:0.98-(-1.245)=2.225V锌汞电池锌汞电池的结构及制造工艺:负极:锌汞齐粉末,含汞量不大于10%;正极:红色HgO+C(石墨粉),石墨含量不大于15%;隔膜:离子透过性牛皮纸;电解质:35%~40%的KOH溶液;电极制作:压结式和锌箔式。汞齐化的方法(1)Zn+HgCl2→ZnCl2+Hg(Zn大大过量)(2)Zn+Hg→Zn(Hg)锌汞电池锌汞齐中杂质除去及检测:HgCl2+2OH-→HgO+H2O+2Cl-ZnO+2HCl→ZnCl2+H2OAg++Cl-→AgCl↓(AgNO3溶液检测Cl-)汞齐化锌粉的汞含量通常为10%~15%(质量分数),一般小于10%,视密度(松装密度)为1.6~2.0。锌汞电池除了体积比能量高,放电平台优良,贮存性能好,放电平稳等优点外,还具有受温度影响小、活性物质利用率高的优点。锌银电池锌银电池的工作方式:锌银电池可以有一次电池和二次电池两种。从外型上有扁形(B)和矩形(F)两种。扁形就是通常所说的扣式。锌银电池的优缺点:优点:放电电压平坦,自放电率小,贮存时间长,比能量和比功率大等。缺点:由于含有贵金属银,所以成本较高。锌银电池锌银电池的电化学表达式为:(-)Zn∣KOH∣Ag2O(AgO)(+)锌银电池是以锌为负极,氧化银为正极,KOH为电解质的一次(或二次)电池。放电反应:负极:Zn+2OH--2e-→Zn(OH)2↓→ZnO↓+H2O正极:Ag2O+H2O+2e-→2Ag+2OH-电池总反应:Zn+Ag2O→2Ag+ZnO锌银电池由于锌银电池的正极含有AgO和Ag2O两种氧化形态,根据还原后的物质不同,其电极电位也不一样,所以电池的电动势也不一致。一般情况下有以下四种组合:氧化产物-还原产物:电动势(1)Zn(OH)2-Ag2O:1.856V(2)Zn(OH)2-Ag:1.594V(3)ZnO-Ag2O:1.867V(4)ZnO-Ag:1.605V锌银电池由于锌银电池的上述特性,所以锌银电池既可以做成高能一次电池,又可以做成可充(二次)电池。最常用做贮备电池,用于航天、导弹的电源。锌银电池的开路电压(或电动势)与环境的pH无关,仅仅取决于正极和负极物质的标准电极电位。锌-空气电池什么是锌-空气电池?锌-空气电池就是以锌作为负极活性物质,以空气中的氧气作为正极活性物质所构成的一次电池。以纯氧气作为正极活性物质的,叫做锌-氧电池。锌-空气电池锌-空气电池的特点1.比能量高(理论比能量高达1350Wh/kg)实际比能量已经可达300Wh/kg以上;2.工作电压平稳,放电平台好;由于正极使用的是空气,因此其成本很低;3.安全性能好。锌-空气电池锌-空气电池的用途1.江河航标灯电源;2.野外工作人员(地质勘探人员、科考人员等)的便携式通讯机电源;3.雷达电源等;4.小型高性能扣式电池还适合作小功率电源。锌-空气电池的工作原理锌-空气电池的工作原理电化学表达式为:(-)Zn∣KOH∣O2(air,C/Pt)(+)电极反应为:负极:Zn+2OH--2e-→Zn(OH)2↓→ZnO↓+H2O负极的电极电位:锌-空气电池正极:1/2O2+H2O+2e-→2OH-正极的电极电位:电池总反应:Zn+1/2O2→ZnO锌-空气电池的电动势:E=+--=E0+?锌-空气电池锌-空气电池的正极结构锌-空气电池的正极以空气中的氧气为活性物质,通过含银(Ag)或铂(Pt)的活性炭载体做成的电极进行反应和工作。银、铂、镍等金属起氧电极的催化剂的作用。为了在碳电极上获得较大的电流密度,必须加速氧的输运速率,气体扩散电极具有加速气体输运的功能。因此,锌-空气电池的氧电极都采用憎水型气体扩散电极。锌-空气电池锌-空气电池的结构常见的锌-空气电池有两种结构:即矩形(F)结构和扣式(B)结构。矩形结构正极:聚四氟乙烯(PTFE)型空气电极;负极:由汞齐化锌粉压制而成的锌电极;隔膜:维尼龙纸、石棉纸或水化纤维素膜等。锌-空气电池锌-空气电池的制造工艺气体扩散电极:气体扩散电极由防水透气层、催化层和导电骨架网组成。上述三层经加热、压合而成聚四氟乙烯(PTFE)型空气电极。根据所用憎水剂的不同,它主要有两种类型。即:聚四氟乙烯(PTFE)型电极和聚乙烯(PE)型电极。催化层由活性炭与聚四氟乙烯(PTFE)的混合物复合而成,质量比3:1。锌-空气电池锌-空气电池的制造工艺导电骨架网是由0.1mm厚的铜箔在氢气炉中退火后冲压而成。防水层也是由活性炭与聚四氟乙烯(PTFE)的混合物复合而成,质量比1:3。导电骨架网的极耳常用银箔裁减后经激光焊接而成。锌-空气电池锌负极的制造方法与工艺锌负极制造常用:压成法、化成法、涂膏法、烧结法、电沉积法等。这五种方法各有其优缺点,但目前都用得比较广泛。电极性能最好的制作方法是电沉积法。但这种制作方法的成本较高。锌-空气电池锌-空气电池的性能特点开路电压:1.45V;工作电压:0.9V~1.3V;平均电压:1.2V;工作电压:1.2V;自放电率:0.2%~1.0%/月;工作环境温度:-20℃~40℃;比能量高;放电平稳。锌-空气电池由于在放电过程中,气体扩散电极的化学性质不变,放电电压平稳,所以在相同负载下,锌-空气电池的放电时间是锌-汞电池和锌-银电池的两倍以上。锌-空气电池适合于大电流放电,所以它常用于输出功率较大、需要较大工作电流的用电设备上。放电时间:由于锌-空气电池比能量比锌-汞电池和锌-银电池大,因此,在相同条件下,其放电时间为:锌-空气电池>锌-汞电池>锌-银电池。锌-空气电池锌-空气电池的寿命与自放电锌-空气电池的贮存寿命比锌-汞电池和锌-银电池的寿命短。主要原因是锌-空气电池的自放电率较大。自放电率大的主要原因又在于锌负极发生的阳极氧化反应(对应于阴极析氢反应),由于正极是气体扩散电极,对自放电影响很小。导致锌负极自放电的因素:(1)析氢反应;(2)电解液中溶解氧的锌氧化反应;(3)CO2破坏电解液的作用;(4)空气湿度变化是电解液变浓或变稀等。练习题写出可充碱性锌锰电池的电化学表达式、电极反应式和总反应式,电极电位和电动势的Nernst表达式。写出锌银二次电池的电化学表达式、电极反应式和总反应式,电极电位和电动势的Nernst表达式。锌-空气电池的工作原理是什么?其电动势主要由哪些因素决定?



















