


《化学反应速率图象分析PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为608.5 KB,总共有20页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 20页
- 608.5 KB
- VIP模板
- ppt
- 数字产品不支持退货
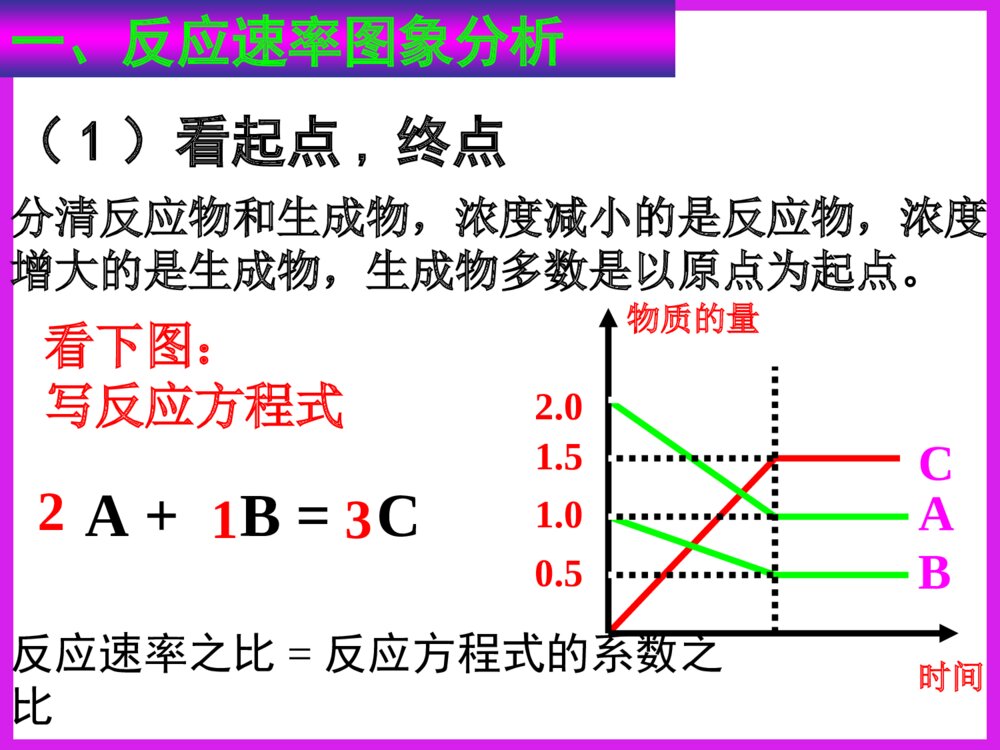
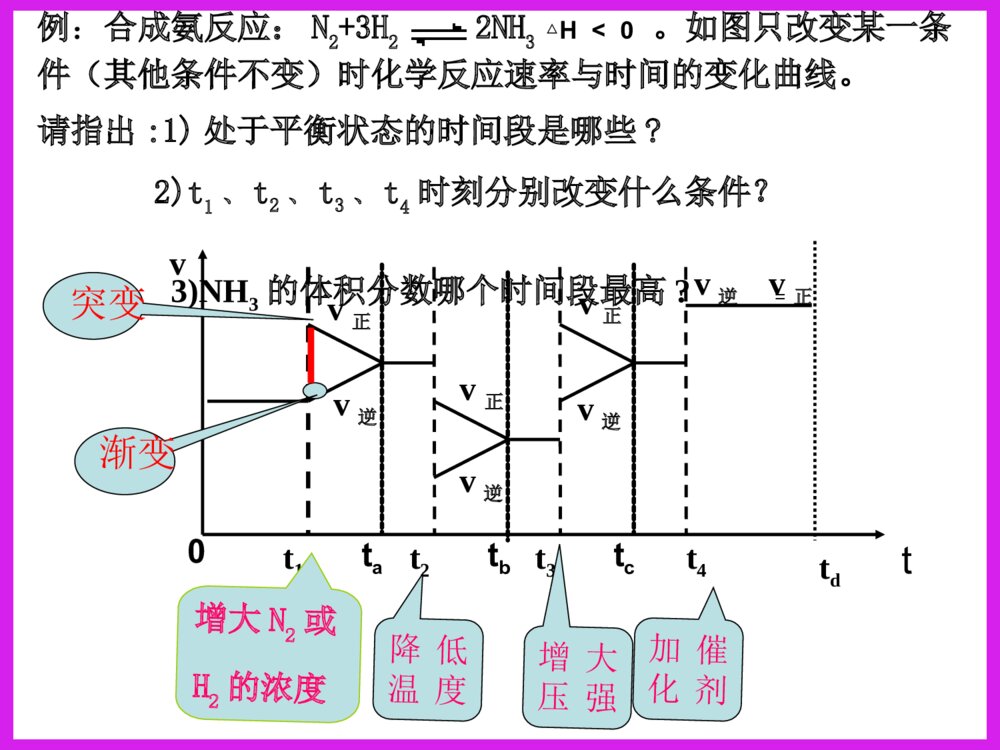
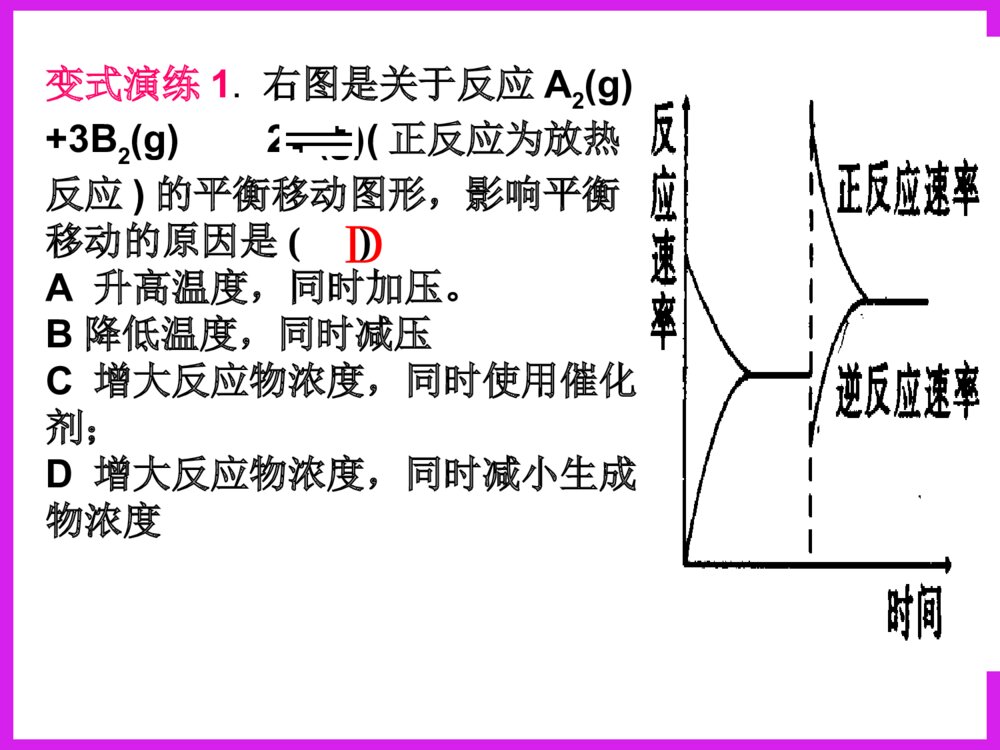
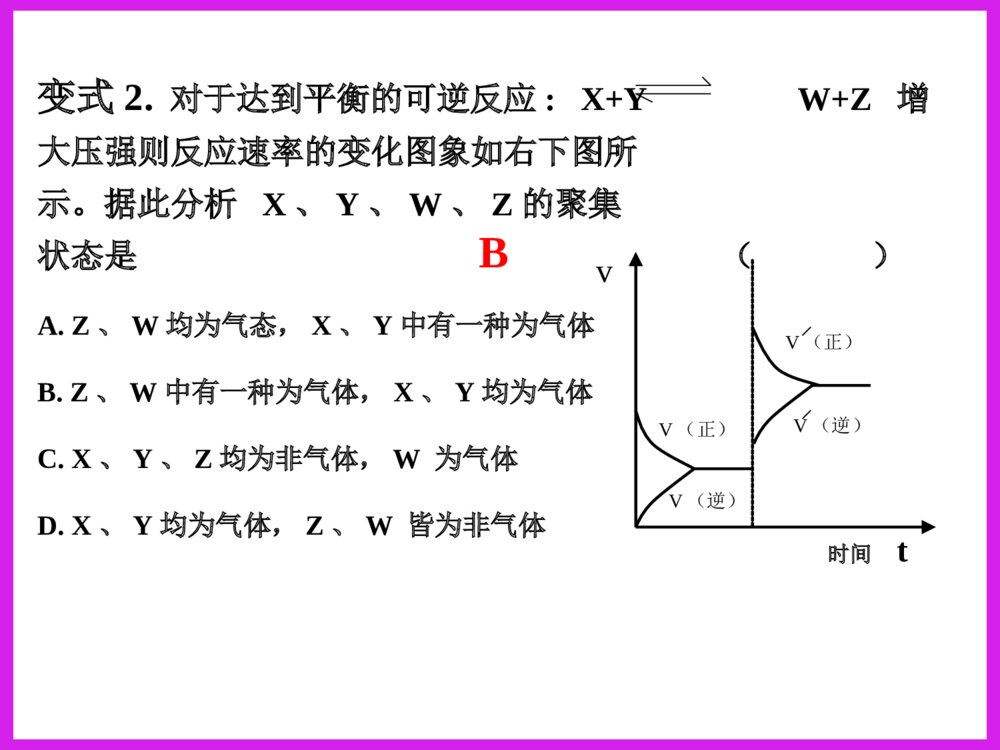
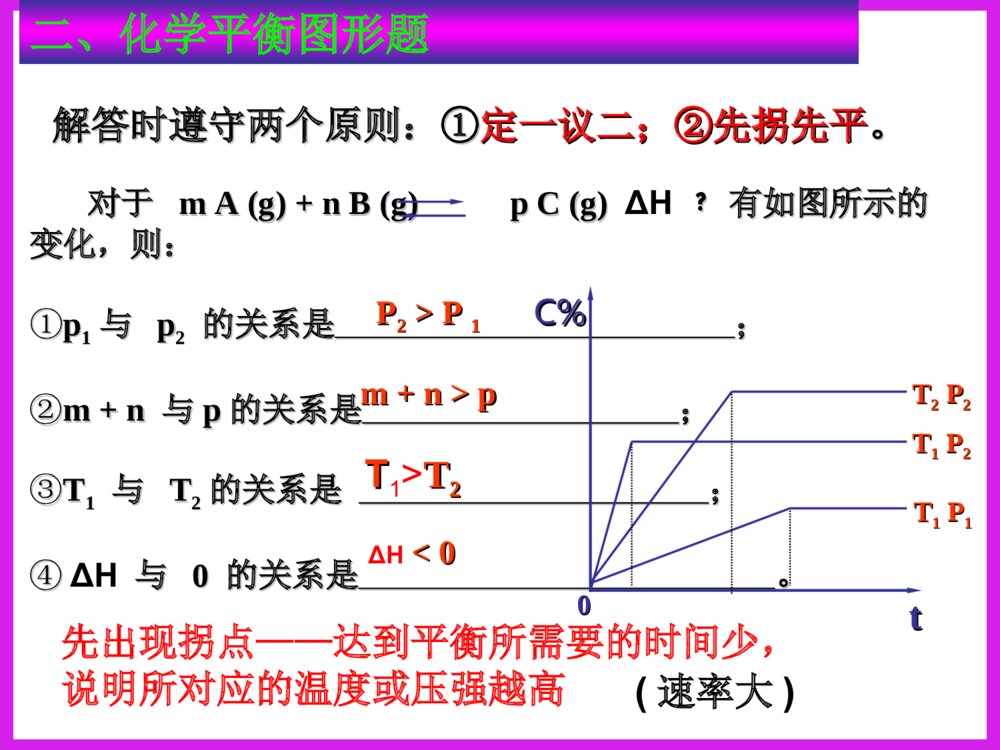
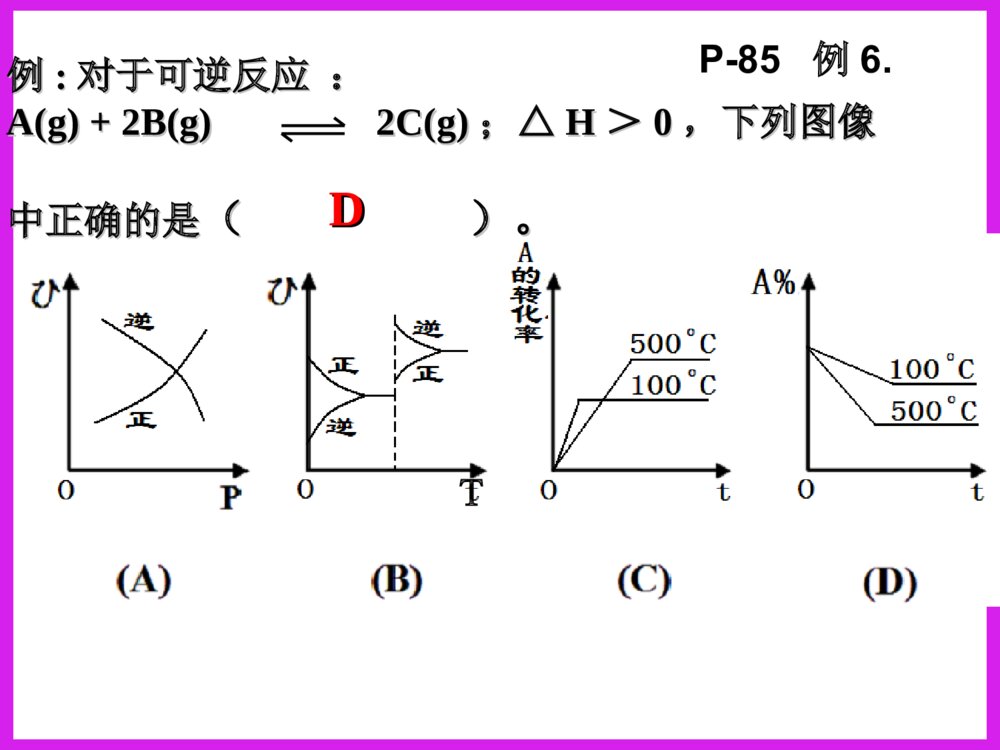
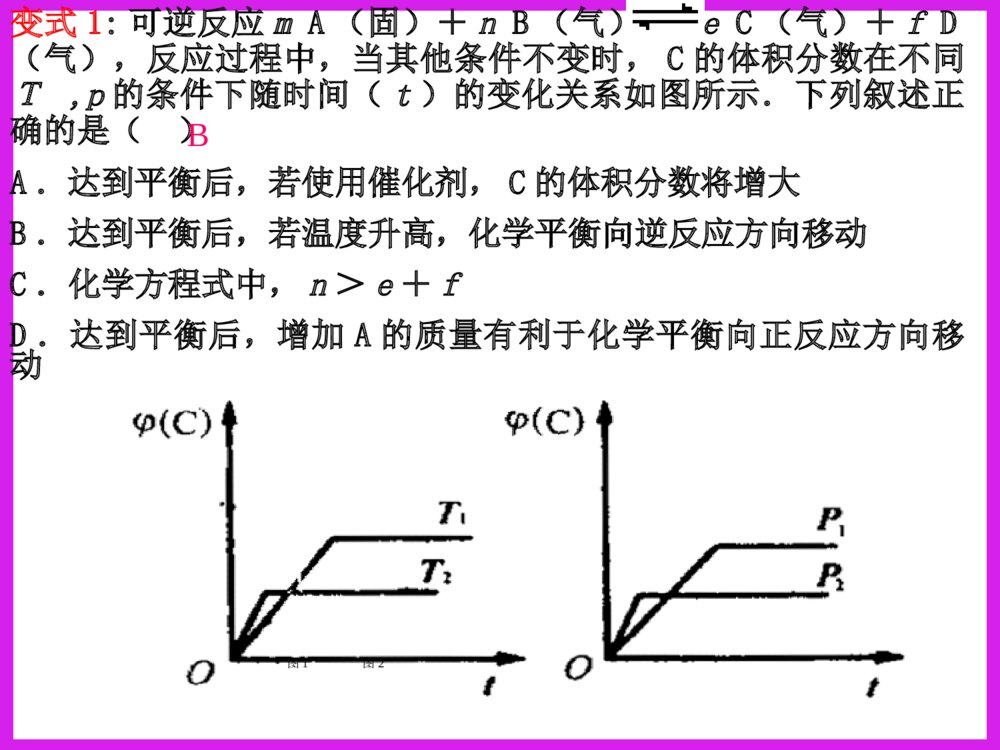
化学反应速率图象分析一、反应速率图象分析(1)看起点,终点分清反应物和生成物,浓度减小的是反应物,浓度增大的是生成物,生成物多数是以原点为起点。看下图:写反应方程式0.51.51.02.0物质的量CAB时间A+B=C213反应速率之比=反应方程式的系数之比(2).看变化趋势一、反应速率图象分析例:合成氨反应:N2+3H22NH3H<0△。如图只改变某一条件(其他条件不变)时化学反应速率与时间的变化曲线。请指出:1)处于平衡状态的时间段是哪些?2)t1、t2、t3、t4时刻分别改变什么条件?3)NH3的体积分数哪个时间段最高?vt1v正t2t3t4v逆v逆v逆v正v逆=tdv正v正增大N2或H2的浓度增大压强降低温度加催化剂tatbtc0渐变突变t(2).看变化趋势分清正反应和逆反应;分清放热反应和吸热反应;分清“突变”和“渐变”“小变”和“大变”一、反应速率图象分析变式演练1.右图是关于反应A2(g)+3B2(g)2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是()A升高温度,同时加压。B降低温度,同时减压C增大反应物浓度,同时使用催化剂;D增大反应物浓度,同时减小生成物浓度DB变式2.对于达到平衡的可逆反应:X+YW+Z增大压强则反应速率的变化图象如右下图所示。据此分析X、Y、W、Z的聚集状态是()A.Z、W均为气态,X、Y中有一种为气体B.Z、W中有一种为气体,X、Y均为气体C.X、Y、Z均为非气体,W为气体D.X、Y均为气体,Z、W皆为非气体vV(正)V(正)V(逆)V(逆)时间t解答时遵守两个原则:①解答时遵守两个原则:①定一议二;②先拐先平定一议二;②先拐先平。。对于对于mA(g)+nB(g)pC(g)mA(g)+nB(g)pC(g)ΔH﹖﹖有如图所示的有如图所示的变化,则:变化,则:①①pp11与与pp22的关系是的关系是;;②②m+nm+n与与pp的关系是的关系是;;③③TT11与与TT22的关系是的关系是;;④④ΔH与与00的关系是的关系是。。PP22>P>P11TT1>TT22m+n>pm+n>pΔH<0<0C%C%tt00TT22PP22TT11PP22TT11PP11二、化学平衡图形题先出现拐点——达到平衡所需要的时间少,说明所对应的温度或压强越高(速率大)DD例例::对于可逆反应:对于可逆反应:A(g)+2B(g)A(g)+2B(g) 2C(g)2C(g);△;△HH>>00,下列图像,下列图像中正确的是中正确的是()。()。TP-85例6.变式1:可逆反应mA(固)+nB(气)eC(气)+fD(气),反应过程中,当其他条件不变时,C的体积分数在不同T,p的条件下随时间(t)的变化关系如图所示.下列叙述正确的是( )A.达到平衡后,若使用催化剂,C的体积分数将增大B.达到平衡后,若温度升高,化学平衡向逆反应方向移动C.化学方程式中,n>e+fD.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动图1图2B2.一定量的锌与足量的盐酸反应,产生H2的量随时间变化的曲线为实线,在相同条件下,若反应开始时加入少量的CuSO4,其对应的曲线为图中虚线,下列正确的是()t气体的量t气体的量t气体的量ABt气体的量CDC若为足量的锌与一定量的盐酸反应,其他不变,又该如何?200C300C100C转化率压强0mA(g)+nB(g)pC(g)+qD(g)Pm+np+q>△H0看图技巧:图象中有三个量时,“定一看二”,再看曲线的变化趋势。等压线>A(1)转化率——压强——温度曲线三.复杂图象的解法B的含量温度01.01107Pa1.01106Pa练习TmA(g)+nB(g)pC(g)+qD(g)m+np+q<等温线△H0>(2)含量——压强——温度曲线综合应用某可逆反应L(s)+G(g)3R(g)为吸热反应,本图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示()(A)平衡混合气中R的质量分数(B)达到平衡时G的转化率(C)平衡混合气中G的质量分数(D)达到平衡时L的转化率C变式2.在一定条件下,固定容积的密闭容器中反应:2NO2(g)O2(g)+2NO(g)△H>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是()A、当X表示温度时,Y表示NO2的物质的量B、当X表示压强时,Y表示NO2的转化率C、当X表示反应时间时,Y表示混合气体的密度D、当X表示NO2的物质的量时,Y表示O2的物质的量0xY3.(05全国卷Ι)右图是温度和压强对X+Y22Z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是:A.X和Y中只有一种为气态,Z为气态B.X、Y、Z均为气态C.上述可逆反应的正反应为放热反应D.上述反应的逆反应的ΔH<0对于反应:对于反应:2A+B2C2A+B2C在反应过程中在反应过程中CC的的百分含量随温度变化如右图所示,则:百分含量随温度变化如右图所示,则:⑴⑴TT00对应的对应的VV正正与与VV逆逆的关系是的关系是_________._________.⑵⑵正反应为正反应为________________热反应热反应..⑶⑶AA、、BB两点正反应速率的大小关系是两点正反应速率的大小关系是:_______:________________._________.⑷⑷温度温度TP4,y轴表示A的转化率B. P3P4,y轴表示混合气体密度D. P3>P4,y轴表示混合气体Mt0P3P4yT(℃)ⅠA、D



















