




《化学电子式书写PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为1.58 MB,总共有32页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 32页
- 1.58 MB
- VIP模板
- ppt
- 数字产品不支持退货
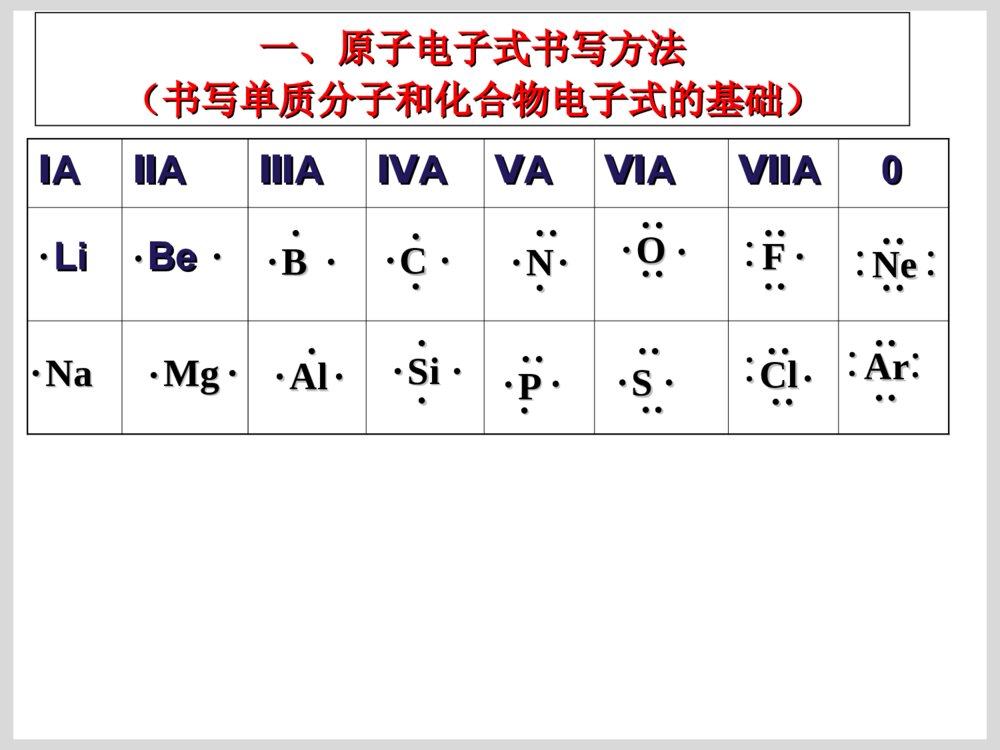
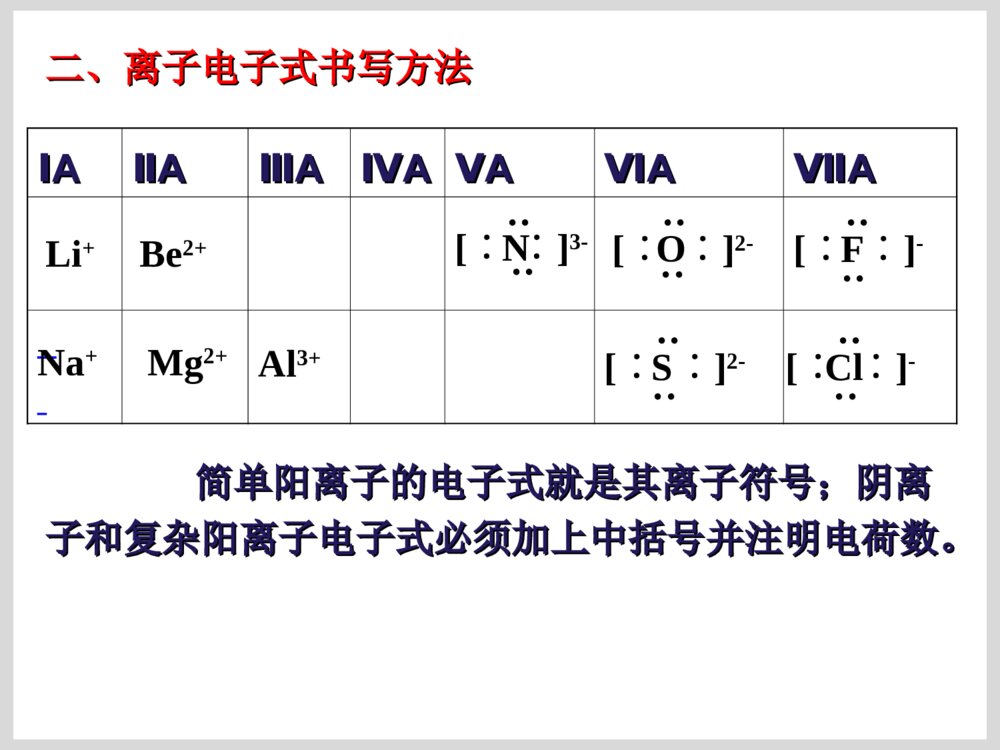
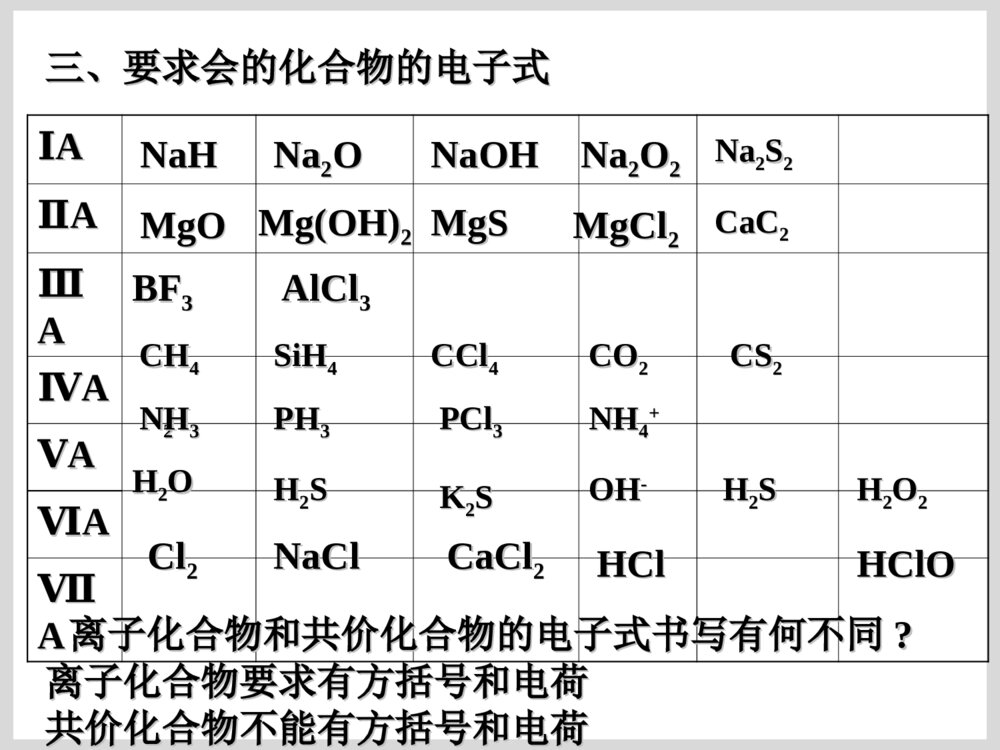
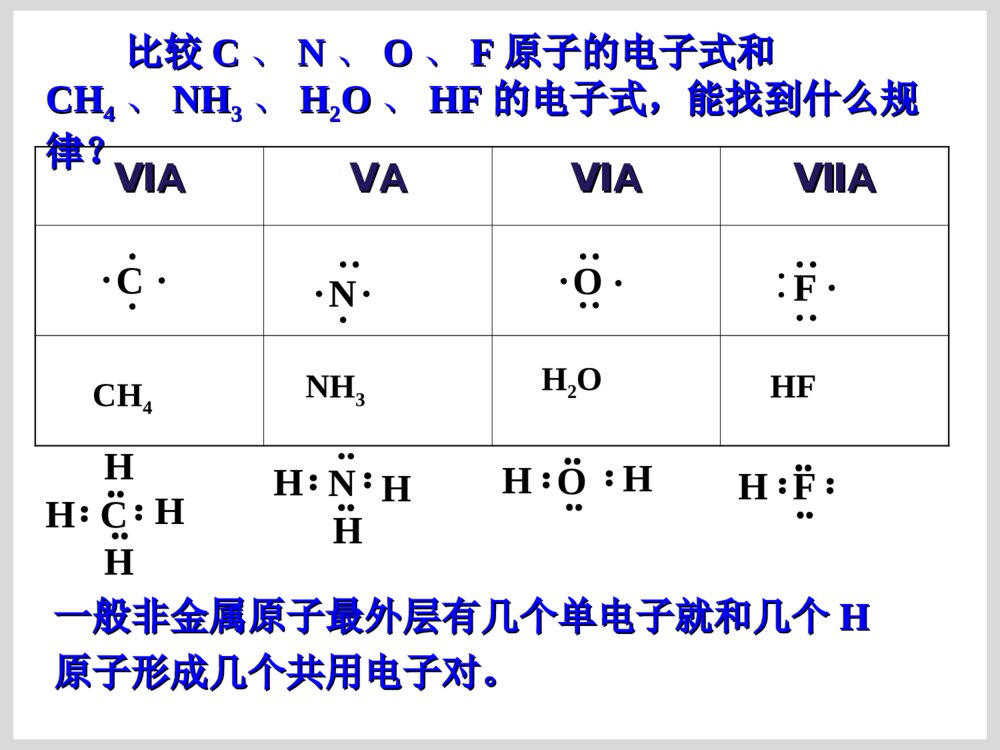
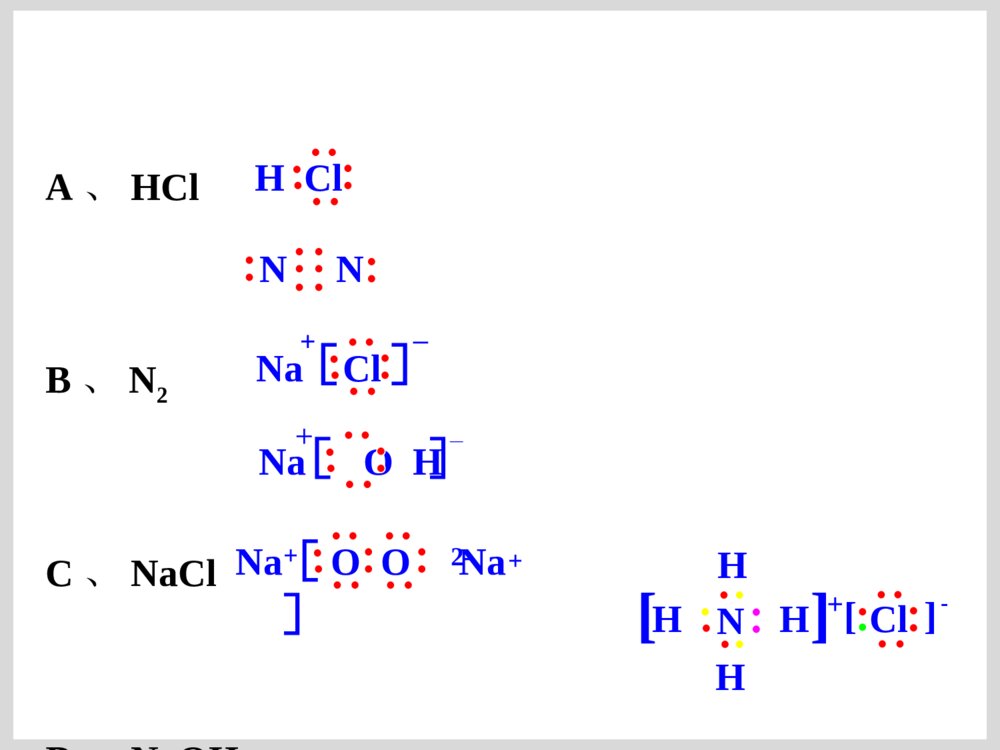
原子结构的表示方法原子结构的表示方法原子结原子结构的表构的表示方法示方法核组成符号极其含义:核组成符号极其含义:XXZZAA原子结构示意图:原子结构示意图:SS2-2-电子式:在元素符号的周围用小点点表电子式:在元素符号的周围用小点点表示原子最外层电子数的式子。示原子最外层电子数的式子。电子排布式电子排布式一、原子电子式书写方法一、原子电子式书写方法(书写单质分子和化合物电子式的基础)(书写单质分子和化合物电子式的基础)ⅠⅠAAⅡⅡAAⅢⅢAAⅣⅣAAⅤⅤAAⅥⅥAAⅦⅦAA00NaNa····MgMg··AlAl······SiSi········LiLi····BeBe··BB······CC········PP··········NN··········OO············FF··········∶∶NeNe········∶∶∶∶∶∶····ClCl··········SS········ArAr········∶∶∶∶二、离子电子式书写方法二、离子电子式书写方法ⅠⅠAAⅡⅡAAⅢⅢAAⅣⅣAAⅤⅤAAⅥⅥAAⅦⅦAALi+N····[∶∶]3-Be2+O····[∶∶]2-简单阳离子的电子式就是其离子符号;阴离简单阳离子的电子式就是其离子符号;阴离子和复杂阳离子电子式必须加上中括号并注明电荷数。子和复杂阳离子电子式必须加上中括号并注明电荷数。····[∶∶]-FNa+Mg2+Al3+····[∶∶]-Cl····[∶∶]2-S离子化合物和共价化合物的电子式不同点:离子化合物和共价化合物的电子式不同点:((11)电荷:用电子式表示离子化合物的结构需标出)电荷:用电子式表示离子化合物的结构需标出阳离子和阴离子的电荷;而表示共价化合物的结构阳离子和阴离子的电荷;而表示共价化合物的结构不能标电荷。不能标电荷。((22))[][](方括号):离子化合物中简单阳离子(方括号):离子化合物中简单阳离子(单核)就是其离子符号;复杂阳离子(单核)就是其离子符号;复杂阳离子(NH(NH44++))需需用方括号括起来,并注明电荷;而共价化合物中不用方括号括起来,并注明电荷;而共价化合物中不能用方括号。能用方括号。三、要求会的化合物的电子式三、要求会的化合物的电子式ⅠⅠAAⅡⅡAAⅢⅢAAⅣⅣAAⅤⅤAAⅥⅥAAⅦⅦAANaHNaHNaNa22OONaNa22OO22NaOHNaOHMgOMgOMg(OH)Mg(OH)22NaNa22SS22MgSMgSMgClMgCl22BFBF33AlClAlCl33CHCH44SiHSiH44COCO22CSCS22PHPH33PClPCl33NN22HH22OOHH22SSOHOH--HH22SSClCl22NHNH33HClHClNaClNaClCaClCaCl22KK22SSNHNH44++离子化合物和共价化合物的电子式书写有何不同离子化合物和共价化合物的电子式书写有何不同??CClCCl44HH22OO22CaCCaC22HClOHClO离子化合物要求有方括号和电荷离子化合物要求有方括号和电荷共价化合物不能有方括号和电荷共价化合物不能有方括号和电荷比较比较CC、、NN、、OO、、FF原子的电子式和原子的电子式和CHCH44、、NHNH33、、HH22OO、、HFHF的电子式,能找到什么规的电子式,能找到什么规律?律?ⅥⅥAAⅤⅤAAⅥⅥAAⅦⅦAAC····N·····O······F·····∶CH4NH3H2OHF一般非金属原子最外层有几个单电子就和几个一般非金属原子最外层有几个单电子就和几个HH原子形成几个共用电子对。原子形成几个共用电子对。C::::HHHHO:::HH:F:::H:N:::HHH..四、用电子式表示化合物的形成过程四、用电子式表示化合物的形成过程NaCl:NaCl:CaO:CaO:NaNa22S:S:MgClMgCl22::HCl:HCl:HH22OO亲爱的同学们:你动手写写吧,高考需要你动手!亲爱的同学们:你动手写写吧,高考需要你动手!K2S:书写离子化合物的电子式书写离子化合物的电子式ClNaNaO2-NaClMg2Cl书写共价化合物电子式的方法书写共价化合物电子式的方法::将成键原子的电子式将成键原子的电子式组合起来,使其达到组合起来,使其达到88电子或电子或22电子稳定结构。电子稳定结构。书写书写HH22SS、、HH22OO22、、COCO22电子式:电子式:CaF2:::K+[:S:]2-K+CaO:Ca2+[O]2-::×·×·:::::×·×·K+[OO]2-K+::×·×·[F]-Ca2+[F]-K2O2:MgCl2:NaCl:Na2O:A、HCl B、N2 C、NaClD、NaOH E、Na2O2 F、NH4ClHClNNNaCl+[ ]-NaOH[ ]+—NaOONa[ ]2-++NHHHHCl[]-[]+·O·····[O]2-····::[[练习练习]]⑴⑴用电子式表示用电子式表示氧化镁氧化镁的形成过程的形成过程·Mg·+→Mg2+⑵⑵用电子式表示用电子式表示硫化钾、硫化钾、MgBrMgBr22的形成过程的形成过程注意Mg2BrBrSKKBrMgBrS2-KK例:写离子化合物电子式时,离子数目少的微粒写写离子化合物电子式时,离子数目少的微粒写在中间,离子数目多的微粒逐个写在左右,不在中间,离子数目多的微粒逐个写在左右,不得合并。得合并。2.2.下列用电子式表示化合物的形成过程正确的是(下列用电子式表示化合物的形成过程正确的是())Cl][HClHKOKO][K2K]MgFFMgF2[2[]Ba[]Cl[]Cl2BaClClABCD课堂练习课堂练习1.1.用电子式表示下列离子化合物的形成过程:用电子式表示下列离子化合物的形成过程:(1)CaO(2)Na(1)CaO(2)Na22O(3)CaClO(3)CaCl22A22、用电子式表示共价键的形成过程、用电子式表示共价键的形成过程++2H××+HH××ו指出下列物质含有什么化学键指出下列物质含有什么化学键KClMgClKClMgCl22ClCl22HFCaOHHFCaOH22OO用电子式化合物的形成过程:用电子式化合物的形成过程:→→NaNa++[S][S]22--NaNa++××············××NaNa++SS++NaNa××××············→→OCOOCO················××××××××········OO++CC++OO············××××××××············ClMgClMg2ClCl常见物质的电子式及结构式氮气的电子式、结构式NN:::::NN———氯气分子的电子式、结构式::::ClCl:::ClCl__水分子的电子式、结构式HHO::::O—HH—二氧化碳的电子式::::OCO::::OCO————二硫化碳的电子式SCS::::::::SCS————硫化氢::SHHS::HH——氨分子的电子式、结构式N::::HHHNHHH———甲烷的电子式、结构式C::::HHHHCHHH————H甲醇的电子式、结构式甲醇的电子式、结构式HCHHHHO:::::::CHHOH_____三氯化磷的电子式、结构式三氯化磷的电子式、结构式ClClPCl___ClClPCl:::::::::::::四氯化碳的电子式结构式四氯化碳的电子式结构式ClClCClCl::::::::::::::::ClClCClCl____一氯甲烷的电子式、结构式一氯甲烷的电子式、结构式CHClHH:::::::CHClHH____次氯酸的电子式、结构式次氯酸的电子式、结构式HOCl:::::::HClO____氢氰酸的电子式、结构式氢氰酸的电子式、结构式HCN:::::HCN————三氟化硼的结构式三氟化硼的结构式BFFF————NaOHNaOH的电子式的电子式Na+O::::H-氢氧化钡的电子式氢氧化钡的电子式Ba2+OOHH::::::::--氮化钠的电子式氮化钠的电子式NaNaNaN::::3-+++过氧化钠的电子式过氧化钠的电子式NaNa++2-OO:::::::氯化铵的电子式氯化铵的电子式ClNHH+-HH::::::::次氯酸钠的电子式次氯酸钠的电子式Na+OCl-:::::::氢化钠的电子式氢化钠的电子式Na+H:-氮化镁的电子式氮化镁的电子式MgMgMgNN::::::::222+++33--碳化钙(电石)的电子式碳化钙(电石)的电子式CaCC:::::22-+乙炔的电子式、结构式乙炔的电子式、结构式CCHH:::::CCHH—————键角在分子中键和键之间的夹角叫做键角在分子中键和键之间的夹角叫做键角OHHO=C=O104°30′104°30′(折线型)(折线型)180°180°(直线型)(直线型)HHHHC109°28′109°28′(正四面体)(正四面体)HHHN107°18′107°18′(三角锥形)(三角锥形)



















