


《第十章醚和环氧化合物PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为847 KB,总共有38页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 38页
- 847 KB
- VIP模板
- ppt
- 数字产品不支持退货
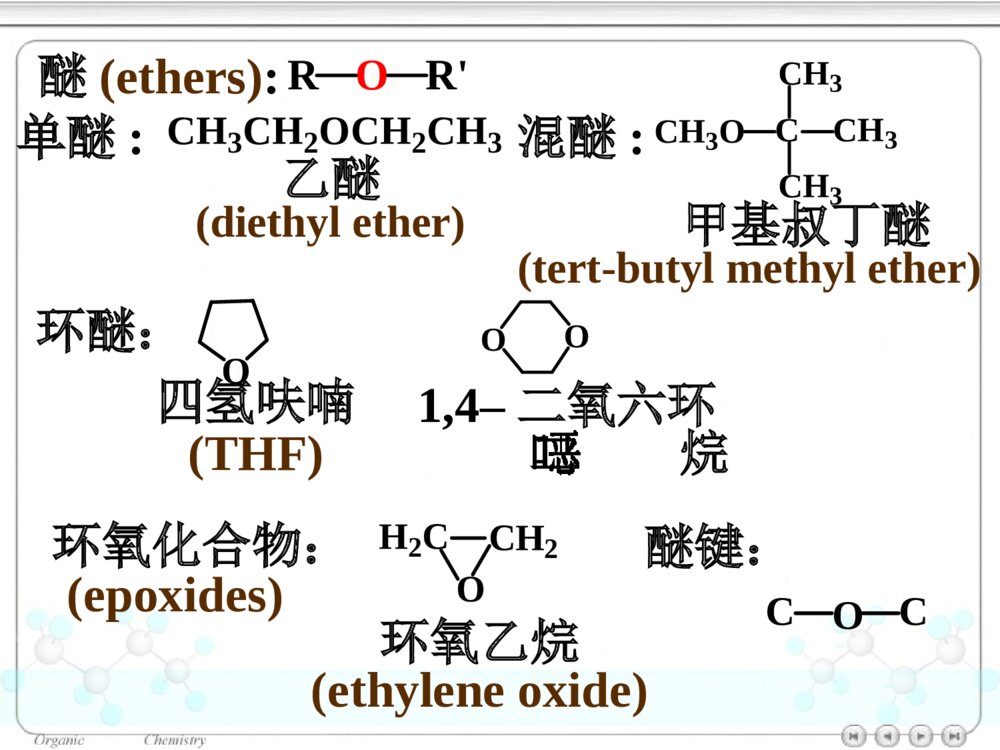
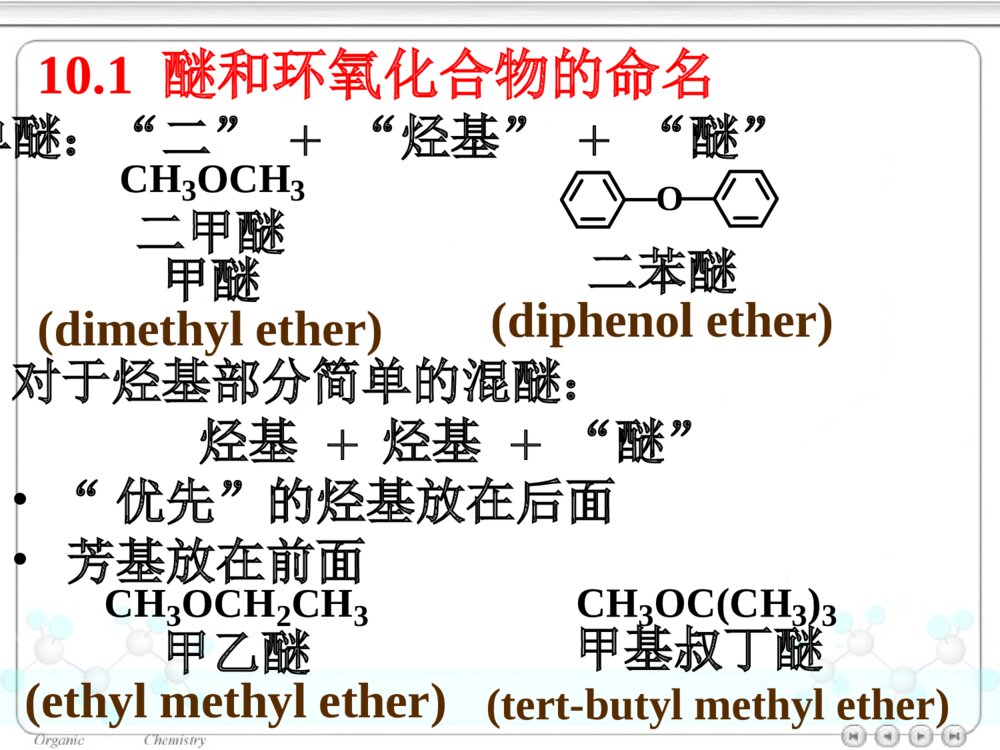
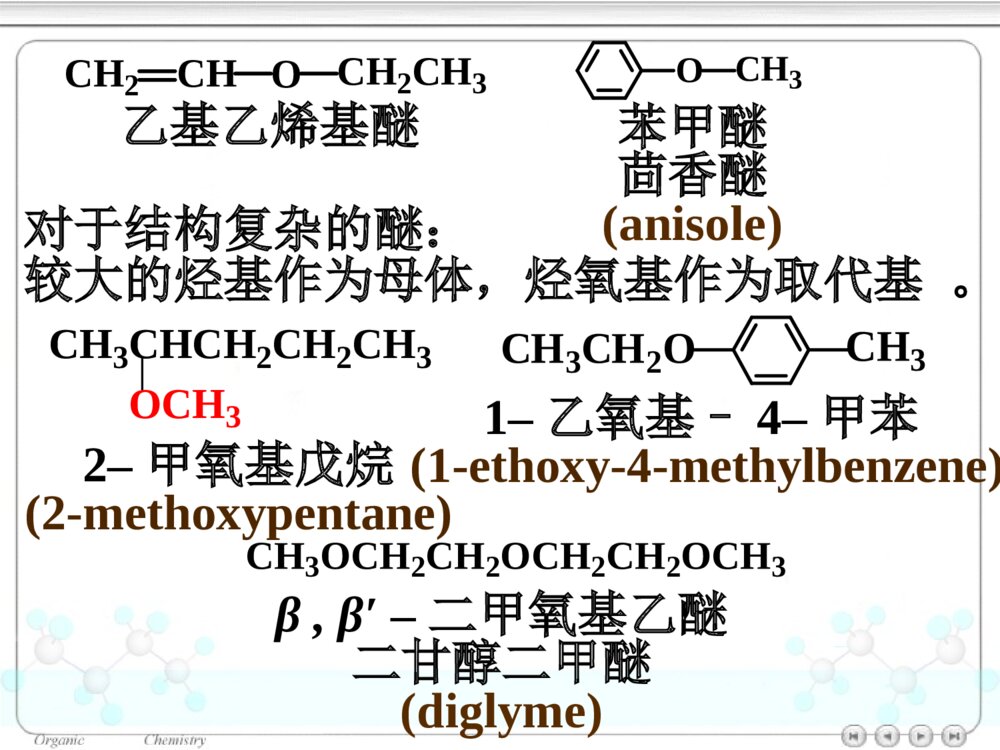
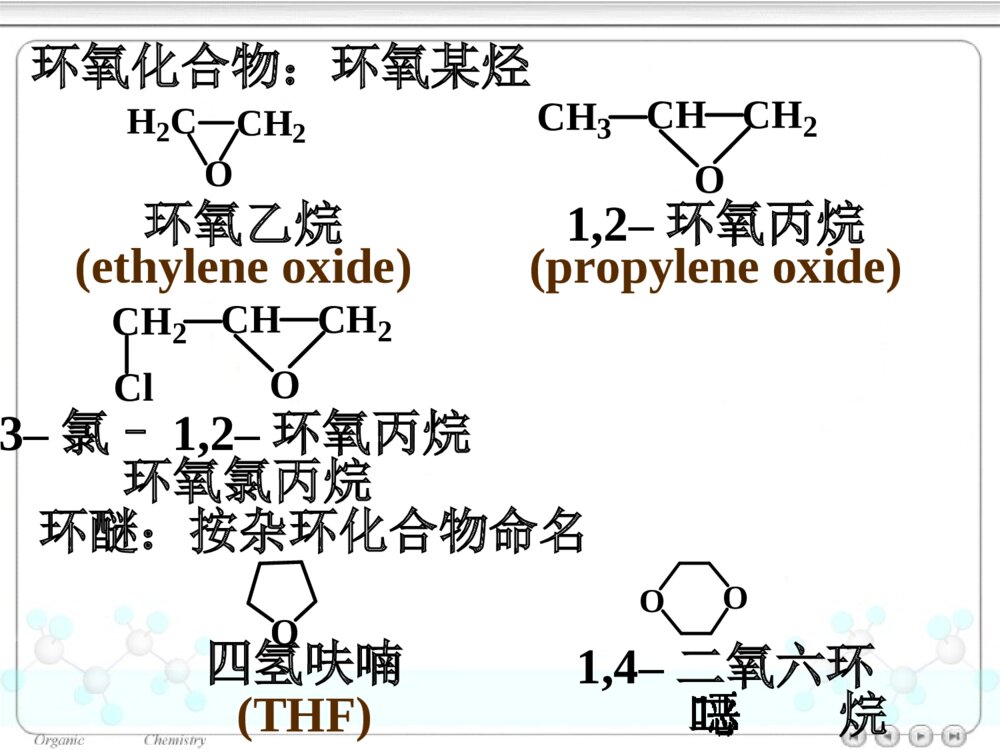
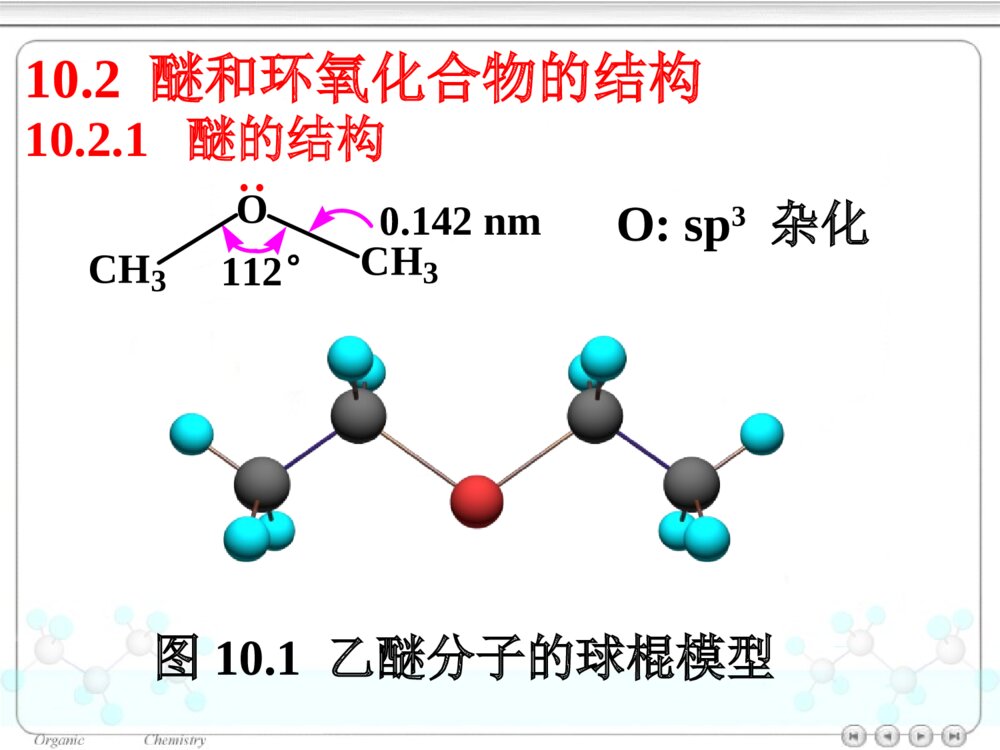
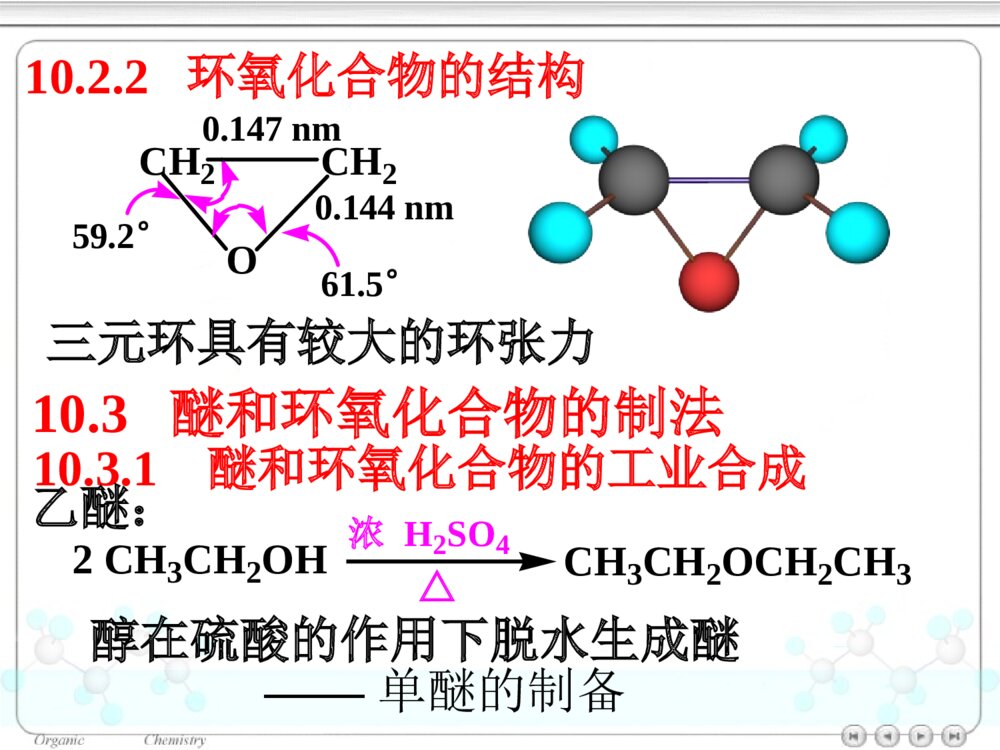
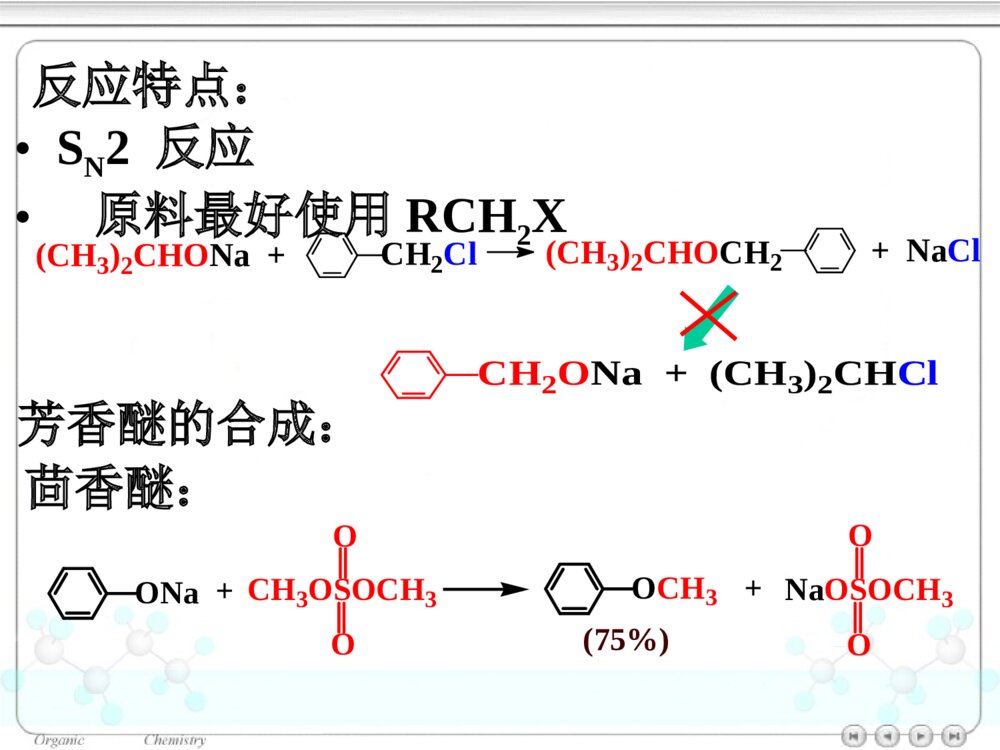
第十章醚和环氧化合物10.1醚和环氧化合物的命名10.2醚和环氧化合物的结构10.2.1醚的结构10.2.2环氧化合物的结构10.3醚和环氧化合物的制法10.3.1醚和环氧化合物的工业合成10.3.2Williamson合成法(1)醇钠对RX的SN2反应合成醚(2)合成环醚——生成环的大小与反应速率的关系(3)立体专一性——邻基参与作用10.3.3不饱和烃与醇的反应10.4醚的物理性质10.5醚的波谱性质10.6醚和环氧化合物的化学性质10.6.1盐的生成10.6.2酸催化碳氧键断裂10.6.3碱催化碳氧键断裂10.6.4环氧乙烷与Grignard试剂的反应10.6.5Claisen重排10.6.6过氧化物的生成绿色化学简介ROR\'醚(ethers):单醚:CH3CH2OCH2CH3乙醚(diethylether)混醚:CH3OCCH3CH3CH3甲基叔丁醚(tert-butylmethylether)环醚:O四氢呋喃(THF)OO1,4–二氧六环二烷环氧化合物:H2CCH2O(epoxides)环氧乙烷(ethyleneoxide)醚键:COC对于烃基部分简单的混醚:烃基+烃基+“醚”•“优先”的烃基放在后面•芳基放在前面10.1醚和环氧化合物的命名单醚:“二”+“烃基”+“醚”CH3OCH3二甲醚甲醚(dimethylether)O二苯醚(diphenolether)CH3OCH2CH3甲乙醚(ethylmethylether)甲基叔丁醚(tert-butylmethylether)CH3OC(CH3)3对于结构复杂的醚:较大的烃基作为母体,烃氧基作为取代基。CH2CHOCH2CH3乙基乙烯基醚OCH3苯甲醚茴香醚(anisole)CH3CHCH2CH2CH3OCH32–甲氧基戊烷(2-methoxypentane)1–乙氧基–4–甲苯(1-ethoxy-4-methylbenzene)CH3CH2OCH3CH3OCH2CH2OCH2CH2OCH3β,β′–二甲氧基乙醚二甘醇二甲醚(diglyme)环氧化合物:环氧某烃H2CCH2O1,2–环氧丙烷(propyleneoxide)CH3CHCH2O环氧乙烷(ethyleneoxide)CH2CHCH2OCl3–氯–1,2–环氧丙烷环氧氯丙烷环醚:按杂环化合物命名O四氢呋喃(THF)OO1,4–二氧六环二烷10.2醚和环氧化合物的结构图10.1乙醚分子的球棍模型10.2.1醚的结构OCH3CH3112°0.142nmO:sp3杂化10.2.2环氧化合物的结构CH2CH2O59.2°61.5°0.147nm0.144nm三元环具有较大的环张力10.3醚和环氧化合物的制法10.3.1醚和环氧化合物的工业合成乙醚:2CH3CH2OH浓H2SO4CH3CH2OCH2CH3△醇在硫酸的作用下脱水生成醚——单醚的制备环氧乙烷:CH2CH2+12O2Ag280~300℃,1~2MPaH2CCH2O10.3.2Williamson合成法用于混醚、环醚、芳香醚的合成RONa+R\'LROR\'+NaLL:Br,I,OSO2R\'\'»òOSO2OR\'\'µÈ(1)醇钠对RX的SN2反应合成醚CH3CH2CH2OHCH3CH2CH2ONa丙醇丙醇钠CH3CH2ICH3CH2CH2OCH2CH3+NaI乙丙醚(70%)Na反应特点:•SN2反应•原料最好使用RCH2X(CH3)2CHONa+CH2Cl(CH3)2CHOCH2+NaClCH2ONa+(CH3)2CHCl芳香醚的合成:茴香醚:ONa+CH3OSOCH3OOOCH3+NaOSOCH3OO(75%)(2)合成环醚——生成环的大小与反应速率的关系环醚可通过分子内的Williamson反应制备:(CH2)nCH2OHXHO-H2O(CH2)nCH2OXX(CH2)n+1O影响反应的因素:•X与–OH的距离愈小,愈易反应;•环张力愈小,愈易反应。反应速率依次减小反应速率与环的大小相关:OOOOO>>>≥O≥X与―OH处于反式,RO-从背后进攻中心C原子,形成具有立体专一性的环氧化合物。(3)立体专一性反应——邻基参与作用分子内的Williamson反应SN2反应机理BrOHH3CH3CHHNaOHBrOH3CH3CHHOHHH3CH3C-Br-H2OBrOHCH3H3CHHNaOHBrOH3CHOHHH3C-Br-H2OCH3HCH3顺–1,2–环氧丁烷反–1,2–环氧丁烷10.3.3不饱和烃与醇的反应醇与烯烃在酸的催化下,发生亲电加成反应,生成醚:羟基的保护基例如:BrCH2CH2CH2OHDCH2CH2CH2OHROH+CH3CCH3CH2浓H2SO4ROCCH3CH3CH3BrCH2CH2CH2OH+CH3CCH3CH2H2SO4BrCH2CH2CH2OC(CH3)3Mg纯醚BrMgCH2CH2CH2OC(CH3)3D2ODCH2CH2CH2OC(CH3)3DCH2CH2CH2OH+H2SO4△CH3CCH3CH2在碱的催化下,醇与炔烃发生亲核加成反应,生成烯基醚:RCCHCH3CH2OH+NaOHRCCH2OCH2CH310.4醚的物理性质10.5醚的波谱性质IR:C―O1200~1050cm-11HNMR:CHOδ3.4~4.0波数/cm-1T%图10.2正丙醚的红外光谱图T/%(CH3CH2CH2)2O(c)(b)(a)a3.37b1.59c0.93δ图10.3正丙醚的核磁共振谱图一种Lewis碱pKb≈17.5ROR\'10.6醚和环氧化合物的化学性质10.6.1盐的生成与强酸作用生成盐:ROR\'+HClROR\'H+Cl分离与提纯醚10.6.2酸催化碳氧键断裂醚在HI或HBr的作用下,C–O键断裂,生成醇与卤代烷等:CH3CH2CH2OCH3+HICH3CH2CH2OCH3H首先生成盐CH3CH2CH2OCH3HICH3I+CH3CH2CH2OHI–与盐发生SN2反应(CH3)3C–O–CH3SN1反应CCH3CH3CH3OCH3HBrCCH3CH3CH3OCH3HCH3OHCCH3CH3CH3BrCCH3CH3CH3Br在酸催化下,环氧化合物发生亲核取代反应,开环生成2–取代乙醇:H2CCH2OHBr10℃BrCH2CH2OH(~90%)H2CCH2OHH2OHOCH2CH2OH2HOCH2CH2OHH2O+H3O+工业上制备乙二醇的方法H2CCH2O+H3O+H2CCH2OH+H2O不对称的环氧化合物在酸催化下,发生SN2反应,Nu:优先进攻取代较多的C原子:CCH2OCH3CH3H+CCH2OCH3CH3HCCH2OHCH3CH3HδδCH3OHCCH2CH3CH3OCH3HOH-H+(CH3)2CCH2OHOCH3反应具有SN1的性质反式开环10.6.3碱催化碳氧键断裂在碱催化下,环氧化合物发生SN2反应,开环:H2CCH2O+NH3HOCH2CH2NH2H2CCH2O一乙醇胺二乙醇胺三乙醇胺H2CCH2OHOCH2CH2NHCH2CH2OHHOCH2CH2HOCH2CH2HOCH2CH2NCCH2OCH3CH3+CH3OCCH2OCH3OCH3CH3CH3OHCCH2OCH3OHCH3CH3+CH3O空间效应决定碱性开环方向;电子效应决定酸性开环方向。不对称的环氧化合物在碱催化下,发生SN2反应,Nu:优先进攻取代较少的C原子:-10.6.4环氧化合物与Grignard试剂的反应环氧化合物与Grignard试剂发生亲核取代反应,生成增加2个C原子的伯醇:H2CCH2O¢ÙRMgBr/(C2H5)2O¢ÚH3O+HOCH2CH2R不对称的环氧化合物与Grignard试剂作用,属于碱催化下的开环反应,试剂进攻取代较少的C原子:MgBrH2CCHO+CH3CH2¢Ù乙醚¢ÚH3O+CHCH3OH(60%)10.6.5Claisen重排苯基烯丙基醚加热分子内重排生成邻烯丙基苯酚:OCH2CHCH2200°OHCH2CHCH2OOOCH2CHCH2HOHCH2CHCH2反应机理:经历一个六元环过渡态。烯丙基同时重排和异构化。当两个邻位均被占有时,取代发生在对位:OCH2CHCH2H3CCH3△OHCH2H3CCH3CH2CH10.6.6过氧化物的生成1990年美国污染防止法案(pollutionpreventionact)1995年美国国家环境技术战略:2020年废物减少40%-50%,装置消耗原材料减少20%-25%1995年美国设立:“总统绿色化学挑战奖”我国进行绿色化学的研究有10年的历史绿色化学简介绿色化学(greenchemistry)环境无害化学(environmentalbenignchemistry)环境友好化学(environmentalfriendlychemistry)清洁化学(cleanchemistry)绿色化学:从源头消除污染的一项措施,是利用化学防止污染的一门科学。内容:新设计或重新设计化学合成、制造方法和化工产品来根除污染源。绿色化学12条规则:(1)防止废物生成比其生成后再处理更好。(2)合成方法使原料最大量地进入产品之中。(3)原料、中间产物和最终产品均对人类和环境无害、无毒。(4)化工产品:具有高效的功能,同时减少毒性。(5)尽可能避免使用溶剂、助剂,选用无毒、无害的助剂。(6)降低能耗,最好采用常温、常压下的合成方法。(7)原料采用可再生性资源代替消耗性资源。(8)尽量不用不必要的衍生物,如限制性基团、保护/去保护基团、临时调变物理/化学工艺。(9)采用高选择性的催化剂。(10)化工产品:使用后能分解成可降解的无害产品。(11)对危害物质在生成前实行在线监测和控制。(12)选择化学生产过程中的物质,使化学意外事故的危险性降低到最小程度。绿色化学的基本内容原子经济反应高选择性反应无毒无害原料可再生资源无毒无害催化剂无毒无害溶剂环境友好产品原子经济性(atomeconomy)Trost教授TrostBMScience1991,254,1471最大限度地利用原料分子每一个原子,使之结合到目标分子中,达到零排放(zeroemmission)A+BCA+BD+ER2CCHR+Br2CCl4R2CCHRBrBr原子经济性或原子利用率=被利用原子的质量反应中所使用全部反应物分子的质量×100加成反应:重排反应OCH2CHCH2ClaisenÖØÅÅOHCH2CH2CHWittig反应Ph3P+CH3Br¼îPh3PCH2CRROCRRCH2+Ph3PO(80%)14357=4%278份废物原子经济性的提高改善合成途径,避免不必要的衍生步骤环氧乙烷的生产2H2CCH2+O2Ag2H2CCH2O前者:25%后者:100%H2CCH2(1)Cl2/H2O(2)Ca(OH)2H2CCH2O+CaCl2+H2O绿色原料的选择光气是剧毒物质RNH2+COCl2RNCO+2HClEtOHRNHCOEtONO2+CO+1/2O2+CH3OHNHCO2CH3+H2O¼ÓÈÈNCO+CH3OH葡萄糖作替代原料:葡萄糖大肠杆菌3–脱氢莽草酸大肠杆菌顺,顺–黏糠酸Pt,H20.34MPa己二酸OH+CH3OCOCH3OOCH3+CH3OH+CO2使用碳酸二甲酯替代硫酸二甲酯:环境友好介质超临界流体——CO2处于超临界温度及超临界压力的流体超临界流体CO2:31.1°,7.18MPa性质:•密度接近于液体,黏度接近气态(扩散系数比液体大100倍),具有很高的传质速度。•流体的密度、溶剂强度和黏度均可由压力和温度变化来调节。功能:(1)作为反应的溶剂-取代有机溶剂,提高反应效率COOCH3NHCCH3O干性催化剂超临界CO2/H2CH3CCOOCH3NHCCH3HOee=95%CH3CHCH3COOCH3NHCCH3CCOOCH3CH3CHNOOH(2)超临界CO2喷漆技术减少80%的污染环境的挥发性有机溶剂(3)超临界流体萃取萃取树兰净油、处理烟草、萃取β–胡萝卜素、从油料作物中制取精炼食油具有较高的品质水作为有机反应的溶剂+COCH3H2OCCH3OBreslow快700倍Br+PhCOHInH2OPhCOHH金属有机反应LiCJ,ChanTH高效催化剂的使用催化剂的功能•自身不被消耗,并促进反应的转换,降低活化能,提高原料的利用率,降低废物的产生。•提高反应选择性:实现反应程度、位置及立体结构的控制。+H2CCH2AlCl3+H2CCHCH3AlCl3使用分子筛取替AlCl3仿生催化绿色化学产品的设计与制备绿色化学产品的特征•产品本身不会引起污染与健康问题•产品被使用后,应能再循环或易于降解为无害物质二酰基肼20–羟基蜕化素可降解塑料杀虫剂:第十章练习(P375-377):(二)(四的2、3小题)



















