








《医用化学《第二章 溶液》PPT课件》是由用户上传到老师板报网,本为文库资料,大小为465.5 KB,总共有33页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 33页
- 465.5 KB
- VIP模板
- ppt
- 数字产品不支持退货
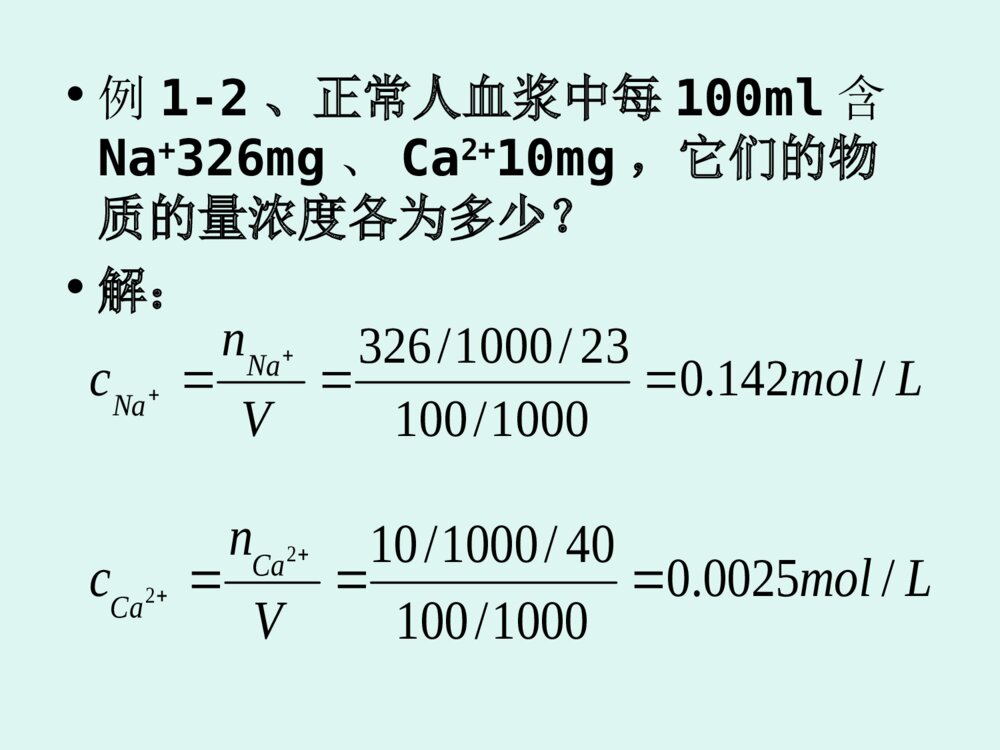
第二章溶液•溶液:一种或多种物质以分子、原子或离子状态分散在另一种物质中形成的均匀而稳定的体系知识回顾:物质的量•一、物质的量及其单位•1、定义:是表示以一特定数目的基本单元粒子为集体的、与基本单元的粒子数成正比的物理量。•2、英文表示:n(B)或nB•3、单位:摩尔(mol)•1)摩尔:是一系统的物质的量,该系统中所包含的基本单元数与0.012kg12C的原子数目(6.023×1023)相等。•2)阿伏伽德罗常数:0.012kg12C的原子数目为6.023×1023,用NA表示。•3)1mol任何物质都含有6.023×1023个基本单元。•注意:基本单元可以是实际存在的,也可以是根据需要指定的。•4)n、N、NA之间的关系:•n=N/NAN=n×NA•二、摩尔质量•1、定义:摩尔质量就是质量除以物质的量。•MB=mB/nB•2、单位:kg/mol,克/摩(g/mol)•3、数值大小:当摩尔质量的单位为g/mol时,摩尔质量数值上等于该物质的化学式量,即分子量或原子量,都可根据元素周期表查阅得到。第一节溶液组成量度的表示方法一、物质的量浓度•符号:cB或[B]•定义:物质B的物质的量除以溶液的体积•cB=VnBBBBMmnMB为摩尔质量•单位:SI单位:mol/m3;常用单位:mol/L,mmol/L,μmol/L•使用物质的量浓度时应注意的问题:1.必须指明物质B的基本单元2.在不引起混淆的情况下,物质的量浓度可以简称为浓度•例1-1药典规定注射用生理盐水的规格为0.5L生理盐水中含4.5gNaCl,计算注射用生理盐水的物质的量浓度。解:n(NaCl)=c(NaCl)=)(077.05.585.4)()(molNaClMNaClm)/(154.05.0077.0)(LmolVNaCln•例1-2、正常人血浆中每100ml含Na+326mg、Ca2+10mg,它们的物质的量浓度各为多少?•解:LmolVncNaNa/142.01000/10023/1000/326LmolVncCaCa/0025.01000/10040/1000/1022二、质量浓度•符号:ρB•定义:物质B的质量除以溶液的体积ρB=•单位:SI单位:kg/m3,医学上常用单位:g/L、mg/L和μg/LVmB•例1-3•临床上“乳酸钠注射液的浓度是112g/L”、“生理盐水的浓度是9g/L”、“葡萄糖注射液的浓度是50g/L”……•都指的是质量浓度。•注意:ρB和ρ的区别。•WHO建议:在绝大多数情况下推荐在注射液的标签上同时写明质量浓度和物质的量浓度;•表示体液组成时,凡是已知相对分子质量的物质,均应使用物质的量浓度;对于少数相对分子质量尚未准确测定的物质,可使用质量浓度•质量浓度与物质的量浓度之间的关系:nB=cB·V,mB=nB·MB=cB·V·MB,可得:mB/V=cB·MB,即:ρB=cB·MB三、质量分数•符号:ωB•定义:物质B的质量除以溶液的质量,ωB=mB/m•单位:1或不写•物质B和溶液的质量单位必须相同,量值很小时可例外,可用小数或百分数表示四、体积分数•符号:•定义:物质B的体积除以混合物的体积,=VB/V•单位:1或不写,可用百分数表示•医学上当溶质B为液体的溶液的组成常用体积分数表示,如消毒酒精的体积分数为75%,药用酒精的体积分数为95%BB五、分子浓度•符号:CB•定义:物质B的分子数除以溶液的体积,CB=NB/V•单位:SI单位:m-3,医用单位:L-1•临床上常用分子浓度表示体液中细胞的含量(一)扩散现象定义:一种物质的微粒自发地向另一种物质中分散的现象动力:浓度差原因:分子的热运动特点:自发性和无方向性第二节稀溶液的渗透压一、渗透现象和渗透压(二)渗透现象·半透膜:膜上的孔只允许部分分子或离子透过而不允许部分分子物质透过的薄膜·渗透现象:溶剂小分子透过半透膜进入溶液的单方向扩散现象·产生渗透现象必须具备两个条件:一:有半透膜存在二:半透膜两侧存在浓度差··渗透平衡:水分子进出半透膜的速率相等的动态平衡·恰能阻止渗透现象继续发生而达到动态平衡的压力即为渗透压(三)渗透压渗透压压力计·若要使膜内溶液与膜外纯溶剂的液面相平,必须在溶液液面上施加一个额外压力,这个压力就是该溶液的渗透压·定义:恰能阻止渗透现象继续发生而达到动态平衡的压力,即为了阻止渗透现象的发生而施加于溶液液面上的额外压力符号:ΠSI单位:Pa或kPa·用半透膜将一种稀溶液和浓溶液隔开,也会发生渗透现象,其方向为从稀溶液到浓溶液。此时要阻止渗透进行,需在浓度较高的溶液液面上施加一额外压力,此压力为两种溶液渗透压的差值二、渗透压与浓度、温度的关系·稀溶液的渗透压力定律:Π=cBRT=·一定温度下稀溶液的渗透压的大小只与单位体积中溶质的质点数目有关,与溶质的本性无关VRTnB·电解质的稀溶液渗透压公式中须引进一个校正系数i,即:Π=icBRTi在数值上等于1mol电解质能够电离出的离子的物质的量。如i(NaCl)=2i[Ca(OH)2]=3·可以利用渗透压公式来测定和计算大分子的相对分子质量:MB=VRTmB例1-4将10g某大分子物质溶于1L水中配成溶液,测得27℃时溶液的渗透压为0.37kPa,求这个大分子的相对分子质量。三、渗透压在医学上的意义(一)渗透浓度·渗透活性物质:溶液中能产生渗透效应的溶质粒子·渗透浓度:溶液中渗透活性物质的总浓度,用cos表示,其常用单位为mol/L和mmol/L·对于非电解质稀溶液,渗透浓度与物质的量浓度相等·对于强电解质稀溶液,渗透浓度等于溶液中离子的总浓度,即校正系数i与浓度的乘积解:c(葡萄糖)=ρ(葡萄糖)/M(葡萄糖)∵葡萄糖是非电解质∴cos(葡萄糖)=c(葡萄糖)c(NaCl)=ρ(NaCl)/M(NaCl)∵1molNaCl能电离出2mol离子∴cos(NaCl)=2×c(NaCl)例1-5、计算50g·L-1葡萄糖溶液和9g·L-1生理盐水的渗透浓度·医学上以正常人血浆的渗透压或渗透浓度为标准来衡量溶液渗透压的相对高低等渗溶液:280mmol/L320mmol/L(二)等渗、低渗和高渗溶液ÆÆÁÑÕý³£ÖåËõµÍÉøµÈÉø¸ßÉø´óÁ¿´óÁ¿不同浓度NaCl溶液对红细胞的影响(三)晶体渗透压和胶体渗透压·血浆渗透压的组成晶体渗透压(约766kPa)+胶体渗透压(约4kPa)¾§ÌåÉø͸ѹ½ºÌåÉø͸ѹϸ°ûĤëϸѪ¹Ü±Úϸ°ûÄÚÒºÍâҺѪҺ×éÖ¯¼äÒºÉø͸ѹÉý¸ßÉø͸ѹ½µµÍÉø͸ѹ½µµÍ



















