




《化学必修二《第二节 化学能与电能》PPT课件》是由用户上传到老师板报网,本为文库资料,大小为3.12 MB,总共有45页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 45页
- 3.12 MB
- VIP模板
- ppt
- 数字产品不支持退货
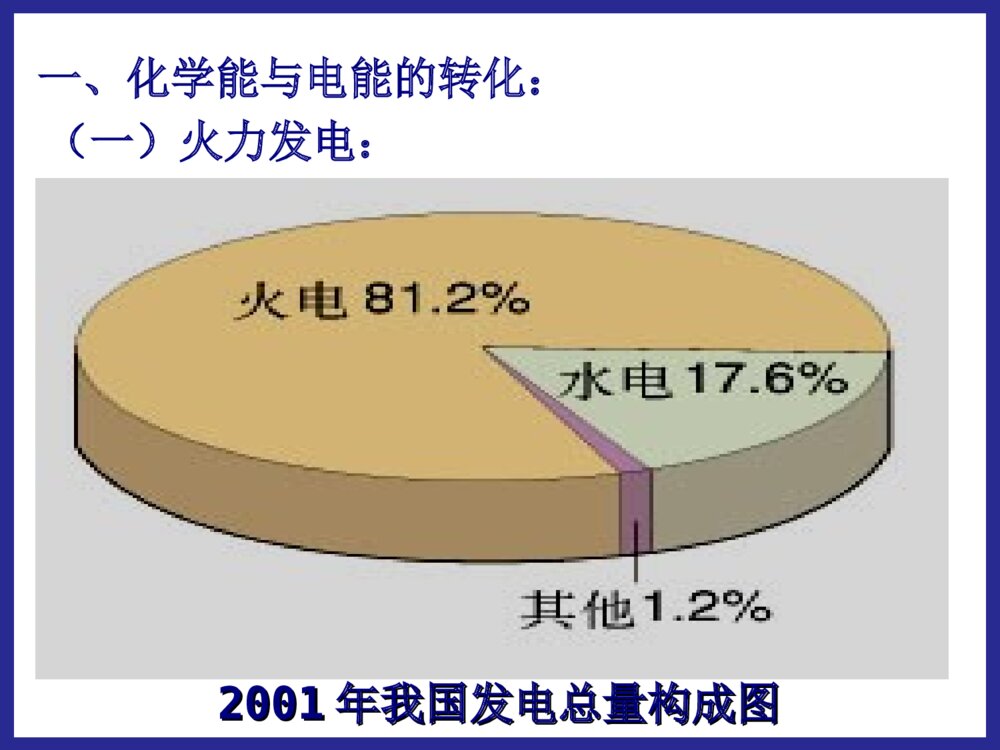
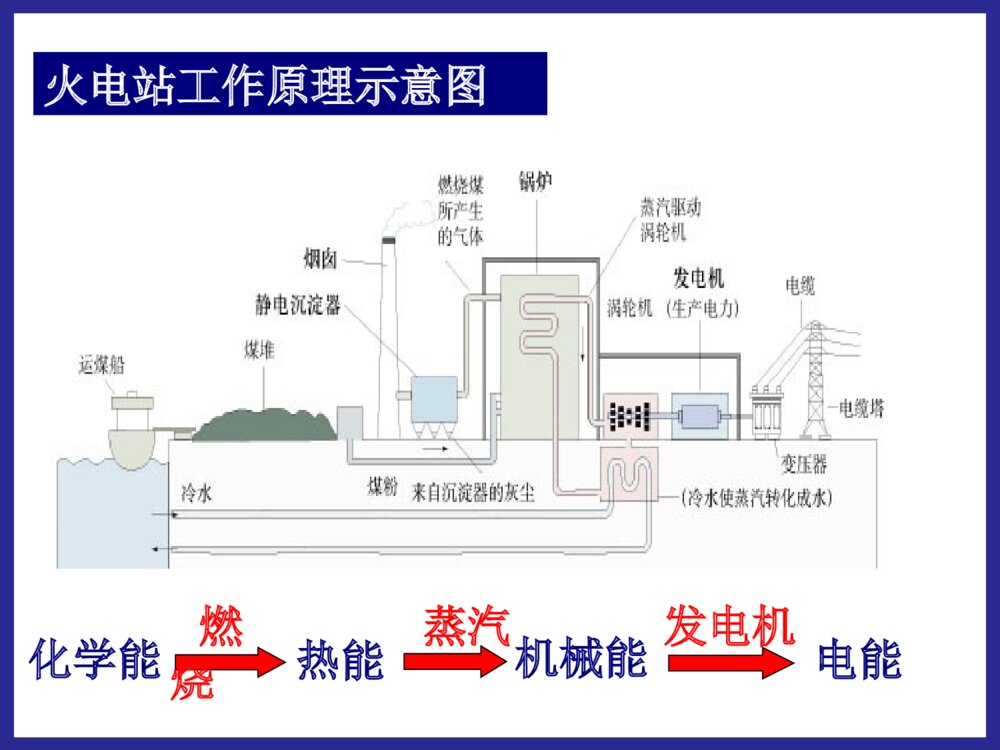
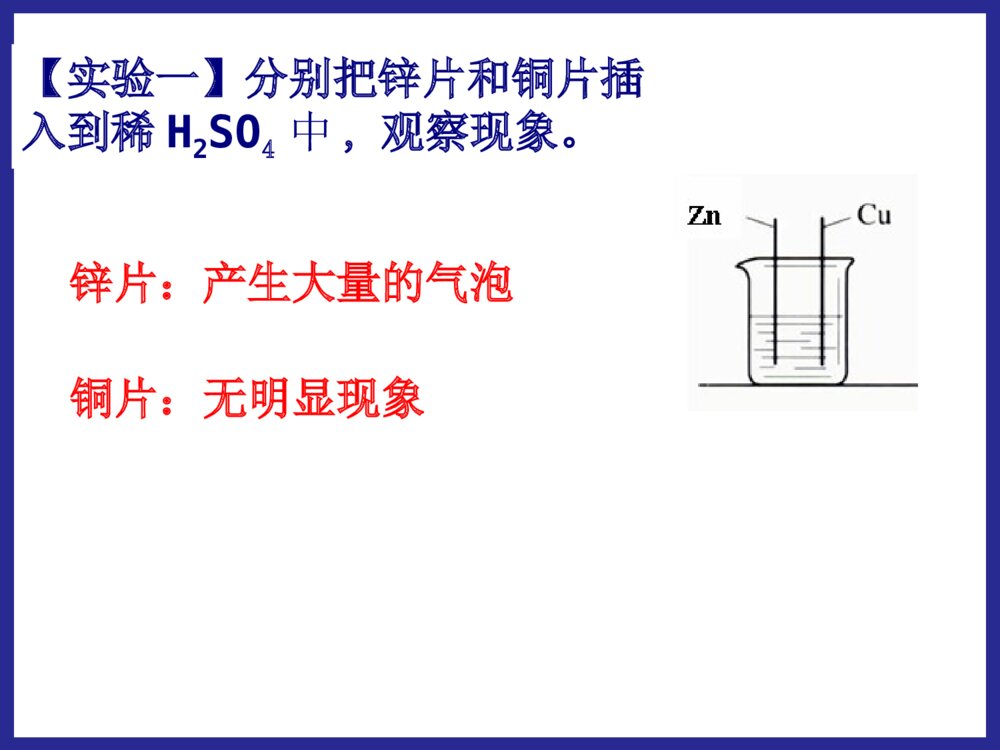
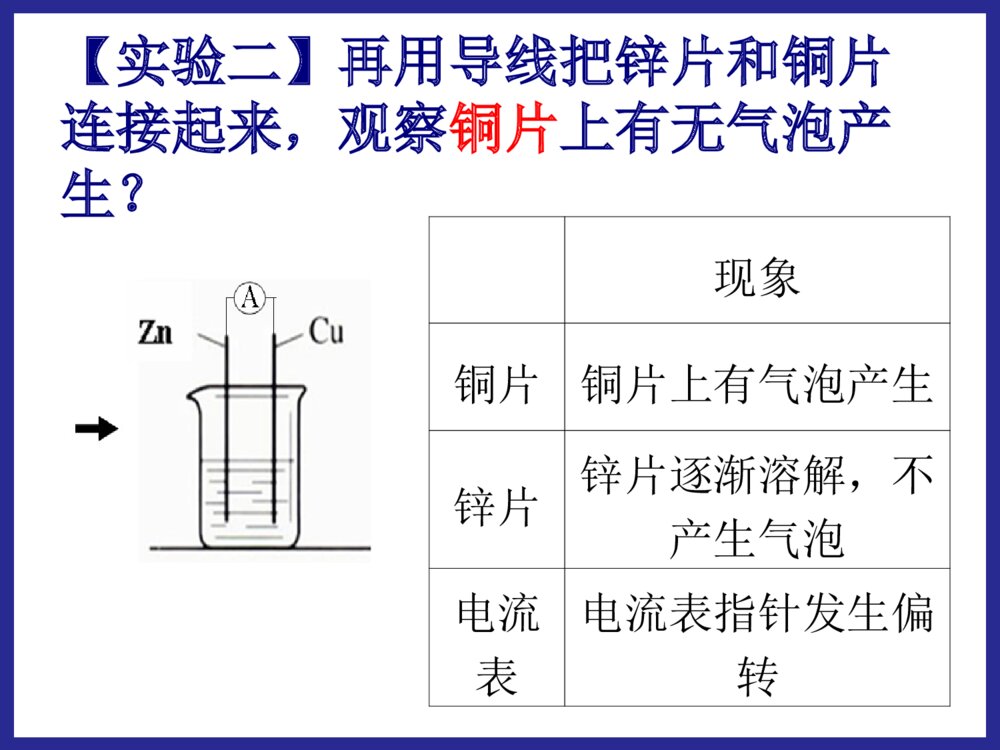
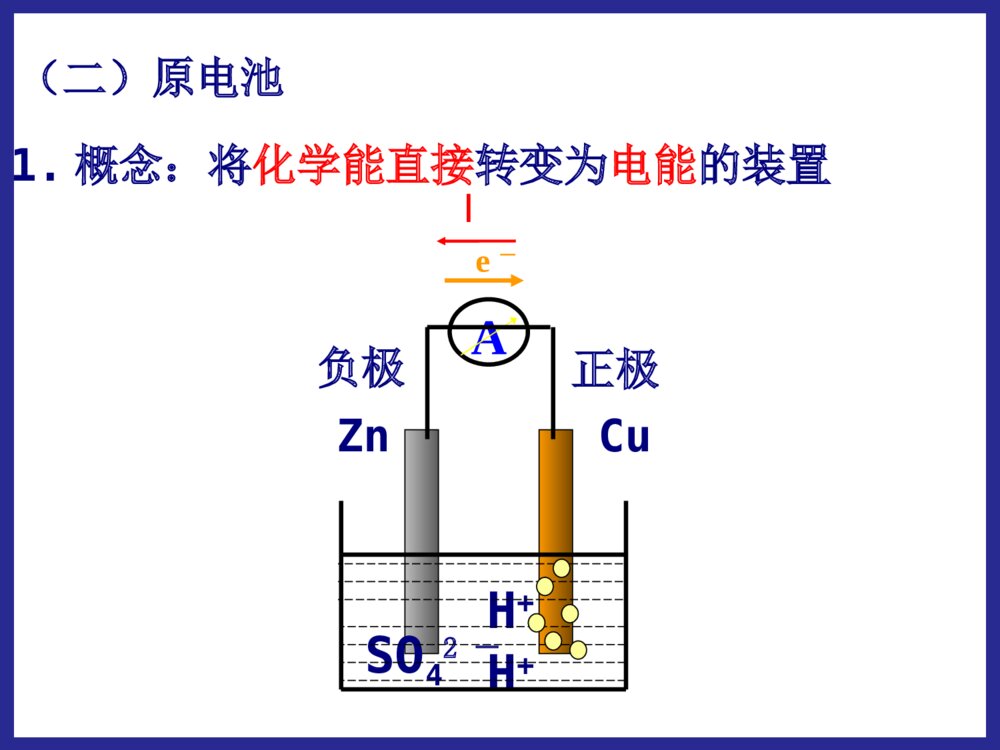
化学反应中的能量变化第二节第二节化学能与电化学能与电能能学习目标:1.掌握原电池的形成条件,理解原电池的工作原理;2.能够正确地判断原电池的两极,能够正确地书写电极反应及总反应;3.了解常见化学电源的种类及特点,能够认识和书写几种新型电池的电极及电极反应。 能源:流水风力石油天然气蒸汽电力原煤能源的分类:直接从自然界取得的能源。一次能源经过加工、转换得到的能源。如:风力、原煤、天然气、石油、流水。如:电力,蒸汽。一次能源:二次能源:20012001年我国发电总量构成图年我国发电总量构成图一、化学能与电能的转化:(一)火力发电:火电站工作原理示意图化学能燃烧热能蒸汽机械能发电机电能火力发电有什么优点和缺点我国煤炭资源丰富,廉价方便存在优点电能清洁安全快捷方便、节省时间存在缺点煤炭资源毕竟有限、非可再生排出大量温室效应气体可能导致酸雨并且有废气能量转化效率低有一定局限性问:如何把化学能直接转化为电能呢?思考与交流【实验一】分别把锌片和铜片插入到稀H2SO4中,观察现象。锌片:产生大量的气泡铜片:无明显现象【实验二】再用导线把锌片和铜片连接起来,观察铜片上有无气泡产生?现象铜片铜片上有气泡产生锌片锌片逐渐溶解,不产生气泡电流表电流表指针发生偏转(二)原电池1.概念:将化学能直接转变为电能的装置AZnCuSO42-H+H+正极负极e-I2.原电池的电极反应:锌片:铜片:Zn-2e-=Zn2+2H++2e-=H2↑电池反应:Zn+2H+=Zn2++H2↑氧化反应还原反应(总反应)(负极)(正极)铜锌原电池的工作原理:锌失去的电子通过外电路流向铜片,H+在铜片上得到电子,从而形成电流。12Zn-2e-=Zn2+2H++2e-=H2还原剂(Zn)失去电子,发生氧化反应氧化剂(H+)在铜极上得到电子,发生还原反应还原剂失去的电子从锌极流出流入铜极.经外电路Zn2+H+SO42-电流方向原电池工作原理原电池工作原理:实现了由化学能到电能的转化。[固本自测]1.如图所示的装置中,在产生电流时,以下说法不正确的是()A.Fe是负极,C是正极B.负极反应式为Fe-3e-===Fe3+C.内电路中阴离子移向FeCl2溶液D.电流由石墨电极流向Fe电极B跟踪练习4.原电池本质氧化还原反应①反应类型。负极发生氧化反应,正极发生还原反应。②电子的移动方向。从负极流出,经导线流向正极。③离子的移动方向。阳离子向正极移动,阴离子向负极移动。(可以)(可以)(不可以)第一组实验探究形成原电池的条件:第二组实验(可以)(不可以)第三组实验(可以)(不可以)原电池的形成条件(4)形成闭合回路。(两电极用导线连接,或接触。)(1)能自发地发生的氧化还原反应:①电极和电解质溶液②两电极上分别有还原剂和氧化剂(燃料电池)(2)电解质溶液:参与电极反应或构成内电路(3)两导体作电极:①活动性不同的金属(或一种金属和一种非金属导体石墨),与电解质溶液反应的活泼金属为负极。②两不活泼的导体-石墨或Pt等。(燃料电池电极)酒精CuH2SO4溶液ZnAgH2SO4溶液ZnCuZnSO4溶液CuSO4溶液ZnCu盐桥ZnSO4溶液CuSO4溶液FeCu下列装置是否能构成原电池?∨∨1.判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.(∨)2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑练习:(∨)正极:负极:总反应:Fe-2e-=Fe2+2Ag++2e-=2AgFe+2Ag+=Fe2++2Ag3.判断下面装置是否可以组成原电池,如果可以请写出电极反应和总反应。 如图Ⅰ所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地往烧杯中央滴入CuSO4溶液。 片刻后可观察到的现象是________。 A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变 C.铁圈向下倾斜 D.银圈向下倾斜 D原电池的正负极的判断方法微观判断(根据电子流动方向)电子流出的极电子流入的极——负极——正极较活泼的电极材料较不活泼的电极材料质量增加的电极工作后质量减少的电极——负极——正极——正极——负极工作后,有气泡冒出的电极为正极发生氧化反应的极发生还原反应的极宏观判断:①根据电极材料②根据原电池电极发生的反应③根据电极增重还是减重④根据电极有气泡冒出:——负极——正极方法四【小结】二.原电池的构成:一.原电池:把化学能转化为电能的装置1.可自发发生的氧化还原反应2.两个电极两个电极3.内部有离子导电体(通常是电解质溶液)4.形成闭合电路三.原电池的工作原理:四.原电池正负极的判断方法:练习1:Zn片,Ag片,AgNO3溶液为组装材料,设计原电池。设计原电池:利用下述反应:2FeCl3+Fe=3FeCl2设计一个原电池装置。①画出装置图;②标明电极材料和电解质溶液;③写出电极反应式。负极(Fe):2Fe-2e-=Fe2+正极(C):2Fe3++2e-=2Fe2+练习2:(先写出离子反应)练习有A、B、C、D四种金属分别浸入稀H2SO4中,A、B产生气泡缓慢而C、D产生气泡较激烈;把A、B两种金属用导线连接后浸入稀H2SO4中,气泡从A金属表面析出,把C、D两种金属用导线连接后浸入稀H2SO4中组成原电池,电流由C→D,根据实验现象,可知A、B、C、D四种金属的活动性顺序。DD>>CC>>BB>>AA二、发展中的化学电源:干电池碱性电池蓄电池锂电池1、干电池干电池是一种伏打电池,利用某种吸收剂(如木屑或明胶)使内含物成为不会外溢的糊状。常用作手电筒照明、收音机等的电源。酸性锌锰干电池是最早进入市场的实用电池(1)普通锌锰干电池优点:制作简单、价格便宜。缺点:放电时间短,电压下降快。(2)碱性干电池碱性电池是个人音响、照相机等地首选电源。碱性电池电解液:酸性NH4Cl→碱性KOH(离子导电性更好)负极:锌片→锌粉(反应面积成倍增长,使放电电流大幅度提高)优点:比能量和储存时间有所提高,适用于大电流和连续放电二、发展中的化学电源1.1.干电池干电池((11)一次性电池:)一次性电池:((22)普通锌锰电池:)普通锌锰电池:Zn-2eZn-2e--=Zn=Zn2+2+((33)碱性锌锰电池:)碱性锌锰电池:[课本P39]、[设计P43]NHNH44ClCl负极负极??正极正极??电解质:电解质:缺点:缺点:Zn-2eZn-2e--+2OH+2OH--=Zn(OH)=Zn(OH)22KOHKOH负极负极??正极正极??电解质:电解质:优点优点::使用寿命短,易泄漏使用寿命长,不易泄漏((44)应用:)应用:卡式录音机、闪光灯、电动玩具、袖珍电视机等卡式录音机、闪光灯、电动玩具、袖珍电视机等放电之后不能充电内部的氧化还原反应是不可逆的2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O2MnO2+2H2O+2e-=2MnO(OH)+2OH-ZnZnCCZnZnCC锌锰电池电极反应:锌锰电池电极反应:负极:正极:Zn–2e-==Zn2+2NH4++2e-==2NH3+H2总反应:Zn+2NH4+=Zn2++2NH3+H2锌-锰干电池在使用过程中,锌会逐渐溶解,锌外壳变薄,最后内部的糊状电解质泄露出来,对电器腐蚀。为了防止泄露,在外壳套上金属筒或塑料筒,制成防漏电池。P42【思考与交流】为什么锌锰干电池放置过久会失效?为了延长电池寿命和提高其性能,人们将电池内的电解质换成湿的,制成了电池。NH4ClKOH碱性锌锰负极:Zn+2OH-–2e-==Zn(OH)22、充电电池22、充电电池:、充电电池:氧化还原反应在氧化还原反应在充电充电时可以时可以逆向逆向进行。进行。11、充电电池又称二次电池,能够重复使用至一定的周期。、充电电池又称二次电池,能够重复使用至一定的周期。手机专用电池摄像机专用电池笔记本电脑专用电池化学能放电充电电能用途:目前汽车上使用的电瓶大多仍是铅蓄电池,它还广泛用于国防、生产、生活等领域。铅蓄电池:铅蓄电池:最早最早使用的充电电池。使用的充电电池。(1)铅蓄电池特点:铅蓄电池的电压稳定,使用方便安全可靠,可再次充电使用。22、充电电池、充电电池二次电池:二次电池:氧化还原反应在氧化还原反应在充电充电时时可以可以逆向逆向进行。进行。铅蓄电池负极?正极?总反应:放电:放电:化学能转化为电能化学能转化为电能充电:充电:电能转化为化学能电能转化为化学能PbOPbO22+Pb+2H+Pb+2H22SOSO442PbSO2PbSO44+2H+2H22OO放电放电充电充电电解质?优缺点:优缺点:应用:应用:可充电,比干电池使用寿命长;但体积大,有污染汽车上使用的电瓶等铅蓄电池:铅蓄电池:放电时:正极材料是负极材料是,电解质是。PbO2PbH2SO4负极:正极:总反应:Pb+SOPb+SO442-2-—2e—2e--==PbSOPbSO44PbOPbO22+4H+4H+++SO+SO442-2-+2e+2e--==PbSOPbSO44+2H+2H22OOPbOPbO22+Pb+2H+Pb+2H22SOSO442PbSO2PbSO44+2H+2H22OO放电放电充电充电②②镍镉充电电池:镍镉充电电池:负极:负极:正极:正极:电解质:电解质:优缺点:优缺点:应用:应用:CdNiO(OH)KOH具有残留性记忆,可重复使用500次以上,体积小;但镉有致癌作用,如不回收,会产生严重污染广泛用于收录机、无线对讲机、电子闪光灯、电动剃须刀等镍镉电池镉有致癌作用,有被镍氢电池取代的趋势。锂离子电池锂离子电池是新一代可充电的锂离子电池是新一代可充电的绿色电池绿色电池。。特点:高能电池,电压高,质量轻,贮存时间长等。用途:现已成为笔记本电脑、移动电话、摄像机、手表、现已成为笔记本电脑、移动电话、摄像机、手表、心脏起搏器心脏起搏器等低功耗电器的主流。等低功耗电器的主流。笔记本电脑专用电池锂电池(有机溶剂电解液)负极:2Li-2e—=2Li+正极:I2+2e—=2I—总反应:2Li+I2=2LiI跟相同质量的其它金属作负极相比,使用寿命延长,高能、质轻、电压高、工作效率高、储存寿命长。发展中的电池发展中的电池3、燃料电池——高效、环境友好的化学电池它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等。(例如:H2和O2的燃料电池,CH4和O2的燃料电池)燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。小型高性能燃料电池氢氧燃料电池工作原理:总反应:2H2+O2=2H2O通入的气体在电极表面放电,电池只是作为一个反应器。与其它电池区别:反应物不是储存在电池内。用途:氢氧燃料电池目前已应用于航天、军事通讯、电视中继站等领域介质电池反应:2H2+O2=2H2O酸性(H2SO4)负极正极中性负极正极碱性(KOH)(记这个)负极正极2H2-4e-=4H+O2+4e-+2H2O=4OH-2H2-4e-=4H+O2+4e-+4H+=4H2O2H2-4e-+4OH-=4H2OO2+4e-+2H2O=4OH-**氢氧燃料电池的电极反应氢氧燃料电池的电极反应一定要会判断:酸性有H+(肯定没OH-);碱性有OH-(肯定没H+)⑵甲烷氧气燃料电池该电池用铂片插入KOH溶液中作电极,在两极上分别通甲烷和氧气负极:正极:放电总反应式:CH4+10OH——8e—=CO32—+7H2O2O2+4H2O+8e—=8OH—CH4+2O2+2KOH=K2CO3+3H2O⑶Al—空气—海水电池负极:正极:放电总反应式:4Al—12e—=4Al3+3O2+6H2O+12e—=12OH—4Al+3O2+6H2O=4Al(OH)346钢铁的析氢腐蚀和吸氧腐蚀比较析氢腐蚀吸氧腐蚀条件水膜呈酸性水膜呈中性或酸性很弱电极反应负极FeFe-2e-=Fe2+2Fe-4e-=2Fe2+正极C2H++2e-=H2↑O2+2H2O+4e-=4OH-总反应:Fe+2H+=Fe2+H2↑2Fe+2H2O+O2=2Fe(OH)2电化学腐蚀两种类型电化学腐蚀两种类型



















