







《高中化学《化学反应的焓变》PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为482.5 KB,总共有26页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 26页
- 482.5 KB
- VIP模板
- ppt
- 数字产品不支持退货
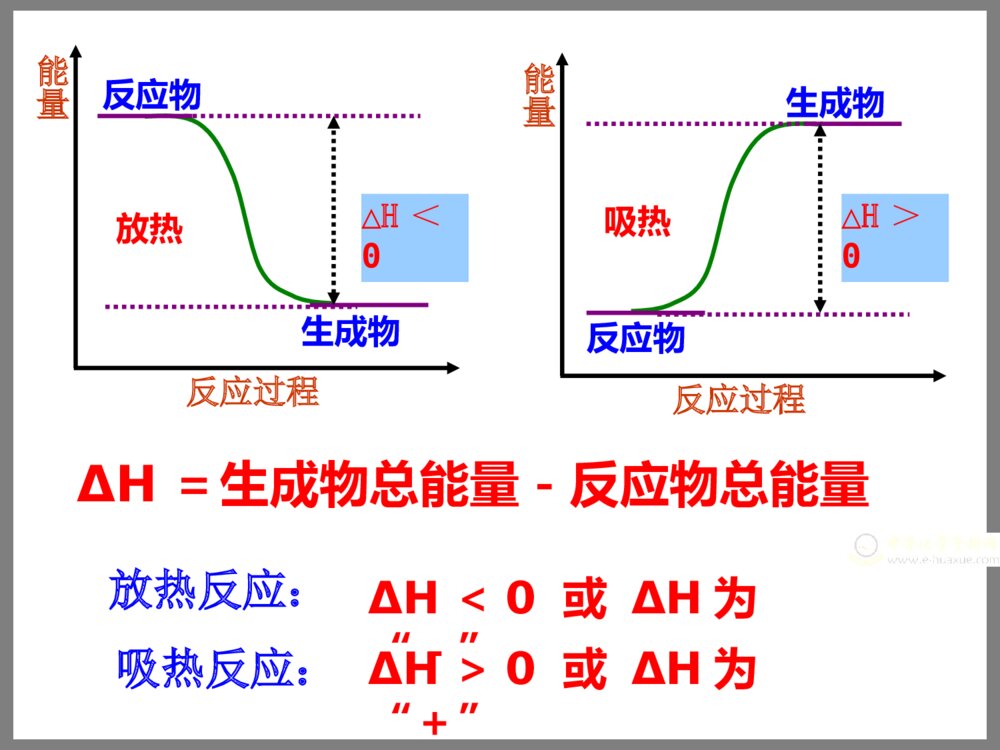
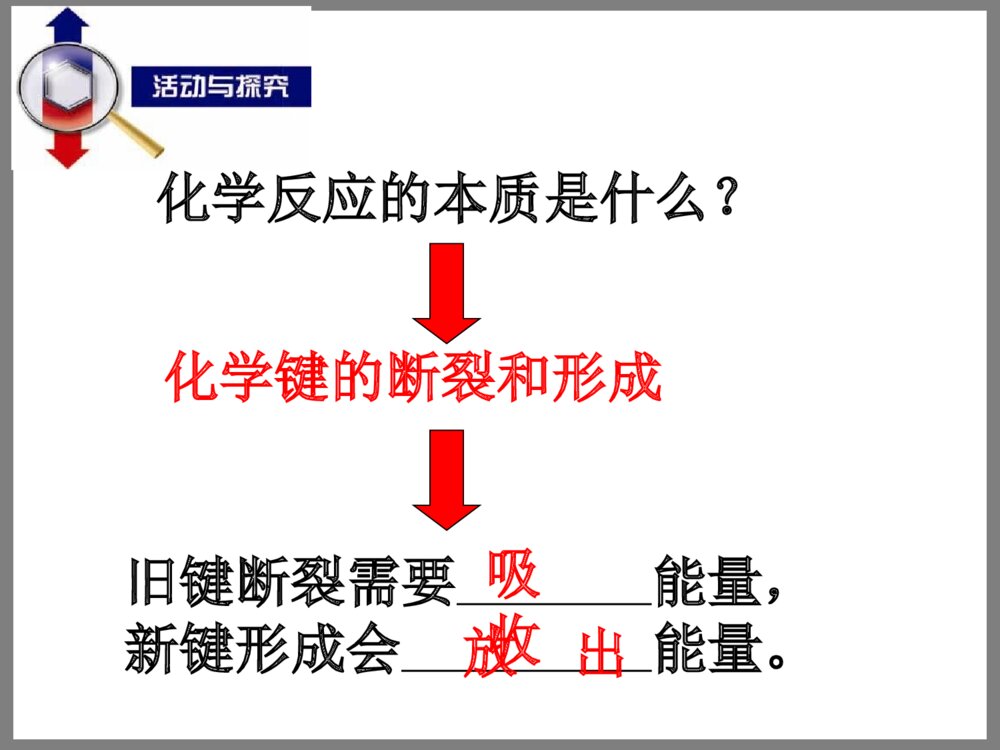
第一单元化学反应的热效应——化学反应的焓变专题1化学反应与能量变化【复习回顾】:在我们以前所学的化学反应中有哪些是放热反应?有哪些是吸热反应?常见的放热反应:所有的燃烧反应所有的中和反应活泼金属与水、酸的反应多数的化合反应C+CO22CO△N2+O22NO放电以下特殊的化合反应是吸热反应:常见的吸热反应:所有的电离过程所有的水解反应水煤气的生成反应、炭与二氧化碳生成一氧化碳氯化铵固体与氢氧化钡晶体的反应多数的分解反应Ba(OH)2+2NH4ClBaCl2+2NH3↑+2H2OBa(OH)2·8H2O+2NH4ClBaCl2+2NH3↑+10H2OC+H2O(g)CO+H2高温一、反应热焓变1.定义:化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为化学反应的反应热。符号:ΔH,单位:kJ/mol或kJ•mol-1在恒温、恒压的条件下,化学反应过程中吸收或释放的热量称为反应的焓变。化学反应中为什么会有能量的变化?宏观:反应物和生成物所具有的能量不同.放热反应:ΔH<0或ΔH为“-”ΔH>0或ΔH为“+”放热反应物生成物能量反应过程△H<0ΔH=生成物总能量-反应物总能量吸热反应物生成物能量反应过程△H>0吸热反应:微观:旧的化学键断裂时所吸收的能量与新的化学键形成时所放出的能量不同.化学反应的本质是什么?化学键的断裂和形成旧键断裂需要能量,新键形成会能量。放出吸收结论:一个化学反应是放热还是吸热取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小观察下列示意图:1、从该图你获得什么信息?2、你能计算出该反应过程中能量的变化为多少吗?ΔH=反应物总键能-生成物总键能从键能角度看:ΔH=[436kJ/mol+243kJ/mol]-431kJ/mol×2=-183kJ/mol小结:△△H=H=生成物总能量生成物总能量--反应物总能量反应物总能量△△H=H=反应物总键能反应物总键能--生成物总键能生成物总键能宏观:微观:【交流与讨论】:二、热化学方程式观察以上热化学方程式,分析其与普通的化学方程式有何不同?H2(g)+Cl2(g)=2HCl(g)=-184.6kJ/molHCH4(g)+2O2(g)=CO2(g)+2H2O(l)=-890.3kJ/molHNaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)=-57.3kJ/molHH2(g)+I2(g)======2HI(g)△H=-14.9kJ/mol热化学方程式包含物质变化和能量变化两个部分,二者缺一不可.普通化学方程式只包含物质变化一个部分.物质变化能量变化定义:表示反应热的化学方程式叫热化学方程式H2(g)+I2(g)======2HI(g)△H=-14.9kJ/mol200℃101kPa1.热化学方程式需注明反应时的温度和压强.对于25℃、101kPa时进行的反应可不注明.普通化学方程式不需注明温度和压强.H2(g)+O2(g)==H2O(g)△H=-241.8kJ/mol122.热化学方程式需注明各物质的状态.普通化学方程式不需注明物质的状态.H2(g)+O2(g)==H2O(g)△H=-241.8kJ/mol12H2(g)+O2(g)==H2O(l)△H=-285.8kJ/mol12H2O(g)==H2O(l)H2O(l)==H2O(g)△H=-44kJ/mol△H=+44kJ/mol3.热化学方程式中化学计量数表示参加反应的各物质的物质的量,可为整数或分数.普通化学方程式中化学计量数表示原子、分子数目,只能为整数,不能为分数.H2(g)+O2(g)==H2O(g)△H=-241.8kJ/mol12H2(g)+O2(g)==H2O(l)△H=-285.8kJ/mol12书写热化学方程式的注意点:1.需注明反应的温度和压强(如在25℃、101kPa下进行的反应,可不注明).2.应注明反应物和生成物的状态.3.对于相同的反应,当化学计量数不同时,其△H不同.H2(g)+O2(g)==H2O(g)△H=-241.8kJ/mol12H2(g)+O2(g)==H2O(l)△H=-285.8kJ/mol122H2(g)+O2(g)==2H2O(g)△H=-483.6kJ/mol练习:A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)H=△-4bkJ/molB.C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)H=+2bkJ/mol△C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)H=△-2bkJ/molD.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)H=+bkJ/mol△1.已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是()A2.下列说法中正确的是()A.需要加热方能发生的反应一定是吸热反应B.放热的反应在常温下一定很容易发生C.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小D.吸热反应在一定的条件下也能发生CD3.下列反应属于吸热反应的是()A.C6H12O6(葡萄糖aq)+6O26CO2+6H2OB.CH3COOH+KOHCH3COOK+H2OC.A+BC+D△H<0D.破坏生成物全部化学键所需能量小于破坏反应物全部化学键所需能量酶D4.同温同压下,下列各组热化学方程式中Q2>Q1的是A.2H2(g)+O2(g)=2H2O(g),△H1=-Q1kJ·mol-1;2H2(g)+O2(g)=2H2O(l),△H2=-Q2kJ·mol-1;B.S(g)+O2(g)=SO2(g),△H1=-Q1kJ·mol-1;S(s)+O2(g)=SO2(g),△H2=-Q2kJ·mol-1;C.C(s)+O2(g)=CO(g),△H1=-Q1kJ·mol-1;C(s)+O2(g)=CO2(g),△H2=-Q2kJ·mol-1;D.H2(g)+Cl2(g)=2HCl(g),△H1=-Q1kJ·mol-1;H2(g)+Cl2(g)=HCl(g),△H2=-Q2kJ·mol-1121212AC高低物质所具有的总能量2A(g)+B(g)2C(g)5.分析右面的能量变化示意图,下列热化学方程式正确的是()A.2A(g)+B(g)=2C(g);△H=a(a>0)B.2A(g)+B(g)=2C(g);△H=a(a<0)C.2A+B=2C;△H=a(a<0)D.2C=2A+B;△H=a(a>0)B6、化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol1):P—P:198P—O:360O=O:498则反应P4(s,白磷)+3O2(g)=P4O6(s)的焓变△H为()A.-1638kJ·mol1B.+1638kJ·mol1C.-126kJ·mol1D.+126kJ·mol1A



















