




《高三化学一轮复习原电池PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为2.18 MB,总共有26页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 26页
- 2.18 MB
- VIP模板
- ppt
- 数字产品不支持退货
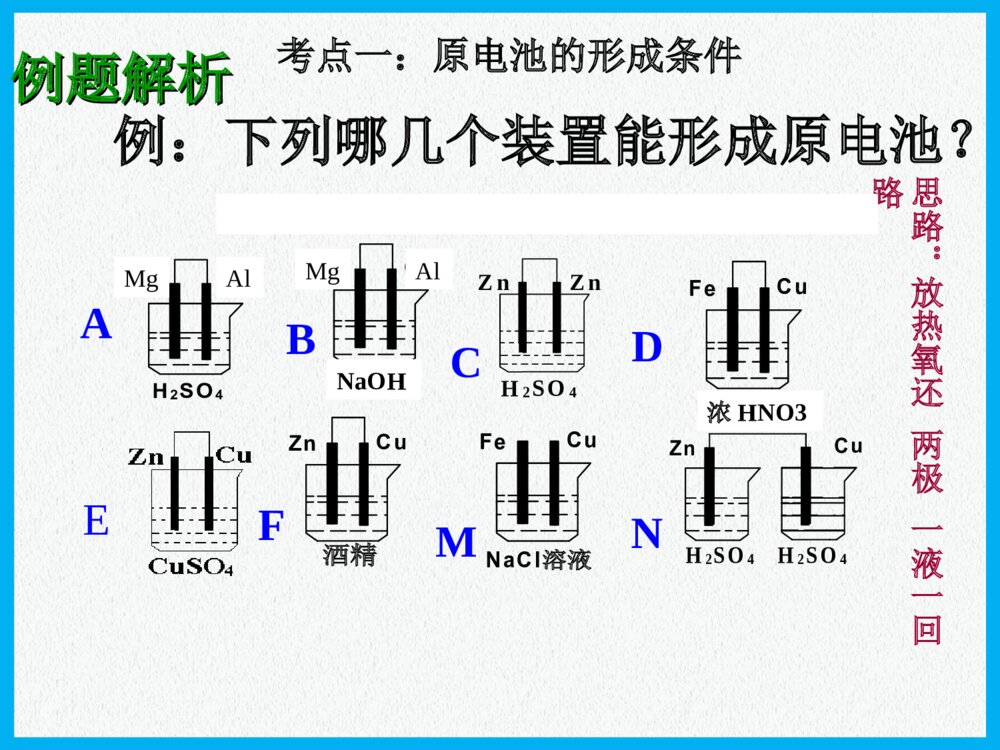
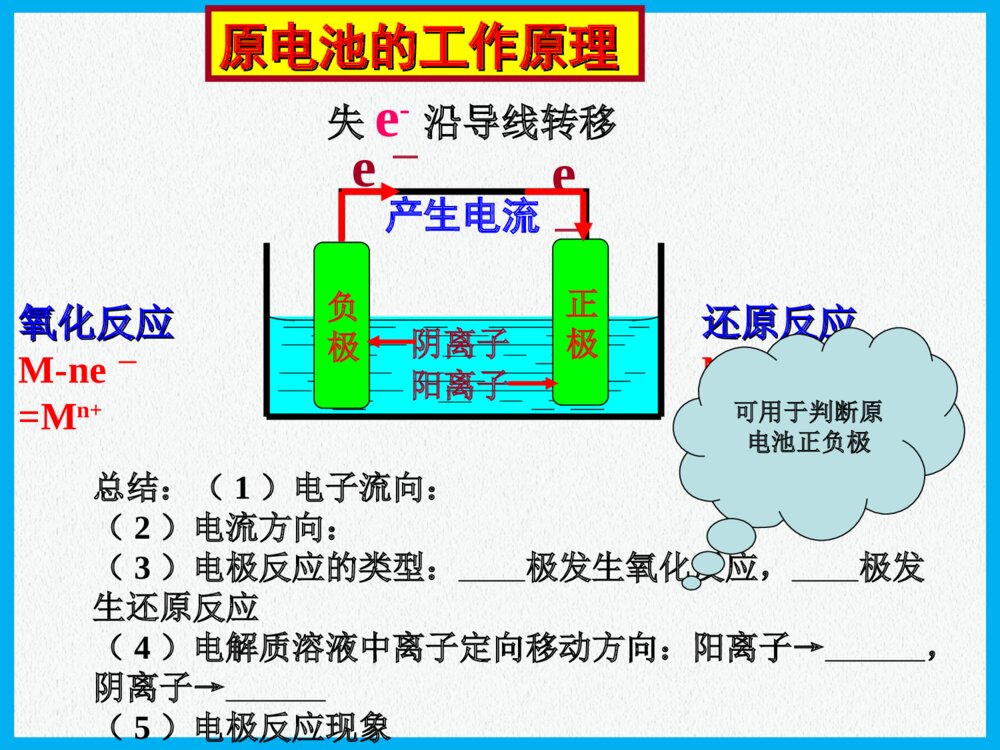
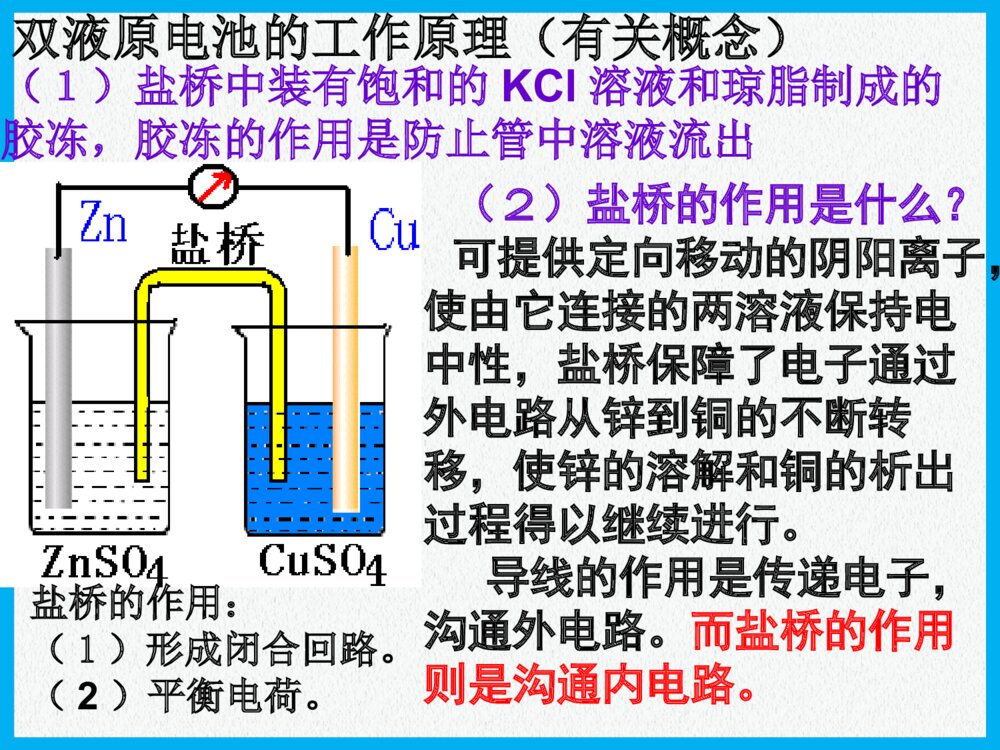
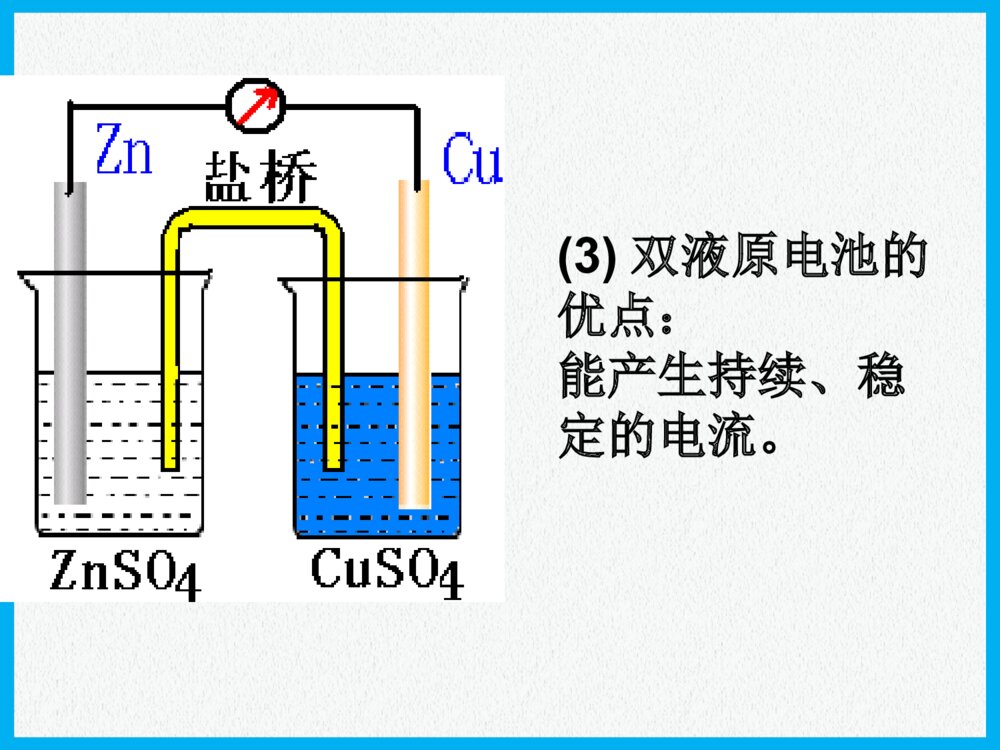
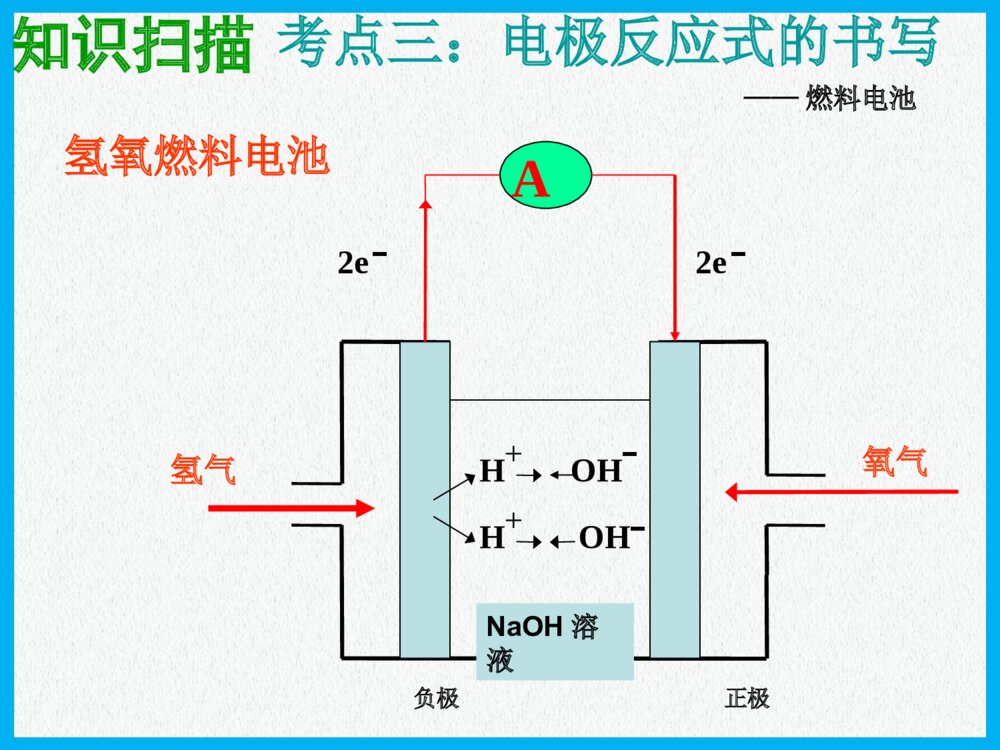
化学反应与能量原电池高三化学一轮复习普通干电池手机电池钮扣电池“神六”用太阳能电池海水电池考纲要求:1.掌握原电池的工作原理和形成条件 能写出电极反应和电池反应式2.了解原电池原理在生产生活中的应用例:下列哪几个装置能形成原电池?ABCDEFMNCuFeNaCl溶液例题解析例题解析CuFeH2SO4CuZnH2SO4CuFeNaCl溶液CuZn酒精CuZnH2SO4H2SO4nZnZ4OS2H考点一:原电池的形成条件思路:放热氧还两极一液一回路MgAlMgAlNaOH浓HNO3氧化反应氧化反应M-ne-=Mn+产生电流失e-沿导线转移还原反应还原反应Nm++me-=N原电池的工作原理原电池的工作原理负极正极阴离子阳离子e-e-总结:(1)电子流向:(2)电流方向:(3)电极反应的类型:极发生氧化反应,极发生还原反应(4)电解质溶液中离子定向移动方向:阳离子→,阴离子→(5)电极反应现象可用于判断原电池正负极例1:(2007全国Ⅱ理综)在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是()A.正极附近的SO42―离子浓度逐渐增大B.电子通过导线由铜片流向锌片C.正极有O2逸出D.铜片上有H2逸出CuZn稀硫酸E.铜是阳极,铜片上有气泡产生F.铜片质量逐渐减少G.电流从锌片经导线流向铜片H.氢离子在铜片表面被还原DH例题解析例题解析考点一:原电池的工作原理递进题组原电池正、负极的判断1.下列有关原电池的说法中正确的是()A.在内电路中,电子由正极流向负极B.在原电池中,相对较活泼的金属作负极,不活泼的金属作正极C.原电池工作时,正极表面一定有气泡产生D.原电池工作时,可能会伴随着热能变化D(2)盐桥的作用是什么?可提供定向移动的阴阳离子,使由它连接的两溶液保持电中性,盐桥保障了电子通过外电路从锌到铜的不断转移,使锌的溶解和铜的析出过程得以继续进行。导线的作用是传递电子,沟通外电路。而盐桥的作用则是沟通内电路。双液原电池的工作原理(有关概念)(1)盐桥中装有饱和的KCl溶液和琼脂制成的胶冻,胶冻的作用是防止管中溶液流出盐桥的作用:(1)形成闭合回路。(2)平衡电荷。(3)双液原电池的优点:能产生持续、稳定的电流。氢氧燃料电池2e-2e-氢气氧气H2OHH++OHOH--A负极正极知识扫描考点三:电极反应式的书写稀H2SO4NaOH溶液——燃料电池介质总反应:2H2+O2=2H2O酸性负极正极中性负极正极碱性负极正极H2-2e-=2H+O2+2H2O+4e-=4OH-H2-2e-=2H+O2+4H++4e-=2H2OH2-2e-+2OH-=2H2OO2+2H2O+4e-=4OH-知识扫描电极反应式的书写(燃料电池)例:据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.试写出该电池放电时的电极反应和总反应式.考点三:电极反应式的书写知识扫描 2CH3OH+3O2=2CO2+4H2O2CH3OH+3O2+4OH-=2CO32-+6H2OCH3OH-6e-+8OH-=CO32-+6H2OO2+2H2O+4e-=4OH-燃烧反应式:电池总反应:正极:负极:(2011年辽宁省高考理综卷)在直接以甲醇为燃料的燃料电池中,电解质溶解为酸性,负极的反应式为_____________________,正极的反应为_________________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1KJ,则该燃料的电池的理论效率为__________。(燃料电池的理论效率是指电池所能产生的最大电能与燃料电池反应所能释放的全部能量之比)。已知CH3OH的燃烧热△H=-726.5KJ/molCH3OH+H2O-6e-=CO2+6H+O2+4H++4e-=2H2O96.6%(2006重庆理综)铅蓄电池是典型的可充型电池,正负极板是惰性材料,电池总反应式:Pb+PbO2+4H++2SO42-2PbSO4+2H2O请回答下列问题:放电时:正极的电极反应式是电解液中H2SO4的浓度将;当外电路通过1mol电子时,理论上负极板的质量增加g。放电充电PbO2+2e-+SO42-+4H+=PbSO4+2H2O;(负极:Pb-2e-+SO42-=PbSO4)变小48知识扫描考点三:电极反应式的书写(铅蓄电池)(2013年玉溪模拟)燃料电池的突出优点是将化学能直接转变为电能,而不经过热能这一中间环节,能量利用率高,已应用于宇宙飞船、航空站及潜水中。某氢氧燃料电池可同时供应电和水蒸气,所用燃料为H2,电解质为熔融的K2CO3。已知该电池的正极反应为O2+2CO2+4e-===2CO2-3。下列叙述正确的是()A.放电时CO2-3向正极移动B.放电时OH-向负极移动C.负极反应为H2+CO2-3-2e-===H2O+CO2D.当该电池产生的水蒸气折算成标准状况下的体积为22.4L时,转移的电子为4molC原电池原理广泛应用于科技、生产和生活中,请回答以下问题:肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。肼—空气燃料电池是一种碱性燃料电池,产物无污染,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是______________________________________________;负极的电极反应式是______________________________________________。O2+2H2O+4e-===4OH-N2H4+4OH--4e-===N2↑+4H2O书写原电池的电极反应式应注意以下四点:(1)明确电池的负极反应物是电极本身还是其他物质、反应产物及化合价的变化;(2)确定电池的正极反应物是电解质溶液中的离子,还是其他物质(如溶有或通入的氧气);(3)判断是否存在特定的条件(如介质中的粒子H+、OH-非放电物质参加反应),进而推断电解质溶液的酸碱性的变化;(4)总的反应式是否满足质量守恒、得失电子守恒、电荷守恒。(2013年江苏化学)Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是()A.Mg电极是该电池的正极B.H2O2在石墨电极上发生氧化反应C.石墨电极附近溶液的pH增大D.溶液中Cl-向正极移动C【解析】本题考查原电池原理。在原电池中活泼金属作负极,A错;H2O2具有强氧化性,在反应过程中发生还原反应,B错;石墨电极为电解池的正负,电极反应式为H2O2+2e-===2OH-,电极附近溶液pH增大,C正确;原电池电解质溶液中的阴离子向负极移动,D错。【答案】C(1)影响氧化还原反应的速率一个自发进行的氧化还原反应,设计成原电池时反应速率。(2)比较金属活动性强弱两种金属分别作原电池的两极时,一般作的金属比较活泼。(3)用于金属的防护使被保护的金属作原电池的而得到保护。(4)设计制作化学电源紧扣原电池的构成条件,注意电极材料和电解质溶液的选择增大负极正极考点四原电池的应用知识扫描典例一将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是()A典例二X、Y、Z、W四块金属分别用导线两两相连浸入稀硫酸中组成原电池。X、Y相连时,X为负极;Z、W相连时,电流方向是W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。据此判断四种金属的活动性顺序是()A.X>Z>W>YB.Z>X>Y>WC.X>Y>Z>WD.Y>W>Z>XA典例三根据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)画出原电池示意图并在图中加入电流表,注明电极材料名称和电解质溶液,其中盐桥为琼胶饱和KNO3盐桥。本课小结形成条件工作原理应用比较金属活动性强弱加快化学反应速率金属的腐蚀和防护原电池(四点记住)放热的氧化还原反应活泼性不同的两种金属或金属和非金属导体(石墨)做电极闭合回路电解质溶液电极反应式的书写负极>正极设计制作化学电源



















