







《普通化学原理《第一章 气体、液体、溶液》PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为1.07 MB,总共有38页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 38页
- 1.07 MB
- VIP模板
- ppt
- 数字产品不支持退货
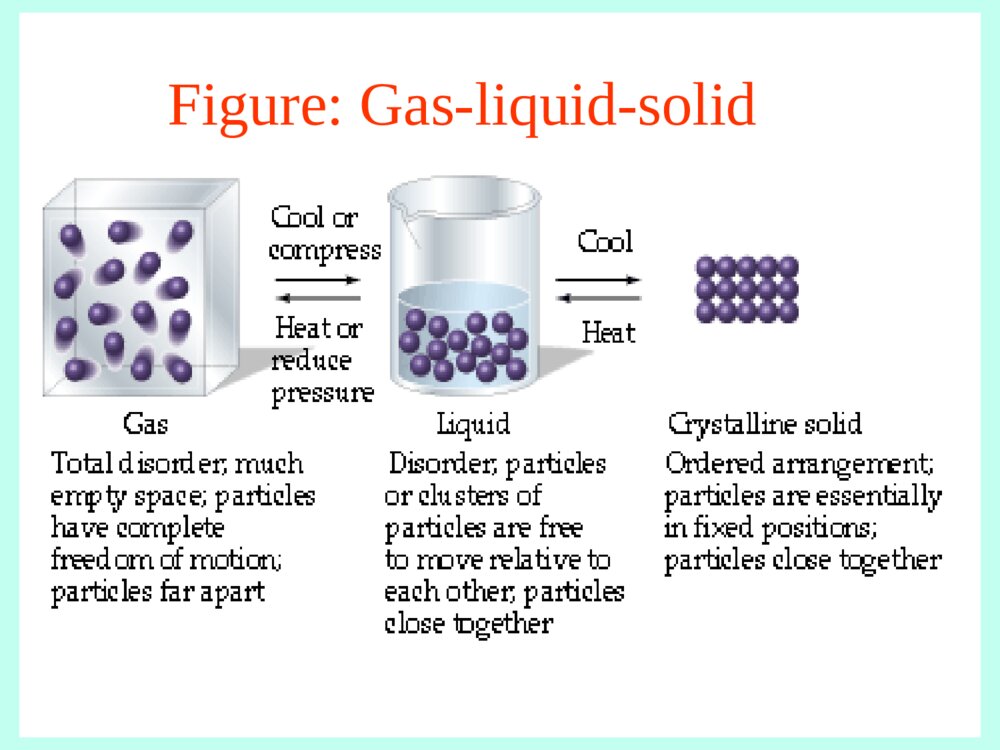
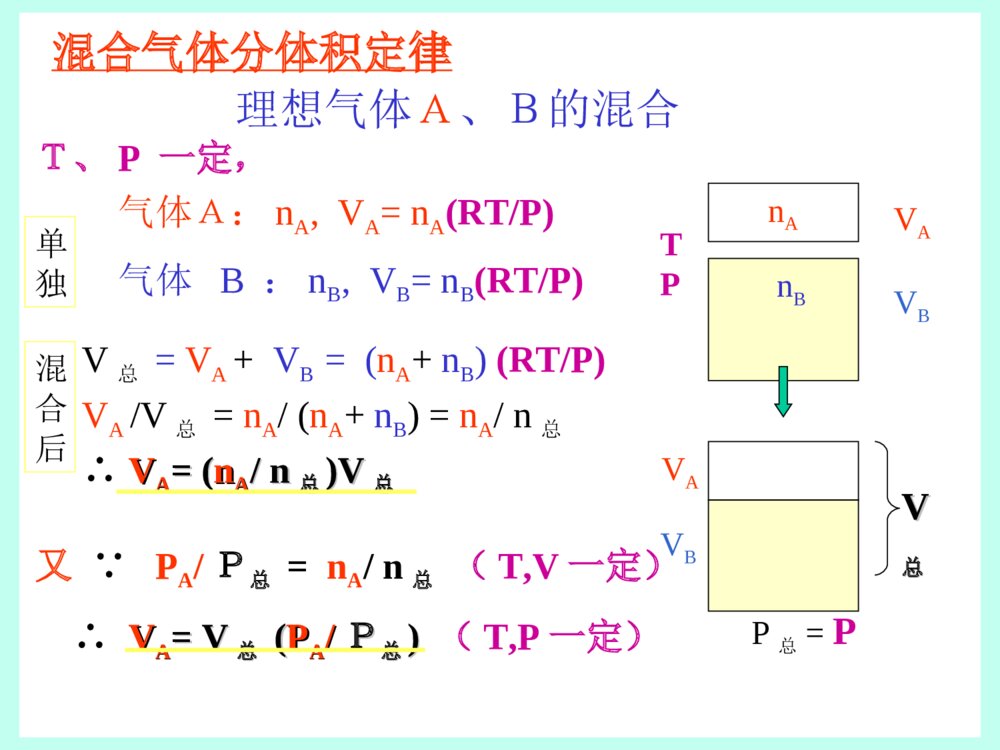
第一章气体 液体 溶液一、气体1理想气体状态方程2混合气体分压定律3实际气体和VanderWaals方程二、液体1气体的液化2液体的气化:蒸发、沸腾3蒸气压计算三、溶液的浓度(自学)(考试要求)1质量百分比浓度2质量摩尔浓度3摩尔分数浓度4物质的量浓度一、气体1理想气体状态方程物质的状态:固体液体气体气体分子间作用力,减弱密度,降低(有例外)(分子本身所占体积的比例)等离子体(Plasma)玻色-爱因斯坦凝结(Bose-Einsteincondensatestates)(请见ftp上有关资料)Figure:Gas-liquid-solid理想气体理想气体假定:分子不占有体积(忽略尺寸)分子间作用力忽略不计PV=nRT(理想气体状态方程)压力体积温度气体常数摩尔数适用于:温度较高或压力较低时的稀薄气体温度较高或压力较低时的稀薄气体气体状态方程的运用•R的取值随压力单位的变化而不同8.31kPa·dm3·mol-1·K-10.0821atm·dm3·mol-1·K-1•几种变化情况:波义耳(Boyle)定律:PV=衡量(T,n恒定)查理-盖•吕萨克(Charles-Gay·Lussac)定律:V/T=衡量(P,n恒定)阿伏加德罗(Avogadro)定律:V/n=衡量(T,P恒定)气体方程的运用•求分子量(摩尔质量)MPV=(m/M)RT(n=m/M)•求密度(m/VP(m/nRT=P(m/n)/(RT)M=m/n=(PM)/(RT)例题:计算摩尔质量惰性气体氙能和氟形成多种氟化物XeFx。实验测定在80oC,15.6kPa时,某气态氟化氙试样的密度为0.899(g·dm-3),试确定这种氟化氙的分子式。解:求出摩尔质量,即可确定分子式。设氟化氙摩尔质量为M,密度为(g·dm-3),质量为m(g),R应选用8.31(kPa·dm3·mol-1·K-1)。例题∵PV=nRT=(m/M)RT∴M=(m/V)(RT/P)=(RT/P)=(0.899×8.31×353)/15.6=169(g•mol-1)已知原子量Xe131,F19,XeFx∴131+19x=169x=2∴这种氟化氙的分子式为:XeF22混合气体分压定律T、V一定,气体A:nA,PA=nA(RT/V)气体B:nB,PB=nB(RT/V)P总=PA+PB=(nA+nB)(RT/V)∵PA/P总=nA/(nA+nB)=nA/n总∴PPAA==((nnAA//nn总总)P)P总总TVPAPBnBnA理想气体A、B的混合(A与B不反应)单独混合后P总混合气体分体积定律T、P一定,气体A:nA,VA=nA(RT/P)气体B:nB,VB=nB(RT/P)V总=VA+VB=(nA+nB)(RT/P)VA/V总=nA/(nA+nB)=nA/n总∴VVAA==((nnAA//nn总总)V)V总总又∵PA/P总=nA/n总(T,V一定)∴VVAA==VV总总((PPAA//PP总总))(T,P一定)TPVAVBnA理想气体A、B的混合单独nB混合后VV总总P总=PVAVB例例11A、B两种气体在一定温度下,在一容器中混合,混合后下面表达式是否正确?1PAVA=nART2PV=nART3PVA=nART4PAV=nART5PA(VA+VB)=nART6(PA+PB)VA=nART否否是是是是PP总总VV分分=P=P分分VV总总=n=n分分RTRT例例22在58°C将某气体通过一盛水容器,在100kPa下收集该气体1.00dm3。问:1.温度不变,将压力降为50.0kPa时,气体的体积是多少?2.温度不变,将压力增加到200kPa时,气体的体积是多少?3.压力不变,将温度升高到100°C时,气体的体积是多少?4.压力不变,将温度降至10°C时,气体的体积是多少?解题思路1.该气体与水蒸气的混合气体的总体积总体积,,nn总总不变,不变,P1V1=P2V22.压力增加会引起水蒸气的凝聚,但该气体的摩尔数没有变化,可以用该气体的分压来计算总体积:PP气气11VV11=n=n气气RTRT==PP气气22VV223.n3.n总总不变,不变,V1/T1=V2/T2=常数4.温度降低也会引起水蒸气的凝聚,但该气体的摩尔数没有变化,可以用该气体的分压来计算总体积:PP气气11VV11/T/T11=n=n气气RR=P=P气气22VV22/T/T22例例22在58°C将某气体通过一盛水容器,在100kPa下收集该气体1.00dm3。问:1.温度不变,将压力降为50.0kPa时,气体的体积是多少?2.温度不变,将压力增加到200kPa时,气体的体积是多少?3.压力不变,将温度升高到100°C时,气体的体积是多少?4.压力不变,将温度降至10°C时,气体的体积是多少?解:1.P1V1=P2V2100×1.00=50.0V2V2=2.00(dm3)2.58°C时,P水=18.1kPa,P气体=(100-18.1)kPaV2=(P气1×V1)/P气2=((100-18.1)×1.00)/(200-18.1)=0.450(dm3)3.V1/T1=V2/T21.00/(273+58)=V2/(273+100)V2=1.13(dm3)4.P1V1/T1=P2V2/T210°C时P水=1.23kPa,P气体=(100-1.23)kPa(100-1.23)V2/(273+10)=((100-18.1)×1.00)/(273+58)V2=0.709(dm3)3实际气体与VanderWaals方程理想气体:PV=nRT实际气体:Z=(PV)/(nRT)Z称为压缩系数Z=1为理想气体•分子间作用力:Z<1(内聚力使P减小)•分子占有体积:Z>1(V增大)偏离理想气体的程度,取决于:1.温度:T增加,趋向于理想气体2.压力:P减小,趋向于理想气体3.气体的性质:沸点愈高与理想状态偏差愈大温度愈升高,愈接近理想气体N2不同气体的比较(1摩尔,300K)气体Z-P图的讨论•常压常温下,沸点低的气体,接近理想气体•起初增加压力时,对于分子量较大的分子,分子间作用力增加占主导,使得Z<1•增加较大压力时,分子的占有体积占主导,使得Z>1VanderWaals方程(P+(P+aann22/V/V22)(V-n)(V-nbb)=nRT)=nRT其中,a、b为范德华常数a用于校正压力,是与分子间作用力有关的常数,分子间作用力与气体浓度的平方成正比b约等于气体凝聚为液体时的摩尔体积a和b,似与分子间作用力及其分子的质量有关。习题与思考题1.室温下,将1.0atm、10dm3的H2与1.0atm、20dm3的N2在40dm3容器中混合,求:H2、N2的分压、分体积、及摩尔比。2.在20°C、99kPa下,用排水取气法收集1.5dm3的O2,问:需多少克KClO3分解?2KClO3=2KCl+3O2(查水(20°C)的蒸气压为2.34kPa)习题与思考题解答习题与思考题解答1.解:1)求分压T一定,n不变(混合前后)P1V1=P2V21.0×10=×40=0.25(atm)1.0×20=×40=0.5(atm)2)求分体积VVAA==VV总总((PPAA//PP总总))==×=40=40×==13(dm3)==×=40=40×0.5/0.75=0.5/0.75=27(dm3)3)求摩尔比==0.25/0.5===0.25/0.5=0.5总V2NV2HP2HP2NP2NP2HV总PP2H总PP2N总V22NHnn22NHPP5.025.025.0习题与思考题解答习题与思考题解答2.解2KClO3=2KCl+3O22/31=RT=99–2.34=96.7(kPa)===0.060(mol)=2/3需KClO3=2/3×=2/3×0.0595×122.5=4.9(克)2OP2OP总V2On2On2OnRTVP2O总)20273(31.85.17.963KClOn2On3KClOM第一章小结一、理想气体状态方程1理想气体的概念2PV=nRT的运用、R的取值3密度和摩尔质量的计算PV=(m/M)RT,=(PM)/(RT)二、Dolton分压定律(混合气体)PA=(nA/n总)P总(T,V不变)VVAA=V=V总总(P(PAA//PP总总))(T,P一定)P总V分=P分V总=n分RT三、临界温度(Tc),临界压力(Pc),气液平衡lg(p2/p1)=Hvap/2.303R[(T2–T1)/T2·T1](R与H的单位要一致)四、质量浓度和体积浓度等(M和二液体二液体1.气体的液化问题:1)是否所有气体都可以液化?2)什么样的条件下可以液化?例:·冬天带眼镜进屋时,镜片会变得模糊。·家庭用液化气,主要成分是丙烷、丁烷,加压后变成液体储于高压钢瓶里,打开时减压即气化。但有时钢瓶还很重却不能点燃。是因为C5H12或C6H14等级烷烃室温时不能气化。温度温度压力压力气气体体性性质质TcTc以下,均以下,均可可临界现象临界现象Tb(沸点)<室温Tc<室温,室温下加压不能液化Tb<室温,Tc>室温,室温下加压可液化Tb>室温Tc>室温,在常温常压下为液体?临界常数:临界常数:•临界温度Tc:每种气体液化时,各有一个特定温度叫临界温度。在Tc以上,无论怎样加大压力,都不能使气体液化。•临界压力Pc:临界温度时,使气体液化所需的最低压力叫临界压力。•临界体积Vc:在Tc和Pc条件下,1mol气体所占的体积叫临界体积。均与分子间作用力及分子质量有关。2.2.液体的气化液体的气化::蒸发蒸发与与沸腾沸腾•蒸发:液体表面的气化现象叫蒸发(evaporation)。ab敞口容器干涸吸热过程分子的动能:红色:大黑色:中蓝色:低气体分子的动能分布气体分子的动能分布与蒸发的关系蒸发的关系分子的份数分子的动能蒸发所需分子蒸发所需分子的最低动能的最低动能•蒸发:密闭容器蒸发冷凝“动态平衡”恒温分子的动能:红色:大黑色:中蓝色:低ab饱和蒸气压:与液相处于动态平衡的这种气体叫饱和蒸气,它的压力叫饱和蒸气压,简称蒸气压。饱和蒸气压的特点:1.温度恒定时,为定值;2.气液共存时,不受量的变化;3.不同的物质有不同的数值。•沸腾沸腾:带活塞容器,活塞压力为P沸点与外界压力有关。外界压力等于101kPa(1atm)时的沸点为正常沸点,简称沸点。当温度升高到蒸气压与外界气压相等时,液体就沸腾,这个温度就是沸点。热源沸腾是在液体的表面和内部同时气化。ab例:水例:水的沸点为的沸点为100100°C°C,但在,但在高山上高山上,,由于大气压降低,由于大气压降低,沸点较低沸点较低,饭就难于煮,饭就难于煮熟。熟。而而高压锅高压锅内气压可达到约内气压可达到约10atm10atm,,水的沸点约在水的沸点约在180180°C°C左右,饭就很容易煮左右,饭就很容易煮烂。烂。“过热”液体:温度高于沸点的液体称为过热液体,易产生爆沸。蒸馏时一定要加入沸石或搅拌,以引入小气泡,产生气化中心,避免爆沸。•蒸气压曲线蒸气压曲线:曲线为气液共存平衡线;曲线左侧为液相区;右侧为气相区。蒸蒸气气压压温度正常沸点正常沸点•水及二氧化碳的相图:水及二氧化碳的相图:左图左图(a):(a):AA正常沸点;正常沸点;BB凝固点;凝固点;DD临界点临界点:218atm,:218atm,374374°C;°C;三相点三相点::0.00980.0098°C°C,4.58torr(6.10,4.58torr(6.10××101022Pa)Pa)。。压压力力温度温度COCO22常压下能以液体存在吗?常压下能以液体存在吗?3.3.蒸气压的计算蒸气压的计算•蒸气压的对数与的直线关系蒸气压的对数与的直线关系:lgp=A/T+BA=-(Hvap)/2.303RHvap为气体的摩尔蒸发热2.001.000.002.63.03.43.8T1×103/K-1T13.3.蒸气压的计算蒸气压的计算(描述气(描述气--液平衡)液平衡)•克拉佩龙克拉佩龙--克劳修斯克劳修斯Clapeyron-ClausiusClapeyron-Clausius方程方程:lgp=-(Hvap)/2.303RT+B温度T1时,lgp1=-(Hvap)/2.303RT1+B温度T2时,lgp2=-(Hvap)/2.303RT2+B两式相减,得lgp2–lgp1=-(Hvap)/2.303R(1/T2–1/T1)或lg(lg(pp22//pp11)=)=HHvapvap/2.303R/2.303R[(T[(T22––TT11)/T)/T22••TT11]]应用:1)计算液体的蒸发热;2)求蒸气压要注意R的单位与Hvap的单位一致。三、溶液的浓度溶液的浓度(自学)(考试要求)1质量百分比浓度2质量摩尔浓度3摩尔分数浓度4物质的量浓度第一章小结一、理想气体状态方程1理想气体的概念2PV=nRT的运用、R的取值3密度和摩尔质量的计算PV=(m/M)RT,=(PM)/(RT)二、Dolton分压定律(混合气体)PA=(nA/n总)P总(T,V不变)VVAA=V=V总总(P(PAA//PP总总))(T,P一定)P总V分=P分V总=n分RT三、临界温度(Tc),临界压力(Pc),气液平衡lg(p2/p1)=Hvap/2.303R[(T2–T1)/T2·T1](R与H的单位要一致)四、质量浓度和体积浓度等(M和习题:1.71.101.12



















